糖基转移酶反应的基质辅助激光解吸电离-飞行时间质谱法监测
2011-02-02周大炜吴俊丽齐源远
周大炜,刘 斌,吴俊丽,胡 波,齐源远
(1.南开大学泰达生物技术学院,天津 300457;2.天津市微生物功能基因组学重点实验室,天津 300457;3.南开大学分子微生物学与技术教育部重点实验室,天津 300457)
糖基转移酶反应的基质辅助激光解吸电离-飞行时间质谱法监测
周大炜1,2,3,刘 斌1,2,3,吴俊丽1,2,3,胡 波1,齐源远1
(1.南开大学泰达生物技术学院,天津 300457;2.天津市微生物功能基因组学重点实验室,天津 300457;3.南开大学分子微生物学与技术教育部重点实验室,天津 300457)
以w abD(大肠杆菌O77中O抗原基因簇内)编码的α-1,3-甘露糖转移酶、w fgD(大肠杆菌O152中O抗原基因簇内)编码的β-1,3-葡萄糖转移酶和w feD(志贺氏菌鲍氏O14中O抗原基因簇内)编码的β-1,4-半乳糖基转移酶酶促反应产物为研究对象,尝试应用碰撞诱导解离 (CID)负离子模式基质辅助激光解吸电离-飞行时间质谱 (MALD I-TOFM S)技术建立简单、高效的糖基转移酶监测方法。该方法首先直接用质谱分析0.3μL未经色谱分离、除盐处理的反应混合物,随后应用CID串联质谱技术对酶活反应产物进行结构表征,实现酶活反应的快速检测。研究结果表明,CID MALD I-TOFMS平台适用于新建克隆的糖基转移酶酶活反应的监测,与现有的高通量方法相比,在速度、灵敏度、重现性、自动化和溶剂消耗方面具有绝对优势。
脂寡糖;糖基转移酶;基质辅助激光解吸离子化-飞行时间质谱(MALD I-TOFMS)
糖基转移酶是负责催化合成系列糖复合物(如糖蛋白、糖脂和蛋白多糖中的糖苷键)的一类重要的酶。糖基转移酶的催化作用对于蛋白和脂翻译后修饰的糖基化反应至关重要,显著影响各种各样的分子-识别过程:如细菌/病毒感染、细胞黏着、免疫响应、细胞分化、生长和控制及很多其他细胞间的通讯和信号转导。研究发现,一些细菌中的糖基转移酶和宿主中相对应的糖基转移酶有结构上的同源区域[1],这是细菌为了逃避动物和人的免疫系统,其表面带有一些与人或动物细胞的糖链具有相似结构的结果。对合成这些糖的糖基转移酶的研究将对医疗和生物制药有着重要的意义。
尽管糖基转移酶有如此重要的作用和功能,但是从国内外的研究现状来说,对糖基转移酶的研究手段并不成熟,表现在现有超过20 000种已知序列可能编码此类酶的基因中(http://afmb.cnrs-m rs.fr/CAZY/),仅有不到5%的假定糖基转移酶基因的特定功能,在纯化制备酶促反应产物的基础上,应用核磁共振(NM R)技术得到了明确鉴定[2-3],关于这种多样性的细节所知甚少。
原则上,一个糖链的完整结构仅从NMR实验的综合就可以推导出来,这已成为糖基转移酶基因功能鉴定的首选方法[2-3]。但其主要缺点是灵敏度较低,特别是涉及耗时的分离纯化制备步骤。基质辅助激光解吸电离-飞行时间质谱(MALD I-TOF M S)能测定完整的糖链分子质量,同时还可以应用碰撞诱导解离(CID)技术进行寡糖序列测定,而且MALD I-TOFM S技术已成功用于多种酶的酶活监测[4-5]。因此,结合已知糖类生化合成途径的专业知识,可以胜任糖基转移酶酶活的监测和初步表征工作。本工作以本实验室前期应用NM R技术已证明其基因功能的3个糖基转移酶:w abD编码的α-1,3-甘露糖基转移酶(大肠杆菌 O77)、w fgD编码的β-1,3-葡萄糖基转移酶 (大肠杆菌 O152)和w feD编码的β-1,3-半乳糖基转移酶(志贺氏菌鲍氏O14)的酶促反应产物为研究对象,其化学结构示于图1,尝试通过MALD I-TOF MS技术分析酶活产物的形成,并在进一步应用 CID MALD I-TOF MS技术对酶活产物的结构进行表征的基础上,建立新的简单、高效、灵敏和准确的糖基转移酶活性监测方法。
1 材料与方法
1.1 试剂与仪器
基质辅助激光解吸电离-飞行时间质谱仪(4700 Proteomics Analyzer):美国 App lied Biosystem s公司产品。甲醇、乙腈(色谱纯):美国Fisher 公 司 产 品;α-氰 基-4-羟 基 肉 桂 酸(α-CHCA):美国 Fluka 公司产品;水为二次重蒸水;GDP-M an、UDP-Glc和 UDP-Gal:购自Sigma-A ldrich公司;本实验涉及的菌株、质粒、酶及其他生化试剂参见文献[6]。

图1 大肠杆菌O77,O152和志贺氏菌鲍氏O14 O抗原的化学结构Fig.1 The O-antigen structures of E.coliO77,O152 and S.boydiiO14
1.2 酶活反应
大肠杆菌O77和O152抗原中w abD基因、w fgD基因和志贺氏菌鲍氏O14抗原中w feD基因的克隆、含相应重组质粒的细菌培养及酶活反应细胞膜提取物的制备按文献[4]方法进行。由于w fgD、w feD和w abD与细胞膜之间存在相互作用,本工作利用含w abD或w fgD或w feD基因的重组质粒细胞膜部分作为酶的来源进行酶促反应。
标准40μL反应体系为:1 mmol/L受体GlcNAc-PP-PhU(空白对照以二次重蒸水替代),5 mmol/L M nCl2,75 mmol/L M ES buffer(p H 7),5 mmol/L GDP-M an(或UDP-Glc,或UDP-Gal)和10μL细菌膜提取物(含1~12 μg蛋白质,阴性对照分别以大肠杆菌DH5α和BL 21替代)。37℃水浴中反应15 min后,沸水浴中加热 3 m in,以 12 000 r/min离心 5 m in。将上清液稀释200倍后,取0.3μL待测液与等体积基质,滴于质谱靶样品点心,室温干燥,结晶后直接分析测试。
w abD酶促反应产物(Man-α-1,3-GlcNAcα-PO3-PO3-(CH2)11-OPh),w fgD酶促反应产物 (Glc-β-1,3-GlcNAc-α-PO3-PO3-(CH2)11-OPh)和w feD酶促反应产物(Gal-β-1,4-Glc-NAc-α-PO3-PO3-(CH2)11-OPh)的化学结构示于图2。
1.3 MALD I-TOFMS分析条件
基质为α-CHCA,激光器 Nd:YAG,波长355 nm,反射模式,负离子谱检测。串联质谱实验中,高能碰撞诱导解离(CID)碰撞小室内空气为碰撞气体,其压力维持在3.33×10-4Pa,碰撞能量1 kV。为质谱解析方便,暂且把预期的酶促反应产物——苯氧基十一烷基二磷酸二糖当成五糖(寡糖),苯氧基十一烷基和二磷酸基相应地分别代表1个和2个糖环。所有碎片应用Domon-Costello命名法识别[7]。

图2 wab D(a),w f g D(b)和w fe D(c)酶促反应产物的化学结构Fig.2 The structures of w ab D product(a),w f g D product(b)and w f e D product(c)
2 结果与讨论
2.1 wab D、w f g D和w fe D酶活性的质谱监测
在负离子模式下,分别利用含w abD、w fgD、w feD基因的重组质粒和大肠杆菌BL21(不含质粒)的细胞膜部分作为酶的来源进行酶促反应,MALD I-TOFM S谱图示于图3。这里,以w abD催化反应产物为例(图3c),丰度强的准分子离子峰m/z789.304 6[M-H]-与M an-GlcNAc-PP-PhU的分子质量相对应,显示w abD具有明显的甘露糖转移酶活性;而以大肠杆菌BL 21(不含质粒)的细胞膜作为酶活反应的阴性对照(图3a)和以水代替给予体底物(图3b)进行酶促反应的空白对照在酶活检测中均完全没有相应的糖基转移酶活性。证明反应中的甘露糖基转移酶活性由含有w abD基因的质粒产生。
同理可以证明:w fgD(图 3d)和w feD(图3e)反应中的葡萄糖和半乳糖基转移酶活性分别由含有w fgD和w feD基因的质粒产生。
到目前为止,已报道的糖基转移酶酶活性监测方法有放射性薄层层析法,色谱法[8],光谱法和质谱法[9]。这些方法或者需要放射性标记的给予体底物,或底物和产物都需要含发色团,或者需要特别的样品前处理(质谱法),普遍存在耗时长、实验程序繁琐等缺陷。本工作建立的MALD I-TOF M S分析法涉及的样品前处理仅需加热除蛋白和适当的稀释处理,从酶促反应开始到获得最终的质谱结果,整个过程不超过30 min。
2.2 wab D、w f g D和w fe D酶活性的初步表征
图4、5和6分别给出了负离子模式下w abD、w fgD和w feD反应产物分子离子的二级质谱图。这里以w abD催化反应产物为例,以m/z789.304 9[M-H]-为前体离子,观察到4个源于磷酸二脂键部分碎裂的MS2产物离子,分别为m/z444.574 9[B3],m/z524.626 5[B4],m/z462.603 4[C3]和m/z405.549 1[Z3];源于糖苷键断裂的产物离子有m/z241.296 6[Y4]和m/z423.569 9[Y3];m/z79.173 9[PO3]-和m/z159.097 9[HPO3PO3]-源于磷酸二脂键部分2个键的同时碎裂;未发现涉及开环的产物离子。
酶促反应产物二级质谱图中的 Y型离子,即m/z241.296 6[Y4]和m/z423.569 9[Y3]源于糖苷键的断裂,表明酶促反应产物二糖的连接序列为M an-GlcNAc-PP-PhU。
w f gD(图5)和w feD(图 6)反应产物分子离子的二级质谱图中的碎片离子组成同w abD(图4)基本一致,表明3种酶活产物的裂解机理相似。同理可以证明,相应的酶促反应产物二糖的连接序列分别为 Glc-GlcNAc-PP-PhU和Gal-GlcNAc-PP-PhU。

图 3 阴性对照(a)、空白对照(b)、wab D(c)、w f g D(d) 和w f e D(e)催化产物的MALD I-TOFMS谱图Fig.3 MALD I-TOFMS spectrum of negative con trol(a)、blank control(b)、wab D product(c)、w f g D product(d)and w fe D product(e)

图4 wab D催化反应产物的CID MALD I-TOFMS谱图Fig.4 CID MALD I-TOFMS spectrum of wab D product MS2 of m/z 789.304 9

图5 w f g D催化反应产物的CID MALD I-TOFMS谱图Fig.5 CID MALD I-TOFMS spectrum of w f g D product MS2 of m/z 789.303 4
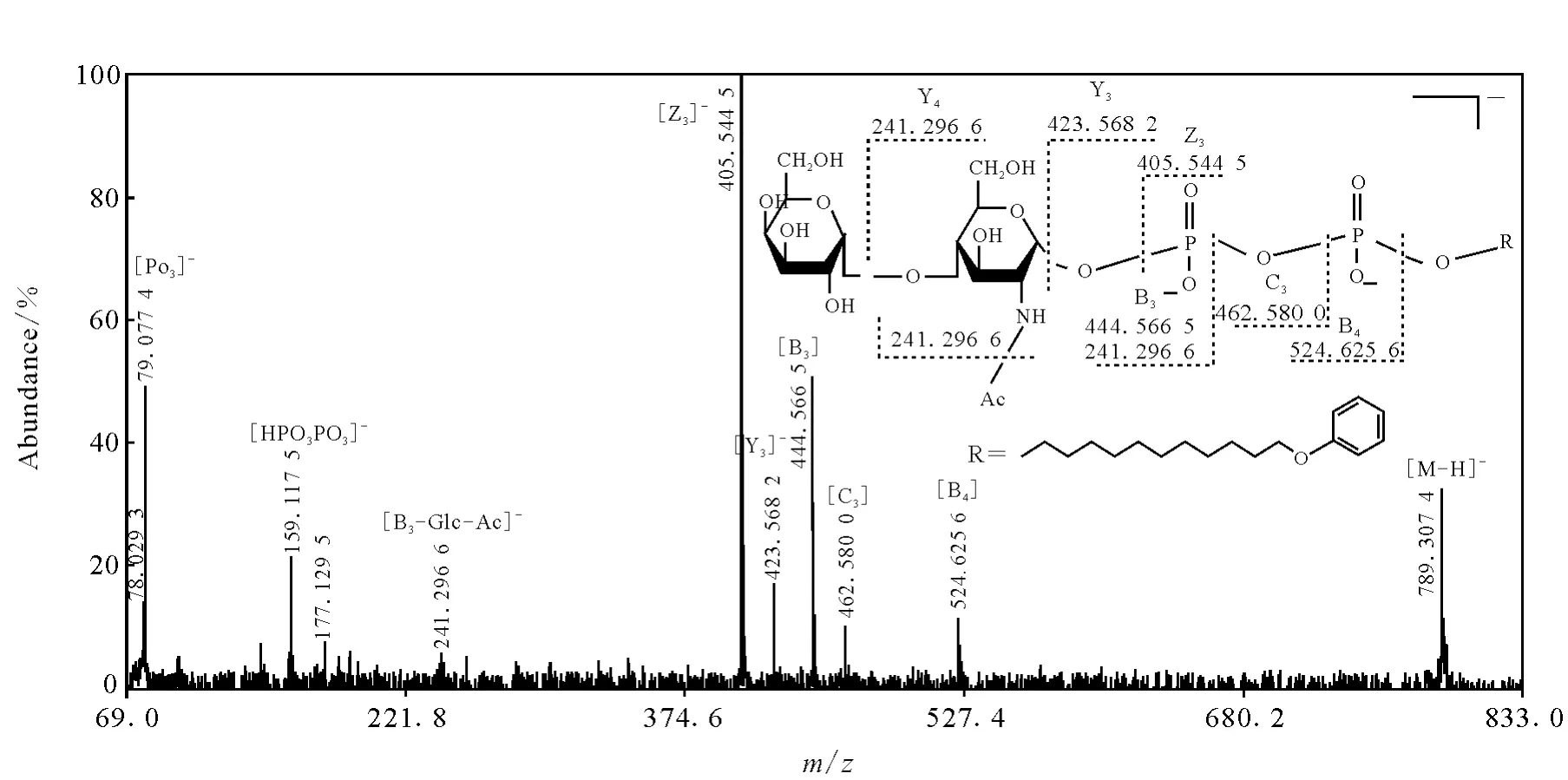
图6 w fe D催化反应产物的CID MALD I-TOFMS谱图Fig.6 CID M ALD I-TOFMS spectrum of w f e D product MS2 of m/z 789.307 4
3 结论
本工作研究了负离子模式下3种酶活产物(w abD基因、w fgD基因和w feD基因编码的)混合物的 MALD I-TOF M S和 CID MALD ITOF M S质谱表征,结果表明,w abD基因、w fgD基因和w feD基因分别具有葡萄糖、甘露糖和半乳糖基转移酶活性,这与已获得的2DNM R(600 M Hz)分析结果一致。本工作建立的简单、灵敏、快速、准确酶活监测手段和酶活性初步表征方法,对O-抗原生物合成路径中细菌糖基转移酶基因功能的高通量筛选具有普遍适用性,将为重组疫苗和应用生物技术大规模合成功能性糖链奠定基础。
[1]BA TCHELOR R A,HARAGUCH IG E,HULL R A,et al.Regulation by a novel protein of the bimodal distribution of lipopolysaccharide in the outer membrane of Escherichia coli[J].J Bacteriol,1991,173(18):5 699-5 704.
[2]YIW,YAO Q,ZHANG Y,et al.ThewbnH gene ofEscherichia coliO86:H2encodes an alpha-1,3-N-acetylgalactosaminyl transferase involved in the O-repeating unit biosynthesis[J].Biochem Biophys Res Commun,2006,344(2):631-639.
[3]YIW,PERAL IR S,EGUCH IH,et al.Characterization of a bacterialβ-1,3-galactosyltransferase with app lication in the synthesis of tumor-associated T-antigen mimics[J].Biochem,2008,47(5):1 241-1 248.
[4]XU Z,WANG H Y,HUANG S X,et al.Determination of beta-lactamase residues in milk using matrix-assisted laser deso rp tion/ionization Fourier transform mass spectrometry[J].Anal Chem,2010,82(5):2 113-2 118.
[5]XU Z,YAO S,W EIY,et al.Monitoring enzyme reaction and screening of inhibitors of acetylcholinesterase by quantitativematrix-assisted laser desorp tion/ionization Fourier transform mass spectrometry[J].J Am Soc Mass Spectrom,2008,19(12):1 849-1 855.
[6]BROCKHAUSEN I,HU B,L IU B,et al.Characterization of twoβ-1,3-glucosyltransferases fromEscherichia colisero types O56 and O152[J].J Bacteriol,2008,190(14):4 922-4 932.
[7]DOMON B,COSTELLO C E.A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugates[J].Glycoconjugate J,1988,5:397-409.
[8]NAGAHORIN,N ISH IMURA S.Direct and efficientmonito ring of glycosyltransferase reactionson gold colloidal nanoparticles by using mass spectrometry[J].Chemistry,2006,12(25):6 478-6 485.
[9]MONEGAL A,PINYOL R,PLANAS A.Capillary electrophoresis method for the enzymatic assay of galactosyltransferases with postreaction derivatization[J]. Anal Biochem,2005,346(11):115-123.
Monitoring of Glycosyltransferase Reactions by MALD I-TOFMass Spectrometry
ZHOU Da-wei1,2,3,L IU Bin1,2,3,
WU Jun-li1,2,3,HU Bo1,Q I Yuan-yuan1
(1.TEDA School of Biological Sciences and Biotechnology,N ankai University,Tianjin 300457,China;2.The Engineering and Research Center for Microbial Functional Genom ics and Detection Technology,Ministry of Education,Tianjin 300457,China;3.The Key Laboratory of Molecular Microbiology and Technology,Ministry of Education,Tianjin 300457,China)
Novel gram-negative bacteria have lipopolysaccharides terminating in repeating oligosaccharides which comp rise the O-antigen.The glycosyltransferases(GTs)assembling the O-chain utilize lipid-linked acceptor substrates and nucleotide sugar donor substrates.However,the lack of a rapid and simplemethod for monitoring glycosyltransferase activity p reclude the elucidation of the function of putative GTs.Mass spectrometry is a rapid,sensitive,and accurate approach for the direct monito ring of enzyme-catalyzed reactions that does not require a chromopho re or radiolabeling and thus provides a viable alternative to ex-
isting analytical techniques.In this study,a simple and efficient assay for glycosyltransferase activity by matrix-assisted laser desorp tion-ionization(MALD I)mass spectrometry with collision-induced dissociation(CID)was demonstrated byw abD(in E.coli O77 O-antigen gene cluste)enzymatic reaction,w fgD(in E.coli O152 O-antigen gene cluste)enzymatic reaction andw feD(in S.boydii O14 O-antigen gene cluste)enzymatic reaction,respectively.The rapid and direct detection of the enzymatic reaction w as achieved by subjecting a small amount(0.3μL)of the reaction mixture to M S analysis without chromatographic separation or desalting steps,and subsequent M S-M S analyses of the product via collision-induced dissociation enabled the structures of products of enzyme-catalyzed reactions to be determined.Collectively,these data demonstrate that CID MALD I-TOF M S based platform is applicable to the facile determination of the enzymatic activity of other new ly cloned glycosyltransferases and offers significant advantages over current H T Smethods in terms of speed,sensitivity,reproducibility,automation and reagent costs.
glucosyltransferase;lipooligosaccharide;matrix-assisted laser desorption-time of flight mass spectrometry(M ALD I-TOF M S)
O 657.63
A
1004-2997(2011)04-0193-07
2010-11-30;
2011-03-09
南开大学引进人才科研启动资金(No.J02006)资助
周大炜(1966~),女(汉族),吉林通化人,副研究员,功能基因组学专业。E-mail:daweizhou@nankai.edu.cn
