RA、SHH和bFGF体外诱导人牙髓干细胞向神经细胞分化的研究
2011-02-02张智慧胡伟平曹潇方
张智慧,胡伟平,郭 阳,曹潇方
(哈尔滨医科大学附属第二医院口腔修复科,黑龙江哈尔滨 150086)
RA、SHH和bFGF体外诱导人牙髓干细胞向神经细胞分化的研究
张智慧,胡伟平,郭 阳,曹潇方
(哈尔滨医科大学附属第二医院口腔修复科,黑龙江哈尔滨 150086)
目的:研究体外使用全反式维甲酸(all-trans-retinoic acid,RA)、音猬因子(sonic hedgehog,SHH)、碱性成纤维生长因子(fibroblastgrowth factor-basic,bFGF)体外诱导人牙髓干细胞(dental pulp stem cells,DPSCs)分化为神经细胞的可行性,以优化DPSCs向神经细胞分化的诱导条件。方法:从因正畸或阻生拔除的第一前磨牙或第三磨牙中提取牙髓,采用酶消化及过滤法得到单细胞悬液 ,有限稀释法培养分离的原代DPSCs,并进行克隆化培养,检测STRO-1的表达。将DPSCs分别接种于含有不同浓度诱导液,MTT法检测三种因子对细胞增殖能力的影响,免疫荧光法检测微管相关蛋白(microtubule-associated protein-2,MAP-2)、神经元烯醇化酶(neuron-specific enolase,NSE)、胶质原纤维酸性蛋白(glial fibrillary acid protein,GFAP)的表达。透射电镜观察诱导前后细胞超微结构。结果:克隆来源细胞的STRO-1表达阳性。三种因子联合诱导促增殖作用最强,与其他组比较,差异有统计学意义(P<0.05)。除对照组外,各诱导组均检测出神经元样细胞,其中以三因子联合诱导组阳性细胞表达率最高,促分化作用均优于其他组。透射电镜观察到神经元样细胞表现。结论:三因子联合可以在体外有效诱导人DPSCs转化为神经细胞。
人牙髓干细胞;全反式维甲酸;音猬因子;碱性成纤维生长因子;分化
[牙体牙髓牙周病学杂志,2011,21(2):72]
[Chinese Journal of Conservativedentistry,2011,21(2):72]
牙髓干细胞(dental pulp stem cells,DPSCs)的多向分化能力研究,既可以作为鉴定干细胞的标准之一,又可以获得多种功能的所需细胞,已成为近年来研究的热点。碱性成纤维生长因子(fibroblastgrowth factor-basic,bFGF)是中胚层和神经外胚层来源细胞的有丝分裂原,主要发挥促增殖效应;全反式维甲酸 (all-trans-retinoic acid,RA)是脊椎动物个体发育中最重要的诱导信号之一 ,是神经系统重要的形成素 ,也是中枢神经系统早期分化的重要参与者。音猬因子(sonic hedgehog,SHH)信号分子可以维持成年大脑中神经前体细胞生存的微环境。本实验采用胶原酶消化法[1],从牙髓中分离了DPSCs并进行克隆化培养,进一步探讨bFGF、RA和SHH是否具有诱导DPSCs向神经细胞分化的潜能,优化其诱导条件。
1 材料和方法
1.1 主要试剂和仪器
DMEM高糖型培养基(Gibco公司,美国);胎牛血清、胰蛋白酶、Ⅰ型胶原酶、dispase、RA、SHH、bFGF(sigma公司);抗微管相关蛋白(microtubuleassociated protein-2,MAP-2)、神经元烯醇化酶(neuron-specific enolase,NSE)、胶质原纤维酸性蛋白(glial fibrillary acid protein,GFAP)(Proptech公司,美国);CO2孵箱(Heraeus公司,德国);YJ-875型超净2工作台(苏州净化设备厂);倒置相差显微镜(Olympus公司,日本);台式低温高速离心机(Hettich公司,德国)、荧光显微镜Nikone800(BD公司,美国)。
1.2 方法
1.2.1 人牙髓干细胞(hDpscs)分离、培养[1]
收集因正畸或阻生新鲜拔除的健康人(15~29岁)第一前磨牙或第三磨牙,无菌条件下劈开牙冠,取出牙髓,0.01 mol/L灭菌PBS冲洗后剪成约1 mm×1 mm×1 mm小块,用体积分数为3g/L的Ⅰ型胶原酶和4g/L的dispase酶(1∶1)37℃消化1 h,轻轻吹打离散单细胞团块,将形成的单细胞悬液通过孔径为70 μm的细胞筛网,800 r/min离心5 min。将细胞沉淀用含体积分数为200 mL/L胎牛血清的高糖型DMEM培养液重悬后接种于5 mL培养瓶中进行静置原代培养,3d观察见细胞呈集落状生长,多数似成纤维状,少数为椭圆形或多角形。细胞生长达80%汇合时,2.5g/L胰酶消化、传代并进行克隆化培养。
1.2.2 人牙髓干细胞免疫荧光染色鉴定
取生长良好的克隆化第三代细胞爬片,进行stro-1检测。40 mL/L中性福尔马林固定15 min,1g/L Triton透化15 min,50g/L BSA封闭30 min,STRO-1抗体37℃孵育2 h,FITC标记IgM荧光二抗37℃作用30 min,DAPI染核(每步均用磷酸盐缓冲液PBS冲洗),牙髓成纤维细胞作为对照,水性封片剂封片,荧光显微镜下观察。
1.2.3 MTT 法检测 RA 、FGF、SHH 作用时dPSCs的增值情况
取第三代DPSCs以2×104接种于5块96孔板,每孔100 μL,调零孔不含细胞。常规培养12 h后,随机分为 4组。A:空白对照组;B:bFGF 20 ng/mL+RA0.5 μg/mL 诱 导 组;C:bFGF 20 ng/mL+SHH100 ng/mL诱导组;D:bFGF 20 ng/mL+RA0.5 μg/mL+SHH100 ng/mL 诱导组,每组设5个复孔。按以上分组,分别更换相应诱导液后,继续培养,毎天换液1次。于诱导培养后7d,各孔加入20 μL MTT,37 ℃静置4 h,吸弃上清液,加入150 μLdMSO,37 ℃震荡10 min。用酶标仪测各孔A492值。
1.2.4 RA、bFGF、SHH 诱导人dPSCs分化
分别将第三代DPSCs以2×104接种于铺片的24孔板中,常规培养12 h后,随机分为 A、B、C、D 4组(分组情况见1.2.3),每组设5个复孔。按分组分别更换相应诱导液后,继续培养,并分别于诱导培养后 1、3、5、7、10d,倒置相差显微镜观察细胞形态。
当观察到细胞形态出现明显的长突起并有折光性改变后,用免疫荧光法检测各组微管相关蛋白(MAP-2)、神经元烯醇(NSE)、胶质原纤维酸性蛋白(GFAP)的表达情况。具体步骤:各组细胞用40g/L多聚甲醛固定20 min,1g/L Triton透化15 min,50g/L BSA 封闭30 min ,加入抗 MAP-2、NSE、GFAP单克隆一抗,4℃过夜,加入羊抗鼠IgG,37℃反应1 h,每步都用PBS清洗后滴加DAPI,空白对照不加一抗。荧光显微镜下观察,并按以下公式计算细胞分化率。细胞分化率=阳性细胞数/细胞总数×100%。
1.2.5 DPSCs诱导培养后透射电镜观察
取克隆的牙髓干细胞按上述分组进行诱导培养7d后,扩大培养至约1×106~1 ×107/mL,0.01 MPBS洗一遍 ,胰酶消化,培养液重悬,收集至尖底塑料离心管中,2000 r/min离心10 min,弃上清,将细胞团块用25 mL/L戊二醛4℃固定2 h后 ,常规透射电镜标本固定、脱水、包埋、切片、染色、观察。
1.3 统计学分析
2 结果
2.1 细胞生长和形态
采用胶原酶消化法及过滤法得到的单细胞悬液,贴壁缓慢,12 h可见细胞呈不规则形,未完全伸展,24 h细胞呈类成纤维状,少数为多角形及不规则形。7d后见细胞呈集落状生长,中心部位密集(图1)。消化传代后,细胞仍呈克隆化生长(图2)。
2.2 STRO-1的表达
荧光显微镜下观察,克隆生长的人牙髓干细胞出现STRO-1阳性表达,细胞浆出现明亮的绿色荧光(图3),对照组细胞仅出现模糊的暗绿色背景。
2.3 MTT 法检测
诱导7d各因子联合诱导组与对照组比较,差异均具有统计学意义(P<0.05),其中三因子联合诱导组促增殖作用最强与其他各组相比差异具有统计学意义(P<0.05)(表1)。
表1 各组作用后细胞生长情况比较(±s)
*与空白对照组比较P<0.05;△与D组比较P<0.05
分组 A492值A组(培养液空白对照) 0.303±0.017△B 组(bFGF20 ng/mL+RA0.5 μg/mL) 0.888 ±0.023*△C 组(bFGF20 ng/mL+SHH100 ng/mL) 0.921 ±0.019*△D 组(bFGF20 ng/mL+RA0.5 μg/mL+SHH100 ng/mL) 0.968 ±0.015*
2.4 诱导后细胞生长和形态
各组细胞诱导后5d可出现突起伸长、胞体回缩、立体感和折光感增强等形态学变化,诱导后7d出现典型的神经细胞形态(图4)。但还有一部分细胞在诱导后并没有出现明显的形态学变化,提示只有一部分DPSCs发生分化。
2.5 免疫荧光染色
诱导7d免疫荧光显微镜观察发现除对照组(图5)外,其余各组均出现抗MAP-2、NSE、GFAP阳性细胞(图6~8),其中以D组诱导后阳性细胞表达率最高,与其他各组相比差异均具有统计学意义(P <0.05)(表2)。
表2 诱导后各组 MAP-2、NSE、GFAP阳性细胞表达率(%,±s)
*与对照组比较P<0.05;△与d组比较P<0.05
分组MAP-2 NSE GFAP A组(空白对照) 0.00±0.00△ 0.00±0.00△ 0.00±0.00△B 组(bFGF20 ng/mL+RA0.5 μg/mL) 33.21 ±2.364*△31.36 ±2.157*△21.39 ±2.528*△C 组(bFGF20 ng/mL+SHH100 ng/mL) 34.92 ±1.83*△ 33.02 ±2.15*△ 22.81 ±1.62*△D 组(bFGF20 ng/mL+RA0.5 μg/mL+ 35.47 ±2.15* 34.14 ±1.59* 24.02 ±2.20*SHH100 ng/mL )
2.6 透射电镜
对照组(图9)可见DPSCs细胞形态不规则、表面有大量的微绒毛、细胞核大、梭形不整、核浆比例大、核仁大而明显、常染色质占大部分、细胞质内线粒体嵴清晰、基质密度增加、核旁可见胞质丝结构丰富、粗面内质网扩张囊、粗面内质网腔内见蛋白粒子胞质丝。B组(图10)诱导后DPSCs细胞体积增加、有伪足、核小、核仁明显、细胞质内有大量的高尔基体、分化的细胞内可见粗面内质网聚集。C组(图11)、D组(图12)诱导后DPSCs细胞体积增加、有伪足、核小、核仁明显、细胞质内有大量的高尔基体、分化的细胞内可见粗面内质网聚集、游离核糖体出现。

图3 Stro-1阳性细胞(×200)
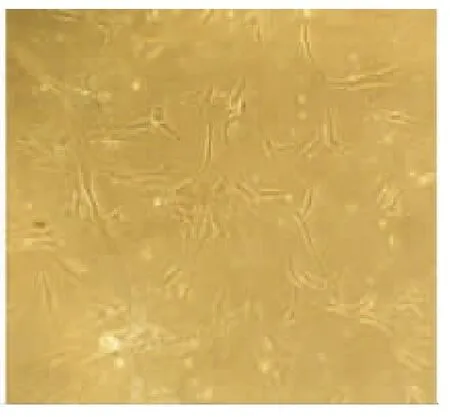
图4 三因子成神经诱导7d(×100)

图5 对照组(×200)
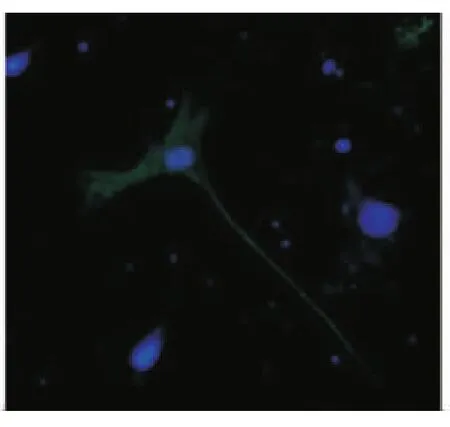
图6 MAP-2阳性细胞(×200)
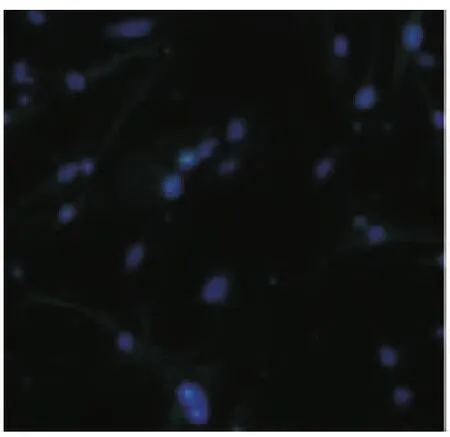
图7 NSE阳性细胞(×200)
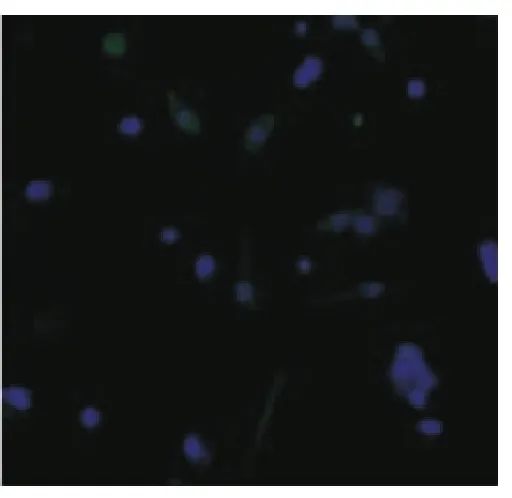
图8 GFAP阳性细胞(×200)

图9 原代人牙髓干细胞(×5 000)

图10 B组成神经诱导后人牙髓干细胞(×10 000)
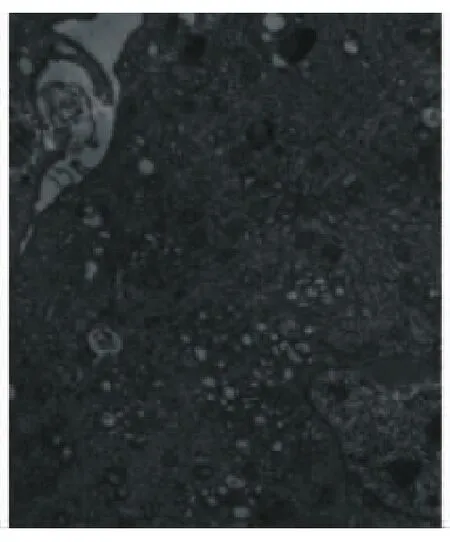
图11 C组成神经诱导后人牙髓干细胞(×10 000)
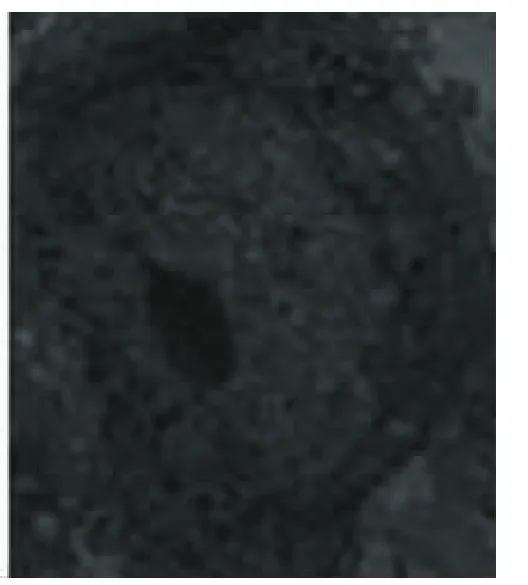
图12 D组成神经诱导后人牙髓干细胞(×10 000)
3 讨论
颅面部复合体及腮弓结构中大部分骨和结缔组织都来自于神经嵴细胞的迁移和分化。腮弓、咽囊及面部发育的调控非常复杂,所涉及的信号分子和基因很多。主要的信号分子有维甲酸、成纤维细胞生长因子(FGF)、转化生长因子(TGF)、SHH基因等。体内各种细胞因子之间有着复杂的相互作用,它们通过自分泌、旁分泌、内分泌作用产生效应。但全反式维甲酸(RA)、音猬因子(SHH)、碱性成纤维生长因子(bFGF)的作用研究尚未深入。
成体干细胞具有自我更新能力,在一定条件下能分化成特定的组织,又可实现跨胚层分化发育,即分化成在发育上与其无关的其他组织的细胞类型,称为可塑性或横向分化[2]。Gronthos等[1]研究发现人牙髓组织中存在一类未分化前体细胞,他们可终末分化为成牙本质细胞,并分泌细胞基质。将其与骨髓基质干细胞(Bone marrow stromal stem cells,BMSCs)比较发现他们同样具有成体干细胞横向分化的潜能,并将其命名为牙髓干细胞(dental pulp stem cells,DPSCs)。目前研究发现[3],DPSCs又可以向其他胚层的细胞如脂肪细胞、肌细胞、软骨细胞等方向分化。
目前关于成体干细胞可塑性的机制尚不十分明确,主要包括以下几种[4]:干细胞来源机制、去分化机制、细胞融合机制、一种组织中同时含有其他组织特定的细胞成分。干细胞来源机制[5]认为,成体干细胞是某种组织的胚胎干细胞遗留在成体组织中所引起的,机体各种组织中均应有发育过程中存留下来的未分化的干细胞。从牙齿发育角度看,Peters等[6]人认为,颅面部发育中颅神经嵴细胞群迁移至牙齿发育部位,凝聚形成的牙源性间充质细胞。此外,Stokowski等[7]发现牙髓干细胞在进行体外扩增时,检测到神经嵴细胞的表型。Nosrat等[8]发现在体外诱导大鼠DPSCs可以分化出现神经元形态,移入成年大鼠脑内发现细胞能够存活。从这个意义上说,可以认为牙髓干细胞也可能是牙齿发育过程中存留下来的干细胞。本实验中牙髓干细胞在三因子的作用下向神经细胞分化,可以认为其可能是牙齿发育过程中遗留在组织中的颅神经嵴来源细胞分化而来,这与Nakashima等[9]观点一致。
本实验中,抗微管相关蛋白(microtubule-associated protein-2,MAP-2)是成熟神经元特有的结构,有稳定神经元微管和保持神经元形态的作用,是突起胞浆中重要的组成部分;神经元烯醇化酶(neuron-specific enolase,NSE)抗原表达鉴定形成的神经元细胞;胶质原纤维酸性蛋白(glial fibrillary acid protein,GFAP)抗原表达鉴定星形胶质细胞,是DPSCs诱导分化为神经元的有力鉴定指标。免疫荧光法检测到三者的表达,可以认为DPSCs具有成体干细胞多向分化的潜能,可诱导其分化神经细胞。
MTT测定发现B、C、D组作用时均有促增殖作用,说明这三种因子能在细胞间传递信息,可以协同促进DPSCs生长。
免疫荧光检测发现B、C、D组出现神经元特异性标记NSE和MAP-2及神经胶质细胞标记GFAP的表达,B、C组有显著差异,三因子联合诱导D组优于前两组,是DPSCs向神经细胞方向分化较好的诱导方式。
尼氏体由聚集的粗面内质网与核糖体组成,是神经元样细胞的典型标志。B、C组均观察到疑似神经元的表现以及神经元的表现,即见粗面内质网与游离核糖体聚集,可认为幼稚尼氏体形成。三因子联合诱导的D组见诱导分化的细胞内有少量的尼氏体,可见粗面内质网聚集、游离核糖体出现。
综上所述,本实验中三种因子体外联合诱导牙髓干细胞,在形态上与超微结构上检测到DPSCs是向神经细胞分化,为获得神经组织工程种子细胞提供了新的思路,最终将会与胚胎干细胞[10]一样可以提供另一种干细胞来源治疗的神经疾病和损伤的治疗方法。但这种神经元样分化的细胞是否具有神经元细胞电生理、生物化学等功能和结构特点,尚有待于进一步的研究来确定。
[1]Gronthos S,Mankani M,Brahim J,et al.Postnatal humandental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625 -13630.
[2]Sata M,Saiura A,Kunisato A,et al.Hematopoietic stem cellsdifferentiate into vascular cells that participate in the pathogenesis of atherosclerosis[J].Nat Med,2002 ,8(4):403 -409.
[3]Zhang W,Walboomers XF,Shi S,et al.Multilineagedifferentiation potential of stem cellsderived from humandental pulp after cryopreservation[J].Tissue Eng,2006,12(10):2813 -2823.
[4]Verfaillie CM.Adult stem cells:assessing the case for pluripotency[J].Trends Cell Biol,2002,12(11):502 -508.
[5]McKinney-Freeman SL,Jackson KA,Camargo FD,et al.Muscle-derived hematopoietic stem cells are hematopoietic in origin[J].Proc Natl Acad Sci USA,2002,99(3):1341-1346.
[6]Peters H,Balling R.Teeth.Where and how to make them[J].Trendsgenet,1999,15(2):59 -65.
[7]Stokowski A,Shi S,Sun T,et al.EphB/ephrin-B interaction mediates adult stem cell attachment,spreading,and migration:implications fordental tissue repair[J].Stem Cells,2007,25(1):156-164.
[8]Nosrat IV,Smith CA,Mullally P,et al.Dental pulp cells provide neurotrophic support fordopaminergic neurons anddifferentiate into neurons in vitro;implications for tissue engineering and repair in the nervous system[J].Eur J Neurosci,2004,19(9):2388-2398.
[9]Nakashima M,Tachibana K,Iohara K,et al.Induction of reparativedentin formation by ultrasound-mediatedgenedelivery ofgrowth/differentiation factor 11[J].Humgene Ther,2003,14(6):591-597.
[10]Keirstead HS,Nistorg,Bernalg,et al.Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury[J].J Neurosci,2005,25(19):4694 -4705.
Effects of RA,SHH and bFGF to induce humandental pulp stem cells into neuron in vitro
ZHANG Zhi-hui,HU Wei-ping,GUO Yang,CAO Xiao-fang
(Department of Prosthodontics,the Second Affiliated Hospital of Harbin Medical University,Harbin 150086,China)
AIM:To examine the inducing effects of all- trans- retinoic acid(RA),sonic hedgehog(SHH)and fibroblastgrowth factor-basic(bFGF)from humandental pulp stem cells into neurons.METHODS:Humandental pulp was extracted from the first premolars or impacted third molars.A single cell suspension was acquaired by enzymaticdigestion and filtration.A limiteddilution method was used to culture the isolated primarydPSCs,which was expanded by cloning training.DPSCs in passage 3 were subjected todifferent inducing medium containing bFGF+RA,bFGF+SHH and bFGF+RA+SHH respectively.The proliferation of the induceddPSCs was measured by MTT method.Expression of microtubule- associated protein-2,neuron-specific enolase andglial fibrillary acidic protein wasdetected by immune fluorescent assay.The ultrastructure of the cells were examined by transmission electron microscopy(TEM).RESULTS:Positive expression of STRO-1 wasdetected in clone-derived cells.The inducing medium containing RA+SHH+bFGF showed the strongest proliferation capacity,with a significantly higher proliferation rate as compared with othergroups(P <0.05).Neuron-like cells were found in all threegroups,with most cell num-ber in the RA+SHH+bFGFgroup.CONCLUSION:The conbination of RA,SHH and bFGF could effectively inducedPSCs into neural-like and/orglia-like cells in vitro.
humandental pulp stem cell;all-trans-retinoic acid;sonic hedgehog;fibroblastgrowth factor-basic;differentiation
R780.2
A
1005-2593(2011)02-0072-05
2010-02-20;
2010-12-01
黑龙江省自然科学基金资助项目(D200856)
张智慧(1984-),女,汉族,黑龙江人。硕士生(导师:胡伟平)
胡伟平,Tel:0451-86297060,E -mail:HuWeiPing1963@163.com
