中晚期肺癌的放化疗与血清VEGF表达的关系
2011-01-30梁洪享季昆明宋琍琍丁颖丽
黄 燕,梁洪享,季昆明,宋琍琍,沈 柳,丁颖丽,丁 罡
上海交通大学医学院附属新华医院崇明分院肿瘤科,上海 202150
血管内皮生长因子(vascular endothelial growth factor,VEGF)是肿瘤的发生和转移所需要的血管生成因子之一,它是目前已知的作用最强的促血管生成因子。它通过刺激内皮细胞的增殖和迁移,并增加血管通透性,为肿瘤的生长提供氧气及其他营养物质,从而引起肿瘤的生长、转移。恶性肿瘤的分期、肿瘤负荷的大小、对治疗的反应及预后均与VEGF的含量有密切的关系。本课题通过检测晚期肺癌患者放化疗前后血清VEGF含量的变化,观察VEGF含量的变化与晚期肺癌放化疗患者的预后及病情进展等的关系,为治疗预后评价、随访复查及制定治疗方案的选择等提供依据。
1 资料与方法
1.1 一般资料
2007年6 月~2008年11月我院收治的中晚期非小细胞肺癌(Ⅲ~Ⅳ期)患者51例(实验组);均经病理和细胞学确诊,KPS≥70分,生存期大于半年,无远处转移,无恶液质及其他重要器官功能损害。符合入选标准的患者中,男43例,女 8 例;年龄 37~75 岁,平均(61.73±7.56)岁,中位年龄 63岁;腺癌24例,鳞癌27例。同期选取10例健康者作为对照组,其中,男 6 例,女 4 例;平均年龄(58.73±10.77)岁,中位年龄62岁。
1.2 标本收集
患者清晨空腹抽血4.0 ml置于肝素抗凝管,并离心(1 000 r/min)15 min,小心吸取上清液,冻存于-80℃超低温冰箱中保存,待收集到一个试剂盒的数量(96个)后再集中后测定,若标本发生溶血则重新采集。
1.3 方法与试剂
采用双抗夹心ELISA法检测。人VEGF酶联免疫吸附试验检测试剂盒由深圳莱伯克生物科技有限公司生产,由上海美季生物科技有限公司提供,检测步骤严格按照试剂盒说明书进行。
1.4 疗效评价标准
主要以患者治疗前后CT为依据,采用RECIST实体瘤近期疗效标准评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以(CR+PR)计算有效率。
1.5 统计学方法
采用SPSS 13.0统计软件处理数据,数据以均数±标准差(±s)表示,采用 t检验,以 P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清VEGF的比较
实验组治疗前的血清VEGF水平明显比对照组血清VEGF水平升高。见表1。
表1 两组血清VEGF的比较(±s)

表1 两组血清VEGF的比较(±s)
注:与对照组比较,t=3.62,P=0.000 6
实验组对照组组别 例数51 10血清VEGF浓度(ng/L)101.28±67.16*23.74±11.12
2.2 实验组血清浓度与疗效的关系
51例中晚期肺癌患者中,其中,29例接受1个疗程以上化疗和放射治疗,10例接受至少1个疗程化疗,5例接受单纯肺部局部放疗,7例接受对症支持治疗。治疗后疗效评价CR 7例,PR 26例,SD 14例,PD 4例。 治疗有效率(CR+PR)为64.7%。治疗有效患者血清浓度(70.00±33.88)ng/L显著低于治疗前浓度(90.30±61.12)ng/L,差异有统计学意义(P=0.006 5),肿瘤进展的患者血清浓度(101.60±52.79) ng/L 与治疗前浓度(121.41±74.63)ng/L相仿,差异无统计学意义(P=0.240 7)。见表2。
表2 实验组治疗前后血清浓度比较(±s)

表2 实验组治疗前后血清浓度比较(±s)
治疗前后 缓解(CR+PR)例数 血清VEGF浓度(ng/L)进展(SD+PD)例数 血清VEGF浓度(ng/L)治疗前治疗后t值P值33 33 90.30±61.12 70.00±33.88 2.92 0.006 5 18 18 121.41±74.63 101.60±52.79 1.22 0.240 7
2.3 实验组血清VEGF浓度与各临床病理参数之间的关系
51例中晚期肺癌患者放化疗前血清浓度与患者不同性别、不同年龄、不同病理类型均无统计学差异(P>0.05)。见表3。
2.4 放化疗效果与治疗前、后血清VEGF的关系
治疗前,放化疗有效组患者血清VEGF水平较无效组低,但差异无统计学意义(P=0.114 7);经治疗,放化疗有效组患者血清VEGF水平较无效组低,差异有统计学意义(P=0.012 2)。 见表4。
表3 实验组血清浓度与临床病理参数之间的关系(±s)

表3 实验组血清浓度与临床病理参数之间的关系(±s)
临床参数 例数 血清VEGF浓度(ng/L)t值P值性别男女43 8 105.820±70.664 76.838±38.056 1.120.266 5年龄(岁)≥60≤59病理鳞癌腺癌35 16 107.800±73.330 87.010±50.310 1.030.309 8 27 24 96.639±63.965 106.500±71.600-0.520.605 9
表4 有效组与无效组治疗前后血清VEGF的关系(±s)
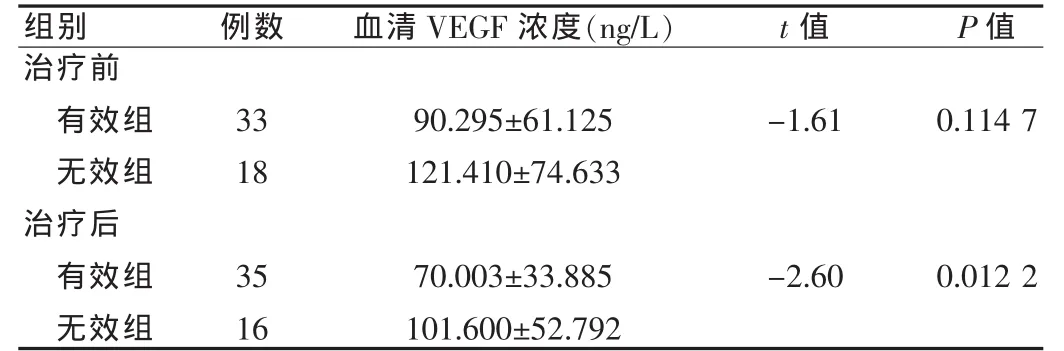
表4 有效组与无效组治疗前后血清VEGF的关系(±s)
组别 例数 血清VEGF浓度(ng/L)t值P值治疗前有效组无效组治疗后有效组无效组33 18 90.295±61.125 121.410±74.633-1.610.114 7 35 16 70.003±33.885 101.600±52.792-2.600.012 2
3 讨论
肿瘤的生长、侵袭、远处转移与肿瘤的新生血管生成密切相关,肿瘤组织通过分泌、调节、促进与抑制血管形成的细胞因子,诱导了新生血管的形成。其中,血管内皮生长因子(VEGF)是目前已知作用最强的肿瘤血管生成诱导因子[1]。VEGF又称血管通透因子(vascular permeability factor)或促血管因子(vasculotropin),是1989年从牛垂体滤泡星形细胞培养液内分离纯化出来的一类细胞因子。它的作用一方面能促进内皮细胞的增生、迁移,促进血管的形成,是一种对血管生长有强力诱导作用的细胞因子;另一方面,它具有增强血管通透性的作用,为肿瘤细胞的转移提供适合的基础[2]。在非小细胞肺癌(non-small-cell lung cancer,NSCLC)的肿瘤组织中VEGF表达阳性率约为64%[3]。目前,以VEGF靶点单克隆抗体贝伐单抗(Bevacizumab)已经在临床上应用于晚期直、结肠癌、非小细胞肺癌、乳腺癌和肾癌等的治疗,大量的临床随机研究证实贝伐单抗在联合化疗的治疗中取得的缓解率、中位生存期等方面均优于单纯化疗[4-5]。国内滕家俊等[6]临床研究证实抗肿瘤新生血管生成抑制剂重组人血管内皮抑制素(恩度)联合化疗治疗晚期非小细胞肺癌的临床疗效较单纯的使用一线、二线、三线的化疗方案有效率高。刘金等[7]通过沙利度胺抗VEGF治疗联合化疗、同步放疗治疗小细胞肺癌取得良好的近期效果。目前临床上普遍认为VEGF是促进肿瘤放疗拮抗、放疗后复发与转移的重要因素,是肿瘤放疗的预后指标,抗VEGF治疗协同放射治疗能提高疗效[8]。江丰收等[9]在非小细胞肺癌患者血清表达水平及其临床意义的研究中表明,VEGF在NSCLC的发生、生长和转移过程中起着极其重要的作用。
本研究即以血清作为标本,并排除了可能影响血清检测水平的其他病理因素。结果表明,化疗前血清VEGF、与血白细胞、血色素、血小板计数无相关性,基本未受血液成分的影响,故结果可靠。本研究结果与文献[8]报道相近,表明外周血中血管形成因子(VEGF)的高表达与肿瘤相关。进一步分析发现,血清VEGF浓度与肺癌患者病情的早晚及肿瘤进展程度有关。本研究51例中晚期肺癌肿瘤患者中,44例接受抗肿瘤治疗,其中75%(33例)的患者治疗后近期缓解患者,他们治疗后的血清VEGF浓度显着下降,低于治疗前血清浓度,结论与其他文献报道[8]的非小细胞肺癌、食管癌和鼻咽癌等恶性肿瘤治疗取得缓解的疗效后,血清中VEGF浓度也随之下降结论一致。随治疗好转,血清中VEGF表达水平下降考虑与抗肿瘤治疗后肿瘤细胞分泌的作用得到抑制、相应的肿瘤负荷有所减轻有关。因此通过化验肿瘤患者治疗前后血清VEGF水平的变化可以动态监测病情及治疗的效果。
肺癌患者血清VEGF浓度与患者性别、年龄及病理类型无明显相关性。本研究51例中晚期肺癌肿瘤患者分别按性别、年龄及病理类型三个临床病理因素分组比较,不论其是否接受抗肿瘤治疗,治疗后有无缓解,治疗前分别比较,均未发现肺癌患者血清VEGF水平与这三个主要的临床病理因素有相关性(P>0.05)。此结论与文献报道的相符[10-11]。
本研究51例患者按放化疗效果的不同分治疗有效组及无效组,结果有效组和无效组治疗前血清VEGF水平无明显差异,而治疗后两者差异明显。结果提示治疗前血清VEGF水平尚不能预测肺癌放化疗治疗效果的敏感性,而治疗后1周的血清VEGF水平可以预测治疗的敏感性及疗效。此结论与国内部分研究[12]报道的肺癌组织表达VEGF阴性者具有较高的放射敏感性,近期疗效较理想有相似之处。但笔者认为从患者治疗后血清VEGF水平的检测结果预测治疗敏感性更加方便及临床易于开展,预测结果比治疗前定性检测更加准确。但由于本研究病例数太少,导致VEGF测定值变化范围较大,存在一定的不足,下一步拟积累更多的放化疗的肺癌病例及血清标本VEGF的测定并进行动态观察,评价放化疗联合抗血管生成的靶向治疗对预后及疗效的影响。
[1]李晓平,张清富,陆斌.等.DLL4、VEGF在肺腺癌中的表达及其与肿瘤血管生成的关系[J].中国肺癌杂志,2009,9(8):2035-2036.
[2]Hicklin DJ,Ellis LM.Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis[J].J Clin Oncol,2005,23(5):1011-1027.
[3]刘孝民,李志娟,王红岩,等.VEGF与非小细胞肺癌预后的相关性研究[J].临床肿瘤学杂志,2007,12(2):88-90.
[4]Sandler A,Gray R,Perry M,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2542-2549.
[5]Miller KD,Sledge GW,Burstein HJ.Angiogenesis inhibition in the treatment of breast cancer a review of studies presented at the 2006 san Antonio breast cancer symposium[J].Clin Adv Hematol Oncol,2007,5(3):1-12.
[6]滕家俊,韩宝惠,沈洁,等.重组人血管内皮抑制素联合治疗30例晚期非小细胞肺癌的临床研究[J].临床肿瘤学杂志,2008,13(2):171-175.
[7]刘金,黄京子,余淑坤.同步放疗、化疗联合沙利度胺治疗小细胞肺癌的临床研究[J].中国医药导报,2009,6(5):24-25.
[8]黄燕,丁罡.肿瘤放射治疗与血管内皮生长因子[J].医学综述,2010,16(2):211-213.
[9]江丰收,王刚,孙玉蓓.非小细胞肺癌患者血清表达水平及其临床意义[J].临床肿瘤学杂志,2008,4(13):325-329.
[10]王鸿彪,林英城,林文照,等.晚期恶性肿瘤血清VEGF含量测定的临床意义[J].临床肿瘤学杂志,2008,13(2):126-128.
[11]赵忠全,余宗阳,谢启超,等.非小细胞肺癌患者血清血管内皮生长因子C的水平及临床意义[J].中国肿瘤临床,2008,35(12):690-692.
[12]李绪彤.肺癌VEGF和IGF-1R的表达与放射敏感性相关性的研究[D].沈阳:中国医科大学,2005.
