日本毛连菜水洗部位降血糖、调节血脂作用研究
2011-01-30席啸虎高建平
席啸虎,葛 睿,高建平
山西医科大学药学院,山西太原 030001
日本毛连菜(Picris japonica Thunb.)为菊科二年生草本植物,全草入药,又名羊下巴、毛柴胡[1]。据《中华本草》记载,日本毛连菜具有理肺止咳、化痰平喘、宽胸理气之功效,民间口服日本毛连菜防治糖尿病。由于西药的刺激性,国内已经出现越来越多的中药降糖药,但大多都以总提物入药[2-3],进一步寻找具有降血糖作用的有效部位并明确其化学成分,有利于药物剂型的改进、剂量的控制[4-6]。本实验在课题组前期研究基础上,采用肾上腺素致小鼠生理性高血糖,以及四氧嘧啶致小鼠糖尿病等模型,筛选日本毛连菜水洗部位的给药剂量,并且对其化学成分进行分析及含量测定,同时初步探讨其在调节血脂水平方面的作用。
1 材料与方法
1.1 药材、药物与试剂
实验用日本毛连菜采自山西省娄烦县,经山西医科大学药学院高建平教授鉴定为菊科毛连菜属二年生草本植物日本毛连菜(Picris japonica Thunb.),蜡叶标本存放于山西医科大学中药标本室。四氧嘧啶(美国Sigma公司);葡萄糖试剂盒(中生北控生物科技股份有限公司,批号:102401.201010);总胆固醇试剂盒(中生北控生物科技股份有限公司,批号:101051.201007);三酰甘油试剂盒(中生北控生物科技股份有限公司,批号:104101.201008);高密度脂蛋白试剂盒(中生北控生物科技股份有限公司,批号:100361)低密度脂蛋白试剂盒(中生北控生物科技股份有限公司,批号:100271);格列本脲(天津力生制药股份有限公司,批号:1003013);芦丁标准品(中国药品生物制品检定所,批号:100080.200707);其余所用试剂均为分析纯。
1.2 实验动物
昆明种小鼠,体重18~22 g,清洁级,雌雄各半,由山西医科大学实验动物中心提供。本实验所有动物饲养条件一致,开始实验前3 d置本实验室观察饲养,自由摄食、饮水,各组饲料与饮用水来源均相同。
1.3 仪器
旋转蒸发器 RE-52AA(上海亚荣生化仪器厂);752紫外可见分光光度计(上海精密科学仪器有限公司);离心机LXJ-IIB(上海安亭科学仪器厂);电子天平BS-124S(北京赛多利斯仪器系统有限公司)。
1.4 实验方法
1.4.1 日本毛连菜水洗脱组分的制备 称取日本毛连菜100 g,加15倍的水回流提取2次,每次1 h,4层纱布过滤,合并滤液,减压浓缩至100 ml,浓缩液经400 g D101大孔吸附树脂分离,用4倍柱体积的蒸馏水洗脱,洗脱液浓缩至100 ml,摇匀,即得。
1.4.2 对四氧嘧啶致糖尿病小鼠血糖及血脂的影响 小鼠尾静脉注射新鲜配制的四氧嘧啶50 mg/kg造成糖尿病模型,72 h后,对禁食不禁水的小鼠眼眶后静脉丛采血,测血糖值,选取空腹血糖高于11.1 mmol/L的小鼠用于实验。取合格模型小鼠50只,随机分为5组,格列本脲组(10只),日本毛连菜水洗部位低、中、高剂量组(每组各10只),糖尿病模型组,另取重量相近的正常小鼠作为正常组(10只)。连续给药14 d后,于末次给药前小鼠禁食不禁水8 h,给药后继续禁食不禁水后2 h,摘眼球取血,测定各组的空腹血糖值、总胆固醇含量、三酰甘油含量、高密度脂蛋白含量、低密度脂蛋白含量。
1.4.3 对肾上腺素致糖尿病小鼠血糖的影响 取合格昆明种小鼠60只(雌雄各半),随机分为6组,日本毛连菜水洗部位低、中、高剂量组(每组10只)和格列本脲组(10只)剂量同“1.4.2”,模型组(10 只)和正常组(10 只)灌胃等体积生理盐水,连续给药10 d。于末次给药前小鼠禁食不禁水8 h,给药后继续禁食不禁水6 h后,除对照组外,每只小鼠腹腔注射肾上腺素0.2mg/kg,正常对照组则腹腔注射等容量生理盐水。30 min后,眼眶后静脉丛采血,测定各组的空腹血糖值。
1.4.4 日本毛连菜水洗部位成分分析 将日本毛连菜水洗部位配制成1 g生药材/ml的供试品溶液,分别取1 ml用于各类成分的检测:生物碱检查,加6滴1%的盐酸,再加3滴生物碱沉淀剂;酚、醌类检查,加1滴1%三氯化铁溶液;内酯类检查,加入1%氢氧化钠溶液,在沸水中反应4 min之后,加2滴盐酸溶液;甾萜类检查,溶液蒸干后用酸酐溶解,加入1滴浓硫酸;多糖类检查,Molish反应;皂苷类检查,香草醛-浓硫酸试液;黄酮类检查,采用NaNO3-AlNO3-NaOH系统。
1.4.5 日本毛连菜水洗脱部位总黄酮含量测定 精密称取干燥至恒重的芦丁标准品18.60 mg,用60%的乙醇(V/V)配制成0.186 mg/ml的芦丁标准溶液。精密吸取芦丁标准溶液0 ml、0.5 ml、1.0 ml、2.0 ml、3.0 ml、4.0 ml、5.0 ml, 各加 60%乙醇至5.0 ml,加5%亚硝酸钠溶液0.3 ml,6 min后加10%的硝酸铝溶液0.3 ml,6 min后加4%的氢氧化钠溶液4.0 ml,加蒸馏水定容至10.0 ml,放置15 min,试样空白作参比,在波长505 nm处测定其吸光度。以浓度C为横坐标,吸光度A为纵坐标得回归方程:A=0.014 6 C-0.006 2(r=0.999 1),芦丁在 9.3~93.0 g/ml之间线性关系良好。精密量取日本毛连菜供试品溶液适量,按照标准曲线方法显色后测定其吸光度,代入回归方程,计算总黄酮含量。
1.4.6 日本毛连菜水洗部位总多糖含量测定 精密称取无水葡萄糖10.4 mg,加水溶解配制成104 μg/ml的标准溶液。取标准溶液 0.1 ml、0.2 ml、0.4 ml、0.6 ml、0.8 ml、1.0 ml,各加蒸馏水至 2.0 ml,苯酚 1.0 ml,摇匀,迅速滴加浓硫酸 5.0 ml,摇匀,沸水浴15 min后,冷却至室温。在490 nm处测定吸光度值。以浓度C为横坐标,吸光度值A为纵坐标,得回归方程:A=0.015 6 C-0.007 6(r=0.999 4),葡萄糖在 5.2~52.0 μg/ml之间线性关系良好。精密量取日本毛连菜总供试品溶液适量,按照标准曲线方法显色后测定其吸光度,代入回归方程,计算多糖含量。
1.5 统计学处理
2 结果
2.1 对四氧嘧啶致糖尿病小鼠血糖的影响
连续给药14 d后,日本毛连菜水洗脱物低、中、高剂量组的小鼠血糖值与模型组相比均有显著性下降(P<0.05),其低剂量组降糖效果最佳(13.42±2.86)mmol/L,与格列本脲组小鼠血糖值差异无统计学意义(P>0.05),结果见表1。追加2个剂量组(0.4 g/kg、0.8 g/kg),连续给药 14 d后,各组小鼠空腹血糖值显著高于1.5 g/kg剂量组(P<0.05)。见图1。
表1 日本毛连菜水洗部位对四氧嘧啶糖尿病小鼠血糖的影响(±s)Tab.1 Hypoglycemiceffectofparteluatedbywaterfrom Picrisjaponica Thunb.ondiabeticmiceestablishedbyinjecatofAlloxan(±s)

表1 日本毛连菜水洗部位对四氧嘧啶糖尿病小鼠血糖的影响(±s)Tab.1 Hypoglycemiceffectofparteluatedbywaterfrom Picrisjaponica Thunb.ondiabeticmiceestablishedbyinjecatofAlloxan(±s)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
组别 剂量(g/kg) 只数格列本脲组水洗低剂量组水洗中剂量组水洗高剂量组模型组正常组0.002 1.5 3.0 6.0--10 10 10 10 10 10给药前血糖(mmol/L)23.64±7.97 23.06±7.41 22.98±5.92 23.49±6.81 21.52±6.08#5.78±0.63给药7d血糖值(mmol/L)13.23±2.08*13.56±1.58*18.52±1.93*16.91±2.03*20.93±4.39#5.87±0.38给药14 d血糖值(mmol/L)13.51±1.39*13.42±2.86*14.92±2.36*17.24±2.15*19.93±3.01#6.41±0.65

2.2 对肾上腺素致糖尿病小鼠血糖的影响
给药10 d后,腹腔注射盐酸肾上腺素,模型组小鼠血糖值显著高于正常组(P<0.05);给药组小鼠血糖值均显著低于模型组(P<0.05);高剂量组小鼠血糖值最低(7.27±1.23)mmol/L,与格列本脲组没显著性差异(P>0.05)。结果见表2。增加2个剂量组(12 g/kg和 18 g/kg),降糖效果均不及(6 g/kg)剂量组(P<0.05),结果见图 2。

2.3 对四氧嘧啶致糖尿病小鼠血脂水平的影响
给药14 d后,与正常组比较,糖尿病组小鼠TC、TG、LDL-C含量显著升高(P<0.05),HDL-C 含量显著下降(P<0.05);与模型组比较,给药组小鼠 TG、LDL-C含量显著下降(P<0.05),HDL-C 含量显著升高(P<0.05)。 见表3。
2.4 日本毛连菜水洗部位成分分析及含量测定
日本毛连菜水洗部位主要含有多糖和黄酮类成分以及少许的酚醌类和皂苷类化合物。多糖和黄酮的含量分别为4 097 mg/100 g生药材和913 mg/100 g生药材。
3 讨论
3.1 日本毛连菜水洗部位降糖剂量探讨
在实验过程中,发现四氧嘧啶致糖尿病小鼠的最佳给药剂量为实验用药的低剂量(1.5 g/kg),因此,继续追加了2个低剂量组(0.8 g/kg和0.4 g/kg),结果降糖效果均不及1.5 g/kg剂量组;肾上腺素致糖尿病小鼠的最佳给药剂量为实验用药的高剂量(6 g/kg),继续追加2个高剂量组(12 g/kg和18 g/kg),降糖效果均不及6 g/kg剂量组。本实验结果表明日本毛连菜水洗脱部位对于四氧嘧啶以及肾上腺素致糖尿病小鼠模型的最适宜给药剂量分别为1.5 g/kg和6.0 g/kg。由于剂量的不一致性,初步推测可能是因为起效的成分或者作用的途径不同,其具体的降糖机制以及药用成分需要进一步探讨。
表2 日本毛连菜水洗部位对肾上腺素糖尿病小鼠血糖的影响(±s)Tab.2 Hypoglycemic effect of part eluated by water from Picris japonica Thunb.on diabetic mice established by injection of Epinephrine(±s)

表2 日本毛连菜水洗部位对肾上腺素糖尿病小鼠血糖的影响(±s)Tab.2 Hypoglycemic effect of part eluated by water from Picris japonica Thunb.on diabetic mice established by injection of Epinephrine(±s)
注:与正常对照组比较,#P<0.05;与模型对照组比较,*P<0.05
组别 剂量(g/kg)1.5 3.0 6.0 0.002水洗低剂量组水洗中剂量组水洗高剂量组格列本脲组模型组正常组--只数10 10 10 10 10 10血糖值(mmol/L)10.35±2.08*10.44±1.83*7.27±1.23*7.97±0.65*17.26±0.45#5.50±0.31
表3 日本毛连菜水洗部位对四氧嘧啶糖尿病小鼠血脂的影响(±s)Tab.3 Hypolipidemiceffectofparteluatedbywaterfrom Picrisjaponica Thunb.ondiabeticmiceestablishedbyinjectionofalloxan(±s)
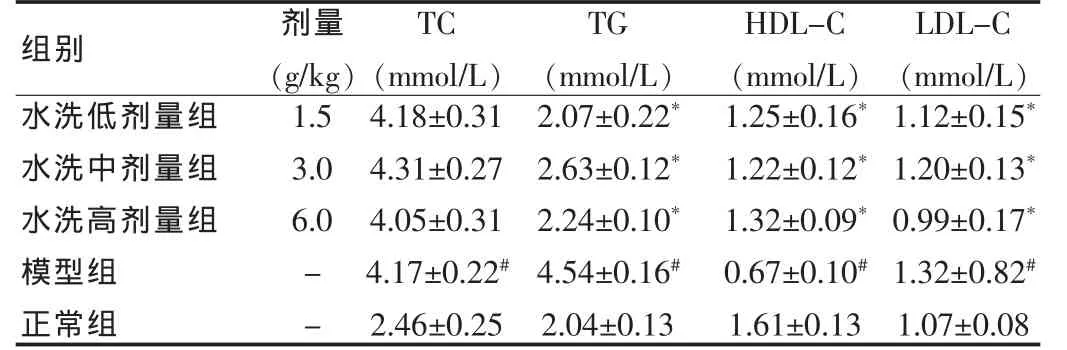
表3 日本毛连菜水洗部位对四氧嘧啶糖尿病小鼠血脂的影响(±s)Tab.3 Hypolipidemiceffectofparteluatedbywaterfrom Picrisjaponica Thunb.ondiabeticmiceestablishedbyinjectionofalloxan(±s)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
组别 剂量(g/kg)TC(mmol/L)水洗低剂量组水洗中剂量组水洗高剂量组模型组正常组1.5 3.0 6.0--4.18±0.31 4.31±0.27 4.05±0.31 4.17±0.22#2.46±0.25 TG(mmol/L)2.07±0.22*2.63±0.12*2.24±0.10*4.54±0.16#2.04±0.13 HDL-C(mmol/L)1.25±0.16*1.22±0.12*1.32±0.09*0.67±0.10#1.61±0.13 LDL-C(mmol/L)1.12±0.15*1.20±0.13*0.99±0.17*1.32±0.82#1.07±0.08
3.2 日本毛连菜水洗部位调节血脂作用探讨
糖尿病又称血脂病,糖尿病患者常可见血脂代谢紊乱[7]。本实验结果表明,日本毛连菜水洗脱物对四氧嘧啶致糖尿病小鼠不仅具有显著的降血糖作用,而且可以显著降低糖尿病小鼠TG、LDL-C含量以及升高HDL-C含量,其中以高剂量组在降低糖尿病小鼠低密度脂蛋白的含量方面表现的最明显[从(1.32±0.82) mmol/L 降至(0.79±0.17)mmol/L)]。
3.3 日本毛连菜水洗部位降糖成分探讨
文献报道,多糖类物质具有降血糖作用,降糖机制主要为促进胰岛素的分泌,从而降低血糖值[8]。日本毛连菜水洗部位含有较多的多糖类化合物(4 097 mg/100 g生药材,占日本毛连菜水洗部位质量的73.12%),且降糖效果与格列本脲没有显著性差异,初步推测日本毛连菜多糖为降血糖的主要成分之一,但其具体的降糖作用及降糖机制需要进一步研究。
[1] 钱崇澍,陈焕镛.中国植物志[M].北京:科学出版社,2004:53.
[2]Gao D,Li Q,Liu Zh,et al.Hypoglycemic effects and mechanisms of action of Cortex Lycii Radicis on alloxan-induced diabetic mice[J].Yakugaku Zasshi,2007,127(10):1715-1721.
[3]Jung CH,Seog HM,Choi IW,et al.Effects of wild ginseng(Panax ginseng CA.Meyer)leaves on lipid peroxidation levels and antioxidant enzyme activities in streptozotocin diabetic rats[J].J Ethnopharmacol,2005,98(3):245-250.
[4]Cao H,Polansky MM,Anderson RA.Cinnamon extract and polyphenols affect the expression of tristetraprolin,insulin receptor,and glucose transporter 4 in mouse 3T3-L1 adipocytes[J].Arch Biochem Biophys,2007,459(2):214-222.
[5]LeeMS,SohnCB.Anti-diabeticpropertiesofChrysophanolanditsglucoside from Rhubarb rhizome[J].Biol Pharm Bull,2008,31(11):2154-2157.
[6]Niu HS,Liu IM,Cheng JT,et al.Hypoglycemic effect of Syringin from eleutherococcus senticosus in Streptozo-tocin-Induced diabetic rats[J].Planta Med,2008,74(2):109-113.
[7]Budoff MJ,Takasu J,Flores FR,et al.Inhibiting progression of coronary calcification using aged garlic extract in patients receiving statin therapy:a preliminary study[J].PrevMed,2004,39:985-991.
[8]Tadashi Kiho.Effect of a polysaccharide (TAP)from the fruiting bodies ofTremella auranitia on glucosemetabolism in mouseliver[J].Biotechnol Blichem,2000,64(2):417.
