结缔组织生长因子、血管内皮生长因子、缺氧诱导因子-1α在胰腺癌中的表达及临床意义
2011-01-30刘建生智仁厚
郑 刚,刘建生,智仁厚
山西医科大学第一医院普外科,山西太原 030001
“肿瘤微环境”的概念由美国Anderson肿瘤研究中心的Ioannides和匹兹堡大学的Whiteside第一次正式提出[1],肿瘤发生、发展过程中所处的内环境除了有各种因子的相互作用外,由于肿瘤的快速增长,耗氧较多,从而形成了一个缺氧的微环境。结缔组织生长因子(connective tissue growth factor,CTGF/CCN2)是1991年Bradham等应用血小板源性生长因子抗体筛选人类脐静脉内皮细胞cDNA文库时首次发现,可与多种因子相互作用,在细胞的增殖、黏附、迁移以及血管生成、炎症反应和组织重构等过程中发挥重要的调节作用。目前在胰腺癌中的作用还不明确,尤其是其在体内和体外环境中对胰腺癌细胞的作用争议较大。可能与胰腺癌特殊的肿瘤微环境有关。血管内皮生长因子(vascular endothelial growth factor,VEGF)是促血管生成重要的因子之一,在很多病理生理情况下的血管形成中发挥重要作用。缺氧诱导因子-1(laypoxia.inducible factor-1,HIF-1)在肿瘤的抗缺氧代谢中起中枢纽带的作用。本研究通过免疫组化技术检测胰腺癌和癌旁正常组织中CTGF、VEGF、HIF-1α的表达情况,探讨其相互关系。
1 材料与方法
1.1 材料
收集山西医科大学第一医院普外科2003年1月~2009年12月行手术切除的胰腺癌标本46例,经病理诊断均为导管腺癌。其中,男22例,女24例;年龄31~77岁,平均(58.23±10.31)岁。术前均未接受放化疗,临床资料完整。另取10例癌旁胰腺组织作为对照。
1.2 方法
标本经福尔马林固定,石蜡包埋切片,切片厚度为4 μm,HE染色复述病理组织学特征,再进行Envision两步法免疫组化染色,光镜观察。用已知胰腺癌阳性切片做阳性对照,用0.05%PBS液代替一抗作阴性对照。一抗CTGF(sc-14939 Santa Cruz产品),及其对应二抗兔抗羊PV9003(Santa Cruz产品);一抗VEGF、二抗鼠抗兔 PV6001、染色试剂盒均购自北京中衫公司;一抗HIF-1α购自北京博奥森公司。经预实验,三者的最佳浓度均调至1∶100,CTGF用EDTA液高温高压修复2.5 min,VEGF、HIF-1α用枸橼酸钠液高温高压修复2 min,其余步骤均按使用说明书进行操作。
1.3 结果判断
CTGF、VEGF、HIF-1α的阳性判断为细胞浆出现棕黄色颗粒。400倍镜下任取5个视野,在双盲条件下,由2名病理科主任医师对切片进行观察,结果判定采用半定量积分分级。采用胡骁的标准[2],标准如下,
①染色强度:0分为无色,1分为浅黄色,2分为棕黄色,3分为棕褐色。②阳性细胞数:0分为阳性细胞占0%,1分为25%,2分为 26~50%,3分为 51~75%,4分为>75%。以上两项积分相加为分级标准:0 分为(-),2~3 分为(±),4~5 分为(+),6~7 分为(++),其中(+)和(++)判定为阳性。
1.4 统计学分析
应用SPSS 17.0统计软件进行分析,计数资料用χ2检验及Spearman等级相关检验作统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 CTGF、VEGF和HIF-1α在胰腺癌和癌旁正常组织中的表达
CTGF、VEGF和HIF-1α在正常胰腺组织中均为0(0/10)表达,而在癌组织中均高表达,阳性率分别为45.7%(21/46)、71.7%(33/46)、76.1%(35/46),差异有统计学意义(P<0.01)。
2.2 CTGF、VEGF和HIF-1α表达与胰腺癌生物学行为的关系
CTGF在胰腺癌组织中的表达水平与性别、肿瘤部位无关,而与年龄、临床分期、病理分级、淋巴结转移情况等有关(P<0.05),年龄越大、分化程度越低,临床分期越晚,阳性表达率越高。VEGF和HIF-1α在胰腺癌组织中的表达只与临床分期有关(P<0.05),与其他肿瘤生物学行为无关。见表1。
2.3 CTGF、VEGF和HIF-1α在胰腺癌中表达的相关性
经相关性检测,CTGF 与 VEGF、HIF-1α;VEGF 与 HIF-1α 之间的 Spearman 相关系数分别为:r=0.575、r=0.483、r=0.082,即三者两两间均存在正相关关系(均P<0.01)。
3 讨论
肿瘤微环境对胰腺癌的形成和发展发挥了重要作用,肿瘤在快速生长的过程中,消耗大量的氧,形成缺氧的局部微环境。体外实验显示,小鼠胰腺原位移植瘤VEGF表达明显增加,而异位移植瘤的VEGF表达不明显,说明胰腺原位微环境可促进癌细胞VEGF表达,增进血管生成[3]。VEGF是血管生成的主要调节者,能促进内皮细胞生长,并具有血管通透性作用[4],增加肿瘤局部环境的血流量,促进肿瘤侵袭和转移。
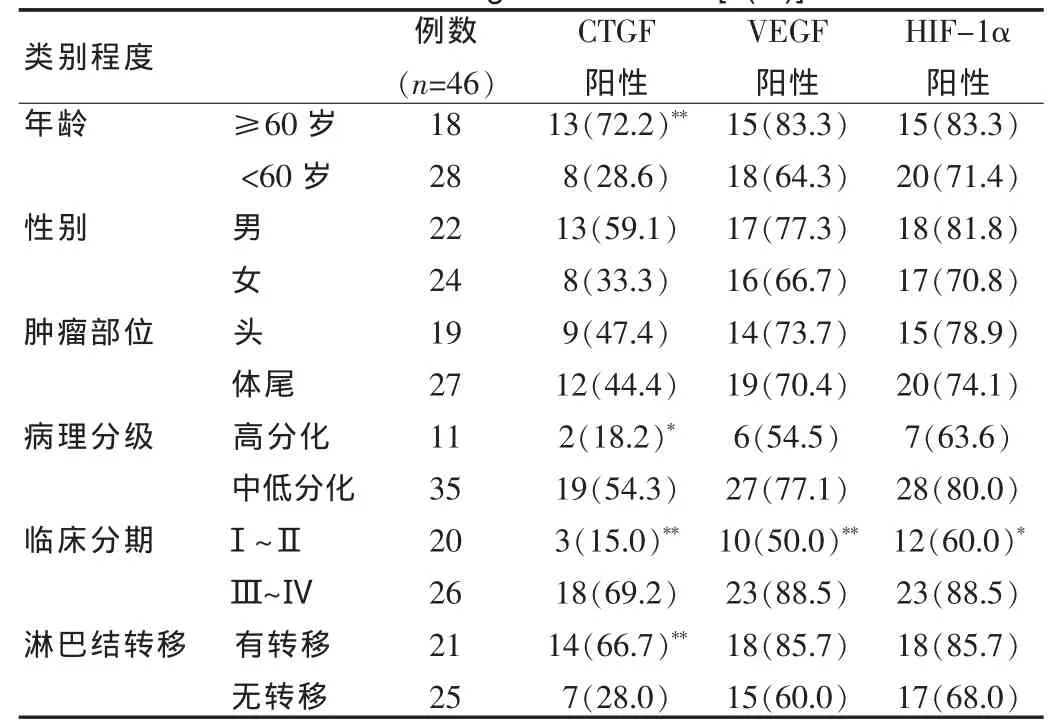
表1 CTGF、VEGF和HIF-1α表达与胰腺癌生物学行为的关系[n(%)]Tab.1 Relationship between expressions of CTGF,VEGF,HIF-1α and tumor biological behaviour[n(%)]
HIF-1α是HIF-1的调节及活性亚基,在缺氧环境下作为机体细胞特异性应答的中介产物,诱导多种因子生成对抗缺氧,VEGF是其最重要的靶基因,HIF-1α上调VEGF表达并增强其稳定性,对胰腺癌的生长、浸润起重要作用。Biichler等[5]发现胰腺癌中HIF-1α mRNA表达上调,且与VEGF mRNA表达呈正相关,说明HIF-1α通过上调VEGF表达来促进血管生成,促进胰腺癌生长。
CTGF在结缔组织丰富的胰腺癌组织发生发展过程中起到重要作用[6],但具体作用还不明确。苏燕等的研究表明CTGF在体外对胰腺癌细胞的生长有抑制作用[7]。但是Bennewith等[8]研究发现内源性的CTGF在体内环境下高表达,并且对胰腺癌的生长发展起重要作用;抑制内源性CTGF表达,胰腺癌细胞的生长在体外及皮下均受到明显抑制,而CTGF在胰腺癌组织中的作用主要是对抗缺氧;在体外试管缺氧条件下,同样可以检测到CTGF的高表达。缺氧能诱导CTGF表达,CTGF和VEGF在血管的生成重构中起重要作用[9]。CTGF在不同环境下对胰腺癌细胞的不同作用,很可能跟缺氧微环境的条件有关。
本研究通过检测CTGF、VEGF和HIF-1α,三者在46例胰腺癌组织中均存在异常高表达。CTGF的表达随着恶性程度的增高而增加,并与淋巴结的转移及年龄有关,提示CTGF的表达增高与胰腺癌的发生、发展,肿瘤恶性程度,淋巴结转移有关。VEGF和HIF-1α在46例癌中分别有33、35例表达,显著高于癌旁组织(P<0.01)。肿瘤的临床分期越晚,VEGF和HIF-1α的表达越高,提示两者与胰腺癌的发生、发展有密切关系。CTGF、VEGF和HIF-1α三者在胰腺癌中的表达,两两之间均呈正相关,提示三者在胰腺癌的缺氧微环境中共同对抗缺氧,促进肿瘤的生长和发展起重要作用。CTGF在胰腺癌组织的病理分型及淋巴结转移上可作为一个较好的临床检验指标。联合检测CTGF、VEGF和HIF-1α的表达可作为预测胰腺癌预后的一个客观指标,对胰腺癌的预后判断有重要意义。
[1]Ioannides CG,Whiteside TL.T cell recognition of human tumors:implications for molecular immunotherapy of cancer[J].Clin Immunol Immunopathol,1993,66(2):91-106.
[2]胡骁.TGF-β1、HIF-1α、VEGF在胰腺癌中的表达及临床意义[D].青岛大学硕士论文,2009.
[3]Teraoka H,Sawada T,Nishihara T,et al.Enhanced VEGF production and decreased immunogenicity induced by TGF-beta 1 promote liver metastasis of pancreatic cancer[J].Cancer,2001,85(4):612-617.
[4]Wang GL,Semenza GL.Characterization of hypoxia-inducible factor 1 and regulation of DNA binding activity by hypoxia[J].Biol Chem,1993,268(29):21513-21518.
[5]Büchler P,Reber HA,Büchler M,et al.Hypoxia-inducible factor 1 regulates vascular endothelial growth factor expression in human pancreatic cancer[J].Pancreas,2003,26(1):56-64.
[6]Aikawa T,Gunn J,Spong SM,et al.Connective tissue growth factor-specific antibody attenuates tumor growth,metastasis,and angiogenesis in an orthotopic mouse model of pancreatic cancer[J].Mol Cancer Ther,2006,5(5):1108-1116.
[7]苏燕,李宏伟,崔培林,等.转化生长因子-β1通过促进结缔组织生长因子表达抑制胰腺癌细胞PANC-1增殖[J].现代医学生物进展,2007,7(12):1761-1764.
[8]Bennewith KL,Huang X,Ham CM,et al.The role of tumor cell-derived connective tissue growth factor(CTGF/CCN2)in pancreatic tumor growth[J].Cancer Res,2009,69(3):775-784.
[9]吴贤敏,唐琼兰,谢贤镛,等.CTGF与肿瘤的研究进展[J].川北医学院学报,2007,22(6):609-612.
