白芍提取物活性成分芍药苷大鼠在体肠吸收动力学的研究
2011-01-30梁文革刘新颜
蔡 郁,梁文革,刘新颜
北京老年医院药剂科,北京 100095
本品为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根[1]。白芍始载于《神农本草经》,列为中品。古人用芍药“主治结实而拘挛也。旁治腹痛、头痛、身体不仁、疼痛满腹、咳逆下利、肿脓”。性苦,微寒;归肝经。有清热凉血,散瘀止痛之功效[2]。现代药理实验证明白芍的主要药理活性成分为芍药苷为代表的芍药总苷。主要药理作用为芍药苷具有镇静、镇痛作用,能延长环己巴比妥钠对小鼠的睡眠时间,对五甲烯四氮唑所致的惊厥有拮抗作用;芍药苷能扩张冠状动脉,增加冠脉血流量,对抗急性心肌缺血,抑制血小板聚集及降低血压等作用;此外芍药苷还具有抗炎、抗溃疡、抗过敏、解热、解痉等作用[3-4]。对于指导各种制剂的处方设计,研究药物的肠道吸收机制及部位,尤其是设计缓控释制剂的处方具有重要意义。离体法、在体法和体内法等是研究药物肠吸收动力学的方法[5-11]。离体法明显优于在体法,因为没有损坏研究部位的淋巴和血液循环系统。其中单向灌流模型被广泛应用,因有吸收速率稳定、与人体有良好的相关性的优点[7-11]。因此本文采用单向灌流重量法对白芍提取物中芍药苷的肠吸收动力学进行研究,以期为芍药苷口服缓控释给药制剂的现代化研究提供生物药剂学依据。
1 材料
1.1 仪器与试药
LC-10ATVP型高效液相色谱仪(日本岛津公司),SPDM20A型检测器(日本岛津公司);BT00-100M型蠕动泵(保定兰格恒流泵有限公司)。芍药苷对照品(Paeoniflorin,批号:36-200016,中国药品生物制品检定所);白芍提取物(徐州弘康科技有限公司);乌拉坦(进口分装);乙腈(色谱纯,山东禹王试剂公司);其他试剂均为分析纯。Krebs-Ringer缓冲液(K氏液,pH=6.8):葡萄糖 1.49 g、氯化钾 0.35 g、氯化镁 0.02 g、氯化钙 0.36 g、氯化钠 7.8 g、碳酸氢钠 1.36 g、磷酸二氢钠0.02 g加水定容至1 L。
1.2 动物
实验用 Wistar健康大鼠,雄性,体重(250±20)g,由沈阳药科大学实验动物中心提供。
2 测定方法与结果
2.1 芍药苷HPLC的测定
色谱柱:CEC C18 柱(4.6 mm×200 mm,5 μm); 保护柱:CEC C18柱(4.6 mm×10.0 mm,5 μm);流动相:乙腈-磷酸二氢钠水溶液(0.1 mol/L)(体积比为 20∶80);柱温:30℃;检测波长:230 nm;流速:1.0 ml/min;进样量:20 μl。
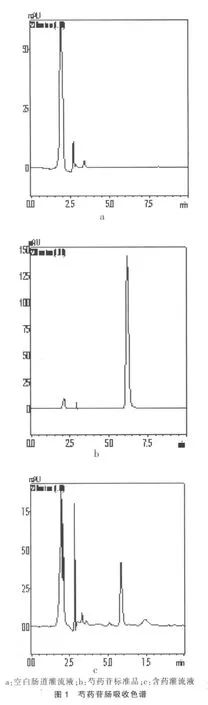
2.2 芍药苷方法学验证
精密称取对照品芍药苷1.00 mg,放置在10 ml容量瓶中,芍药苷标准溶液:以空白灌流液溶解并定容,浓度为100.0 mg/L,芍药苷标准曲线的制备:以空白灌流液配成芍药苷浓度分别为 2.0、5.0、8.0、10.0、20.0、50.0 mg/L。 使用 0.45 μm滤膜,分别取上述芍药苷标准溶液滤过,弃去初滤液,取续滤液20 μl进样。以峰面积A为横坐标,浓度C(mg/L)为纵坐标进行线性回归,得芍药苷标准曲线方程为:C=6.34×10-5A-1 287.4(r=0.999 9)。 2.0~50.0 mg/L线性关系良好。 回收率:5.0、10.0、50.0 mg/L 浓度下的回收率均大于 99%(n=5);精密度:日内、日间RSD均小于3%(n=5)。
2.3 稳定性的考察
3份9.80 mg/L的芍药苷溶液用空白肠灌流液配制,在37℃水浴中孵育 6 h,取样时间分别为 0、1、2、3、4、6 h,样品注入液相色谱仪进行分析,记录峰面积,得RSD=1.04%(n=6),表明芍药苷在灌流液中6 h内稳定。
2.4 白芍提取物中芍药苷含量的测定
取适量白芍提取物用水溶解,溶液用HPLC测定峰面积计算芍药苷含量,结果为36.5%(n=5)为芍药苷。
3 大鼠在体肠单向灌流法
3.1 实验步骤
为了消除实验过程中管路对药物的吸附作用,应在实验前用供试液将管道饱和至出液口药液浓度与供试液浓度相等为止。大鼠实验前禁食一夜(自由饮水),腹腔注射乌拉坦溶液(20%,0.5 ml/100 g),固定于恒温手术台上。沿腹中线剪开腹部(3~4 cm),对考察的取约10 cm于两端剪切后插直径为0.3 cm的玻璃管,用预热至37℃的生理盐水对所取肠道进行冲洗,清除其内容物,再用空气将生理盐水排净。将肠管两端的玻璃管与蠕动泵的胶管连接,形成回路。开动蠕动泵,以流速0.2 ml/min进行灌流,用已知重量的小瓶在出口处每隔15 min收集一次,作为一个取样点,同时用下一个已知重量的小瓶替换,计算收集前后小瓶重量称量差,同时测定收集液中药物浓度。实验结束后处死大鼠并剪下被灌流的肠段,测量其长度和内径。
3.2 肠道吸收水分的校正
在灌流药液之前,用空白K氏液灌流个肠段,以进行方法学验证,并对水分对灌流液重量影响进行校正。
4 数据分析
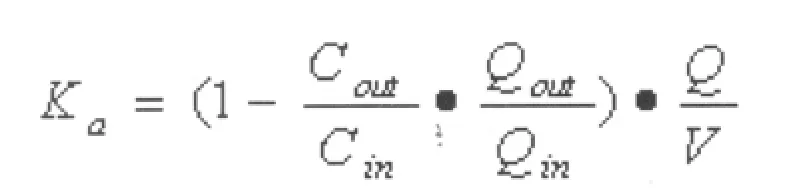
4.1 药物吸收速率常数(Ka)的计算
4.2 药物表观吸收系数(Papp)的计算
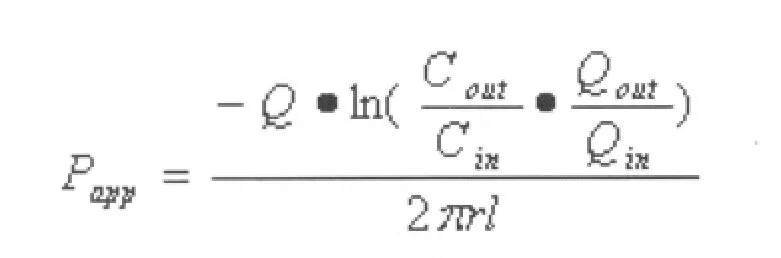
以上公式中:肠道进出口灌流液的体积(ml):Qin和Qout(经过密度校正);肠道进出口灌流液中药物的浓度(mg/L):Cin和 Cout;被灌流肠段的长度(cm)和横截面半径(cm):l和r;灌流速度(ml/min):Q;灌流肠段的体积(cm3):V。
4.3 密度的校正
收集45~105 min的灌流液,并记录总体积与总重量,计算收集液的密度。 结果为(1.45±2.16)g/ml(n=10)。
4.4 统计学方法
利用统计分析软件SPSS 15.0处理数据,并进行方差分析(ANOVA)。采用t检验考察组间差异。
5 影响药物肠吸收的因素
5.1 不用肠段对肠吸收的影响
取6只大鼠,每只大鼠分别取10 cm十二指肠段(自幽门下1 cm处开始)、空肠段(自幽门15 cm处开始)、回肠段(自盲肠上行20 cm处)和结肠(紧邻盲肠至结肠)。称取适量白芍提取物并用K氏液配制成芍药苷浓度为9.96 mg/L灌流液,灌流速度:0.2 ml/min,每15分钟换液,持续时间:105 min,计算并比较各肠段下的Ka和Papp值并取后5组数据的平均值,见表1。
表1 不同肠段对药物Ka和Papp的影响(±s,n=6)

表1 不同肠段对药物Ka和Papp的影响(±s,n=6)
肠段 Ka(×10-2/min)1.69±1.23 1.72±0.63 1.78±2.02 1.70±1.03十二指肠空肠回肠结肠Papp(×10-3cm/min)5.75±1.42 5.67±0.58 5.32±1.71 5.57±0.79
从结果表明芍药苷在十二指肠段、空肠段、回肠段与结肠段药物的Ka和Papp之间均无显著性差异(P>0.05)。提示芍药苷在全肠道均有吸收,且小肠内无特定吸收部位。
5.2 药物浓度对肠吸收的影响
以K氏液为溶剂,取适量白芍提取物,制备成浓度分别为5.52、9.96、21.43 mg/L的芍药苷供试液,选取肠道实验方法同“3.1”项下,以0.2 ml/min对空肠进行灌流,每隔15 min取样,取样点为7个,分别计算各点的Ka和Papp值,对5组数据计算平均值,见表2。
表2 不同药物浓度下的Ka和Papp(±s,n=6)

表2 不同药物浓度下的Ka和Papp(±s,n=6)
5.52 9.96 21.43芍药苷浓度(μg/ml) Ka(×10-2/min)1.72±1.61 1.79±2.28 1.76±1.34 Papp(×10-3cm/min)5.64±2.74 5.31±1.69 5.76±1.53
结果发现考察范围内芍药苷的浓度对Ka和Papp无明显影响(P>0.05)。表明芍药苷吸收入体循环的主要机制为被动扩散。
5.3 灌流速度对肠吸收的影响
将6只大鼠随机分成2组。以K氏液为溶剂,配制浓度为9.96 mg/L的芍药苷溶液作为灌流液,肠道选取方法同“3.1”项下,对空肠进行灌流,一组以下列灌流速度进行灌流:0.2、0.4、0.8、1.0、0.8、0.4、0.2 ml/min, 且每种流速均维持45 min,取样间隔为15 min,在更换下一流速后应先进行平衡10 min后再进行取样,以消除误差;另一组同法操作,灌流速度如下:1.0、0.8、0.6、0.4、0.2、0.4、0.6、0.8、1.0 ml/min,分别计算每个取样点的Ka和Papp值,考察灌流速度对Ka和Papp的影响,见表3。
表3 灌流速度对药物Ka和Papp的影响(±s,n=6)

表3 灌流速度对药物Ka和Papp的影响(±s,n=6)
0.2 0.4 0.8 1.0灌流速度(ml/min) Ka(×10-2/min)1.68±1.78 1.98±1.44 2.52±2.12 2.95±2.32 Papp(×10-3cm/min)5.32±1.69 8.65±2.12 11.3±2.07 14.1±1.46
结果表明,灌流速度影响着药物的吸收速率常数和表观吸收系数(P<0.01)。灌流速度与Ka和Papp值呈线性关系(r>0.97)。提示可能随着灌流速度的增大,对肠道冲洗作用增强,导致肠壁细胞脱落增加,使肠道厚度降低,更有利于药物的扩散,所以导致Ka和Papp值的增大。
6 讨论
在体、体内和离体法为目前国内研究药物肠吸收的方法,在体法是较多的采用方法,由于灌流液体积的变化是因为肠道对水分有部分吸收导致,国内曾把标识物选为不被肠吸收的酚红,来标识灌流液体积的变化[13],但肠也吸收了小部分的酚红,从而对某些药物的肠道转运和分析测定产生了干扰。相比较于传统的标记物法,采用重量法可以显著减少影响实验准确性的干扰因素,并且消除了肠道吸收水分对实验结果的影响。同时通过对密度的校正,可以看出假定收集液密度为1.0 g/ml存在一定误差,实际实验值为(1.45±2.16)g/ml(n=10),要略高于假定值。导致密度增加的原因可能为:肠道内仍存在残留物,冲洗不彻底;在灌流过程中,灌流液可能会使肠道壁细胞溶蚀或黏膜脱落等。药物难以吸收和易于吸收都用 Kappa值表示,当 Kappa<0.03×10-4和 >0.2×10-4cm/s时分别为药物难以吸收和易于吸收[12],实验所测各肠段品也用Kappa值表示,当 Kappa为(0.000 281±1.63) cm/s表明肠道吸收较少量的芍药苷,可能是芍药苷有较好的水溶性,难以透过肠道表皮细胞,吸收过程有所限制,从而吸收少。
[1]国家药典委员会.中国药典[S].一部.北京:化学工业出版社,2005:68.
[2]张克荣.芍药质量评价方法研究[D].沈阳:沈阳药科大学硕士学位论文,2003.
[3]高小荣,田庚元.白芍化学成分研究进展[J].中国新药杂志,2006,15(6):416-418.
[4]蒋午峻,王巧,李小娜,等.白芍总苷的药理作用和质量控制方法研究进展[J].河北医科大学学报,2006,27(5):500-502.
[5]Stewart BH,Chan OH,Lu RH,et al.Comparison of intestinal permeabilities determined in multiple in vitro and in situ models:relationship to absorption in humans[J].Pharm Res,1995,12(5):693-699.
[6]FagerholmU,JohanssonM,LennernasH.Comparsion between permeability coefficients in rat and human jejunum[J].Pharm Res,1996,13(9):1336-1342.
[7]Le Corre P,Dollo G,Chevanne F,et al.Influence of hydroxypropyl-βcyclodextrin and dimethyl-β-cyclodextrin on diphenhydramine intestinal absorption in a rat in situ model[J].Int J Pharm,1998,169(2):221-228.
[8]聂淑芳,潘卫三,杨星钢,等.对大鼠在体肠单向灌流技术中重量法的评价[J].中国新药杂志,2005,14(10):1176-1179.
[9]刘睿,刘志东,张伯礼,等.丹酚酸B在体肠吸收研究[J].中国新药杂志,2008,17(10):852-860.
[10]周萍,蒋惠娣.单向灌流模型研究木犀草素对大鼠在体肠的吸收[J].中药与天然药物,2007,17(4):29-32.
[11]吴雅娜,栾立标.独活有效成分大鼠在体单向灌流肠吸收[J].药学学报,2008,43(1):102-107.
[12]Schurgers N,Bijdendij KJ,Tukker JJ,et al.Comparison of four exermentaltechniquesforstudying drug absorption kineticsin anesthetized ratin situ[J].J Pharm Sci,1986,75(2):117-119.
[13]胡一桥,郑梁元,钱陈钦.离子型药物酚红的小肠吸收研究[J].中国药科大学学报,1996,27(6):355-359.
