联合蛋白质组学和代谢组学探讨兔脊髓缺血再灌注损伤的时间规律
2011-01-29苑福升朱本清王海涛杨小玉
苑福升 ,刘 健 ,高 琦 ,朱本清 ,王海涛 ,闫 鹏 ,杨小玉
1.吉林大学中日联谊医院骨科,吉林长春 130021;2.天津人民医院骨科,天津 300211
脊髓缺血再灌注损伤是脊柱脊髓外科领域研究的热点,以往的研究主要集中在阐述机制、解释空间构造方面。我们建立蛋白组学和代谢组学联合研究平台,试图从新的角度阐释脊髓缺血再灌注损伤时间规律。
1 蛋白组学方法
1.1 仪器
Amersham公司IPGphor等电聚焦仪、Ettan DALT Twelve电泳系统、蛋白核酸分析仪、超声破碎仪。Beckman冷冻离心机,PROTEAN IEF cell型等电聚焦仪、PROTEAN-11(R)ⅪCell型垂直电泳槽、凝胶成像系统为Bio-Rad产品,Thermo冷凝水循环仪质谱仪,Applied Biosystems产品ABI-4800型反射式基质辅助激光解吸附飞行时间串联质谱,Typhoon 9410扫描仪及图像分析软件DeCyder v.5.02(Amersham Bioscience)。
1.2 试剂
Cy2、Cy3、Cy5荧光染料购自Amersham公司;DMF购于SIGMA 公司;裂解液(7 mol/L 尿素、2 mol/L 硫脲、4%CHAPS)、水化液(8 mol/L尿素、2%CHAPS)、平衡母液(6 mol/L尿素、50mmol/L Tris-HCl、20%甘油、2%SDS)、RCDC 定量试剂盒、10× 电 泳 缓 冲 液 (250 mmol/L Tris、1.92 mol/L glycine、1%SDS)、Bradford定量试剂盒、30%丙烯酰胺(丙烯酰胺∶甲叉双丙烯酰胺=29∶1)、1.5 mol/L Tris-HCl (pH 8.8)、10%SDS 均是Bio-Rad公司产品。
1.3 实验方法
1.3.1 模型制备和脊髓标本采集 清洁级健康成年新西兰大白兔由吉林大学实验动物中心提供,雌雄不限,体重2.5~3.0 kg。随机将实验动物分3组:假手术组(I0R0)、缺血30 min组(I30R0)、缺血再灌组(I30R6、12、24、48),每组 6 只。 将其用10%的水合氯醛麻醉,开腹后用血管夹在左肾动脉分叉下阻断腹主动脉,使脊髓腰骶段缺血。假手术组和缺血30 min组于术后麻醉下取脊髓L4~5节段,缺血再灌注组缺血30 min后去除血管夹闭创,模拟再灌注。再灌注6、12、24、48 h麻醉下活体取脊髓L4~5节段。液氮速冻-70℃冰箱保存。
1.3.2 样品制备 液氮研磨组织粉末,按1∶10(W/V)加入lysis buffer。 加蛋白酶抑制剂(Cocktail) 20 μl/ml。 先取一部分lysis溶解样品粉末,转入Dounce匀浆器中。用剩余buffer清洗容器,再转入Dounce匀浆器中匀浆。将样品放入冰水混合物烧杯里超声,21%振幅。累计超声60 s,超0.2 s,停1 s(pulse on 0.2,off 2), 室温提取 30 min。 离心,40 000 g×1 h/s,4℃离心,取上清,测量出蛋白浓度后,分装保存在-80℃冰箱。
1.3.3 实验方法 标本提取、标记及电泳过程详见文献[1]。
1.3.4 图像扫描及分析 电泳结束后,扫描仪在488/520 nm,532/580 nm,633/670 nm 波长分别对 Cy2、Cy3、Cy5 荧光染料标记的图像进行扫描。用DeCyder v.5.02图像分析软件观察各蛋白点在缺血和再灌注各时间点的变化,取正常组与缺血再灌注24 h组比较筛选差异点标记描述。
1.3.5 差异点的质谱鉴定 应用胶内酶切法切取差异点。质谱分析采用反射式扫描方式,扫描范围:700~4000Da;激光能量:一级质量分析器5000 v,二级质量分析器 5 500 v。
1.3.6 数据库检索 数据库应用兔形目数据库和NCBI全库。兔形目数据库取蛋白质评分>52分,NCBI全库取蛋白质评分>67分,置信水平在95%以上。
1.4 结果
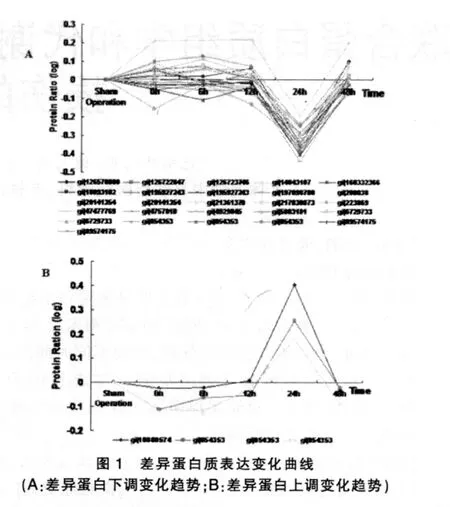
选取实验动物I30R24组相对于对照组I0R0组,2倍的差异结果作为入选对象,通过荧光标记比较结果,共选取了49个差异点,通过MALDI-TOF-TOF/MS分析酶解后肽碎片的一级和二级离子序列。最后基于MASCOT算法的检索平台,分别以NCBI的兔蛋白库和物种全蛋白库分别检索,最终获得了21个蛋白质。根据灌流过程中蛋白质表达量的变化,实验中所设定的取样组(0、6、12、24 和 48 h)绘制变化曲线,见图 1。
1.5 Western-blot验证分析
选取了24 h下调蛋白质α-tubulin进行验证结果分析,电泳上样次序根据缺血后灌注的时间顺序,与蛋白质分析曲线序列完全一致。
2 代谢组学方法
2.1 材料与方法
2.1.1 主要仪器与装置试剂
气相色谱-飞行时间质谱仪(GC-TOF-MS):美国Waters公司产品;DB-5MS 柱(30 mm×0.25 mm,0.25 μm)安捷伦科技有限公司产品;离心机为德国Eppendorf公司产品;电子分析天平(BS124S)为德国Startorius公司产品,Masslynx 4.0数据处理系统,英国Micromass公司产品;Nist 02数据库。
2.1.2 主要试剂
核糖醇(内标):由中国药品生物制品检定所提供;甲醇、正己烷(色谱纯):Merck公司产品;其他标准试剂均为国产。分析纯实验用水为Milli-Q超纯水系统(美国Milipore公司)纯化的纯净水。
2.1.3 实验动物与处理
同蛋白质组学研究组实验新西兰兔,随机分为3组:第1组为正常假手术组 (I0R0,K),第2组为脊髓缺血30 min(I30R0,M), 第 3 组缺血 30 min, 再灌注 24 h 组(I30R24,H)。复制动物模型同前。分别于假手术后,缺血30 min及再灌注24 h采集门静脉血,用1%肝素钠抗凝,3 000×g离心10 min后,取血浆-20℃保存待测。
2.1.4 实验条件
2.1.4.1 色谱条件:色谱柱:DB-5MS(30.00 mm×0.25 mm,0.25 μm);升温程序:柱初温50℃,以30℃/min升温至160℃,保持1 min,以4℃/min升温至240℃,保持1 min;以30℃/min升温至280℃,保持 3 min;进样温度 260℃;载气为超纯氦(99.9996%),柱流量(恒流):1 ml/min;进样量 0.3 ml。
2.1.4.2 质谱条件:电子轰击(EI)离子源,电子能量70 eV,传输线温度250℃,离子源温度220℃,电离方式EI+,检测质荷比范围:50~800 m/z。
2.1.4.3 多维统计分析结果:试验中采用非监督的主成分分析(PCA)对K、M和H组的血清代谢物进行分析,建立二维PCA数学模型OPLS-DA模型的载荷图。
2.2 结果
采用气相色谱联合质谱分析(GC-MS)的方法分析测定血清中代谢物并用PCA、OPLS-DA等多维统计方法区分假手术组和不同时段(30 min,24 h)缺血再灌注损伤组。结果发现了51种差异代谢物物质组成的代谢标志物组 (其中一个为内标物)。代谢产物的成分及对比差异详见表1、2。

表1 假手术组(K)、术后24 h组(H)比较

表2 术后30 min组(M)与术后24 h组(H)比较
代谢产物主要分为糖类、氨基酸、脂类等。K组和H组对照,代谢产物偏高主要集中在半乳糖、未知糖、甘油、硬脂酸、6-脱氧吡喃甘露糖、软脂酸、尿素、肌醇;M和H组对照,代谢产物偏高主要集中在:葡萄糖、半乳糖、软脂酸、尿素、甲氧基丙二酸、甘氨酸、硬脂酸、5-氧基脯氨酸。
3 讨论
建立和完善蛋白质组学和代谢组学技术平台,可从蛋白组、代谢组两个水平检测目的样品的非期望效应,非选择性、无偏倚的方式筛选出被研究对象在细胞或组织水平的病理生理或代谢水平的潜在变化[2]。
DIGE在差异蛋白质分析方面稳定、可靠。在数据库检索上,借鉴Vissers等[3]的经验,采用兔形目数据库和NCBI全库进行互补分析的策略。分时段采样的蛋白质差异表达的结果上获得若干组动态的变化曲线,变化趋势显示,损伤的24 h是主要改变关键点,在此前后蛋白质的表达水平基本一致。
重点神经蛋白质如神经纤维蛋白M (neurofilament M,NFM),在上调和下调模式中均出现,其在应激后受雌二醇的诱导表达以恢复神经细胞的功能[4],损伤前期该蛋白质表达下降,而后保护性地上升以恢复神经元的功能,因此推测,保护性机制发生于再灌注24 h。另一个神经蛋白是span2,该蛋白参与神经元膜的稳定性的保持,Indraswari等以脑缺血小鼠为模型发现spna2的mRNA表达上调,参与缺血保护[5]。在结果中其蛋白质表达水平在24 h明显下调,表明该蛋白在缺血损伤前期发挥不同的作用。
胶质纤维酸性蛋白(GFAP)24 h表达量下降,之后表达水平恢复。胶质纤维酸性蛋白被认为是脊髓损伤的标志性蛋白。
根据实验结果构建的数学模型显示,蛋白表达量变化总体趋势呈现24 h“瀑布式”下降,而其余时间点变量很小的特征,Woolf等也通过免疫组化分析周围神经损伤时观察到,糖原磷酸化酶(PYGM)在24 h表达有一个瞬时降低[6],因此推测在脊髓损伤中,糖代谢的酶表达水平的降低可以在一定程度上降低葡萄糖的消耗,使体内的葡萄糖维持在较高水平,从而保护急性应激中受损的神经。
保守的热休克蛋白(HSP)是细胞对缺血、缺氧等应激反应敏感而可靠的标记,对应激细胞起保护作用[7]。最近有实验证实,脊髓损伤组大鼠在脊髓损伤后2 h即有HSP70开始表达,并随着时间增加,表达24 h达到峰值,维持至72 h后表达渐少,低于6 h水平[8],与HSP相关的辅助因子热激活蛋白70识别蛋白A(HSC70)在24 h下降达到低谷而后升高,此过程表明初期应激后机体内在损伤保护机制启动,与HSP70联动,其诱导的数量与保护作用的强弱呈正相关[9]。
琥珀酸脱氢酶、烯醇酶等参与碳水化合物代谢和能量代谢的酶类在24 h时间点上也呈现下降的特征,但是目前仍缺少其在神经损伤研究中的作用机制证据。
代谢组学方面,由于所检测的许多内源性小分子化合物直接参与了体内各种代谢、循环,其水平高低在一定程度上反映了机体生化代谢的功能和状态,通过代谢网络分析还能了解体内生化代谢状态,沟通生化代谢与疾病关系[10]。气质联用(GC-TOF/MS)在扫描模式下不但具备了广谱测定、强大的分离和分析复杂混合物的能力,还拥有很高的灵敏度、良好的重现性和线性响应[11-12]可以同时测定定性几百个化学性质不同的化合物。其庞大的化合物谱图库也极大地方便了未知化合物的鉴定。
代谢产物分析方面,高能磷酸化合物,如磷酸肌酸(P2Cr)、三磷酸腺苷(ATP)的耗竭及葡萄糖、糖原的耗竭被认为是缺血性损伤最敏感和最可靠的代谢指标。葡萄糖在细胞内转换为丙酮酸后,缺氧时氧化磷酸酶活力下降,糖酵解产生的H+与丙酮酸结合形成乳酸,其作为疲劳物质,量的升高可以在某种程度上反映细胞缺血缺氧的状态。本试验中假手术组(K)、术后 30 min 组(M)、术后 24 h 组(H)比较:在假手术组与术后24 h组比较中(表1),出现明显高峰的产物,假手术组为葡萄糖,术后24 h组为乳酸,说明葡萄糖消耗明显。而术后30 min组与术后24 h组比较(表2),术后24 h出现半乳糖与未知名称的糖明显较术后30 min组高。半乳糖也可以通过半乳糖激酶等作用下进入酵解途径。其他糖类如6-脱氧吡喃甘露糖也可通过变位酶转变成磷酸己糖而半乳糖激酶等作用下进入酵解途径。其他糖类如6-脱氧吡喃甘露糖也可通过变位酶转变成磷酸己糖而进入酵解途径,由此可推断在术后24 h中,糖代谢已经达到峰值,趋向于向正常方向回归正常代谢变化。此外甘油是细胞膜的组成部分,研究表明甘油的浓度变化可能反映细胞膜损伤的程度[13]。
综上所述,通过对缺血再灌注损伤兔模型蛋白质组和代谢组的分析,笔者认为,脊髓缺血再灌注后的24 h是关键性变化点,神经蛋白部分受损严重,影响模型动物的神经支配运动能力。在这种状态下机体应激启动了相关的保护机制,主要以降低糖代谢酶类来维持相当水平的血糖浓度,同时为了对受损蛋白质进行修复和重叠以恢复其功能,机体启动热激活蛋白等相关修复的因子。而代谢产物中,葡萄糖及其他多种己糖在缺血再灌注损伤24 h的时候,达到代谢的峰值,逐渐开始趋向于向正常方向,回归正常代谢变化。
[1]朱本清,杨小玉,顾锐,等.兔脊髓缺血再灌注损伤与正常组蛋白质组的差异分析[J].中国实验诊断学,2010,14(4):487-489.
[2]Weston AD,Hood L.Systems biology,proteomics,and the future of health care:toward predictive,preventative,and personalized medicine[J].J Proteome Res,2004,3(2):179-l96.
[3]VissersJP,PonsS,HulinA,etal.Theuseofproteomesimilarityforthe qualitative and quantitative profiling of reperfused myocardium [J].J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(13):1317-1326.
[4]Chiasson K,Lahaie-Collins V,Bournival J,et al.Martinoli MG Oxidative stress and 17-alpha-and 17-beta-estradiol modulate neurofilaments differently[J].Mol Neurosci,2006,30(3):297-310.
[5]Indraswari F,Wong PT,Yap E,et al.Upregulation of Dpysl2 and Spna2 gene expression in the rat brain after ischemic stroke [J].Neurochem Int,2009,55(4):235-242.
[6]Woolf CJ,Chong MS,Ainsworth A.Axotomy increases glycogen phosphorylase activity in motoneurones[J].Neuroscience,1984,12(4):1261-1269.
[7]Giffard RG,Yenari MA.Many mechanisms for Hsp70 protection from cerebral ischemia[J].Neurosurg Anesthesiol,2004,16:53-61.
[8]周成福,赵立新,马晓茹,等.大鼠急性脊髓损伤热休克蛋白70的表达[J].黑龙江医药科学,2010,33(1):32-33.
[9]Salehi AH,Morris SJ,Ho WC,et al.AEG3482 is an antiapoptotic compound that inhibits Jun kinase activity and cell death through induced expression of heat shock protein 70[J].Chem Biol,2006,13(2):115-116.
[10]曹蓓,阿基业,王广基.代谢组学在临床研究中的应用及进展[J].生命科学,2010,22(8):761-771.
[11]Koek MM,Muilwijk B,vander Werf MJ,et al.Microbial metabolomics with gas chromatography/mass spectrometry [J].Anal Chem,2006,78(4):1272-1281.
[12]胡正青,林夏珍,郭明.代谢组学研究技术进展[J].中国现代应用药学,2010,27(6):488-490.
[13]Kett-White R,Connell MTO,Hutchinson PJA,et al.Extracellular amino acid changes in patients during reversible cerebral ischaemia Acta[J].Neurochirurgica Supplementum,2005,95(3):83-88.
