茄蒂黄酮提取工艺及抗氧化性研究
2011-01-25安红钢林敏任雪峰于文广吴冬青
安红钢,林敏,任雪峰,于文广,吴冬青
(河西学院化学化工学院,甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖734000)
茄子Solanum melongena L.是一年生草本植物,亚洲、地中海、中欧及东南欧地区广泛栽培的蔬菜作物[1]。茄子是我国普遍食用的蔬菜,价格低廉,容易取材,而茄蒂(茄子的萼片)常作为茄子的下脚料丢弃。茄子全身均可入药,茄蒂可治风下血不止、血痔、口齿疮、癜风等[2]。本实验以茄蒂黄酮为主要指标,在单因素试验基础上,借助SAS9.2统计分析软件,采用响应曲面法的Box-Behnken设计优化出茄蒂黄酮最佳提取工艺。又通过体外实验进行抗氧化作用研究,并应用Origin分析软件对实验数据进行线性回归,计算清除自由基的IC50和还原力的IC0.5。研究结果以期为该植物资源的充分利用提供参考依据。
1 材料与方法
1.1 材料、试剂与仪器
茄子(张掖市产紫黑色长茄子)购于蔬菜市场,取下茄蒂,洗净、晾干,粉碎备用。
DPPH Sigma公司;邻二氮菲、双氧水、硫酸亚铁、三氯乙酸、邻苯三酚、三羟甲基氨基甲烷、三氯化铁等均为分析纯。实验用水为二次水。
WFJ2100型可见分光光度计(尤尼柯仪器有限公司);RE-52旋转蒸发器(上海青浦泸西仪器厂);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司);国华HH-6数显恒温水浴锅(常州国华电器有限公司)等。
1.2 实验方法
1.2.1 茄蒂黄酮提取工艺
1.2.1.1 提取工艺流程茄蒂→洗净→晾干→粉碎→加入乙醇→浸泡1 h→超声→抽滤→减压浓缩→定容→得黄酮备用液
1.2.1.2 黄酮含量测定[3]准确移取浓度为0.24 mg/mL芦丁标准溶液0、0.20、0.60、1.20、1.80、2.40 mL,分别置于10 mL量瓶中,加入5%NaNO20.5 mL,摇匀,放置5 min后,加入10%Al(NO3)30.5 mL,摇匀,再放置5 min,然后加4%NaOH溶液5 mL,补水至刻度,放置1 min后,在510 nm处测定吸光度(以试剂空白为参比),以样品浓度为横坐标,吸光度值为纵坐标作图,得回归直线方程:y=0.303 4x+0.010 7(R2=0.999 5)。线性范围0~0.9 mg。
1.2.1.3 单因素试验考察料液比、乙醇浓度、超声时间3个因素对茄蒂黄酮提取量的影响。
1.2.1.4 响应面法试验设计[4-5]在单因素试验的基础上,根据Box-Behnken的中心组合试验设计原理,选取料液比、乙醇浓度、超声时间为试验因素,以茄蒂黄酮含量为响应值,设计了三因素三水平的响应面分析试验,见表1。
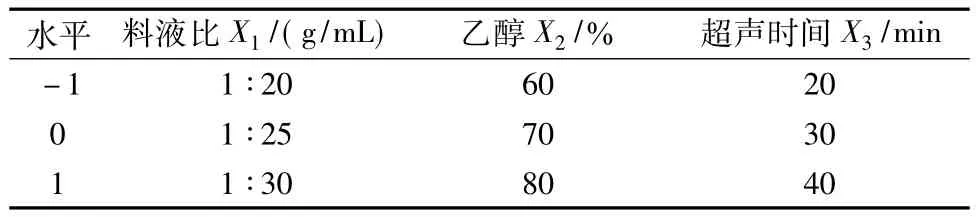
表1 响应面法试验的因素水平Tab.1 The factor and level of response surface test
1.2.2 体外抗氧化作用研究
1.2.2.1 清除·OH自由基的测定方法采用邻二氮菲-Fe2+-H2O2法测定[6-7],并有所改动。实验设五组:空白组、未损伤组、损伤组、样参组、样品组。测定波长为510 nm,按表2加样。对照品为Vc、槲皮素、芦丁(以下试验相同)。
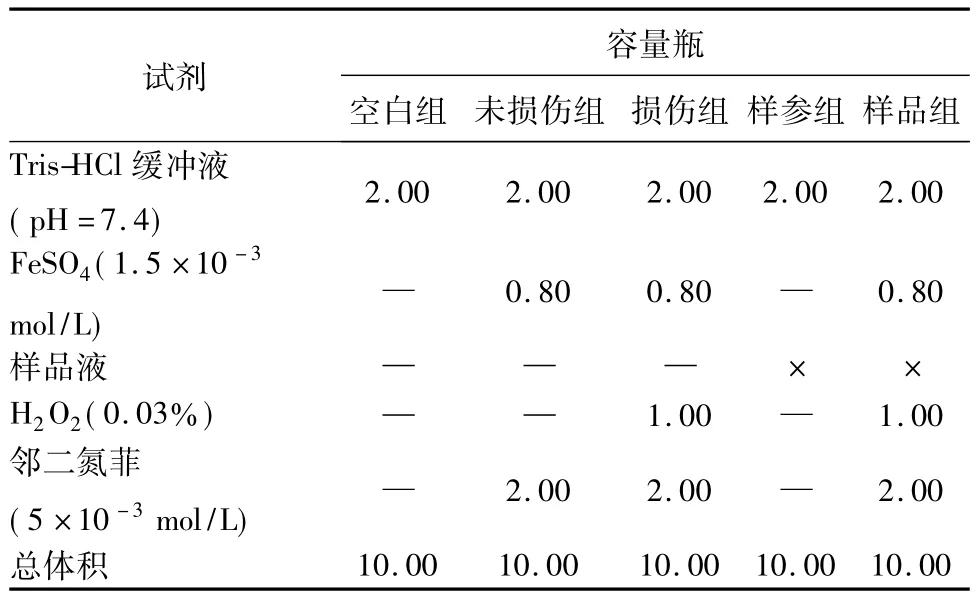
表2 邻二氮菲-Fe2+-H2O2法各试剂组成(mL)Tab.2 Composition of reagent systems for phenanthroline-Fe2+-H2O2reaction
1.2.2.2 清除O-2·自由基的实验方法采用邻苯三酚自氧化法测定[8-10],方法有所改动。取3.00 mL,pH 8.2,50 mmol/L Tris-HCl缓冲溶液,加入0.5 mL不同浓度样品溶液,混合后在25℃水浴中预热10 min,然后立即加入25℃预热过的50 mmol/L邻苯三酚0.5 mL,迅速摇匀,25℃下反应3 min(加入邻苯三酚开始计时)后。10 min后,在420 nm处每隔1 min测定吸光度。以等体积10 mmol/L HCl代替邻苯三酚为空白调零,对照以等体积二次水代替样品。
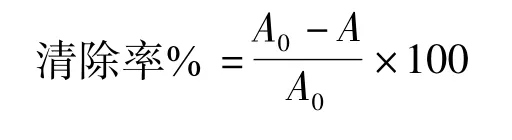
式中:A0为对照OD值;A为样品OD值。
1.2.2.3 清除DPPH自由基的实验方法[11-12]准确移取4 mL不同浓度样品溶液,加入0.065 mmol/L DPPH乙醇溶液4 mL,摇匀,常温反应30 min后于517 nm处测定吸光度A1;同上法,95%乙醇代替DPPH溶液,测定吸光度A2;同上法,二次水代替样品液,测定吸光度A。
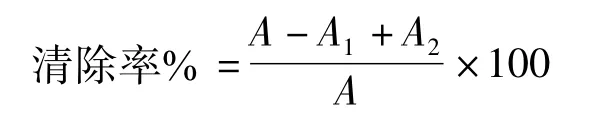
1.2.2.4 还原力测定方法采用普鲁士蓝法[11]。移取3.00 mL不同浓度样品溶液,分别加入0.2 mol/L pH 6.6的磷酸盐缓冲液和1%的K3Fe(CN)6溶液各2.50 mL并混合均匀,混合液在50℃保温20 min后加入2.50 mL 10%的三氯乙酸溶液,混合后离心(3 000 r/min)10 min。取上清液2.50 mL,加入2.50 mL二次水及0.50 mL 0.1%FeCl3溶液,混匀,静止10 min,测定其在700 nm处的吸光度值。用吸光度值表示还原力,吸光度值越大,表明还原力越强。
2 结果与分析
2.1 最佳提取工艺确定
2.1.1 响应面试验与分析
根据Box-Behnken设计模型,按表1以料液比、乙醇浓度、超声时间为自变量,以茄蒂黄酮产量为响应值,试验结果见表3。
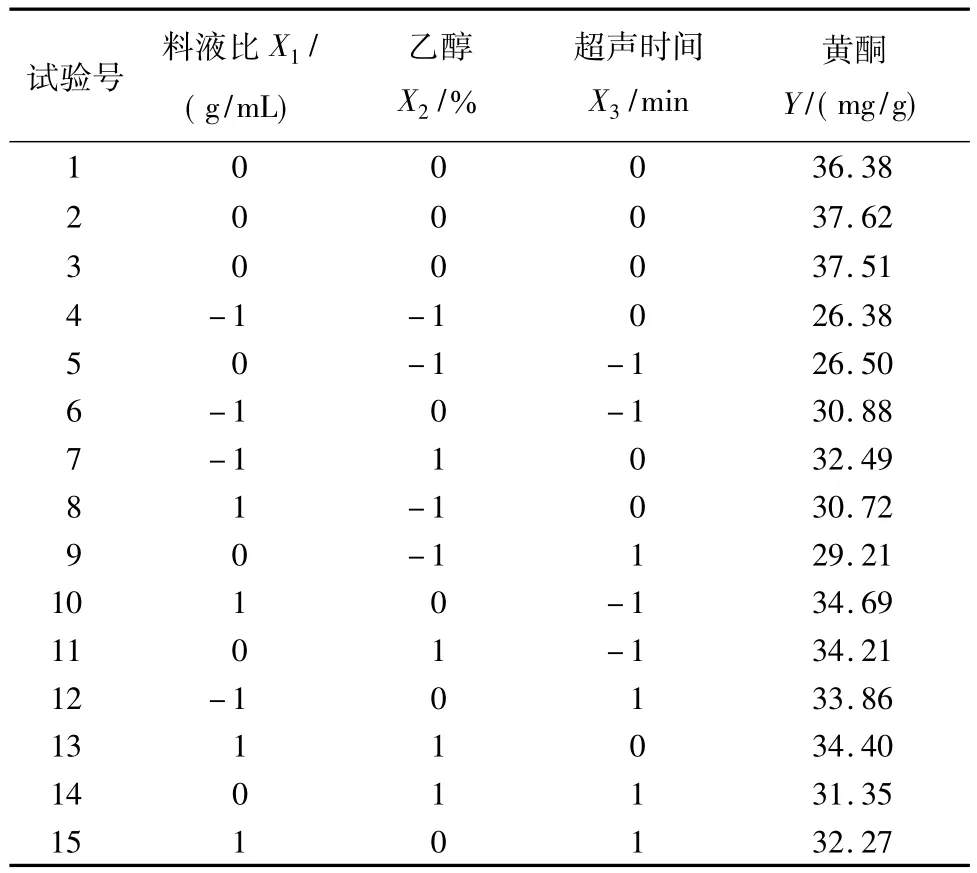
表3 Box-Behnken试验设计及结果Tab.3 Box-Behnken experimental design and results
采用SAS9.2统计分析软件对表3数据进行多元回归分析,结果各试验因子对响应值的影响不是简单的线性关系,试验因子对响应值影响的回归方程为:Y=37.17+1.059X1+2.455X2-1.782-1.350XX-4.390-1.393X2X3-2.463X32
方差分析结果见表4。试验所得的二次多项模型表现极其显著(P<0.001),决定系数为R2=98.22%,说明回归方程的拟合程度很好,失拟较小,回归方程能很好地反映各因子与响应值的关系,可预测茄蒂黄酮实际产量。从表4中的P值又可知,方程中X1、X2、、X1X3、、X2X3、对Y值的影响显著,对黄酮产量影响大小排序为:乙醇浓度>料液比>提取时间。
为确定各因素的最佳取值,利用SAS9.2软件进行岭脊分析,得出回归模型响应值Y的最大估计值为37.68 mg/g,其对应的茄蒂黄酮提取的最佳条件为:料液比1∶26(g/mL),乙醇质量分数73%,超声时间30 min。
2.1.2 提取工艺优化验证实验
在以上优化条件下进行3次验证实验,得出茄蒂黄酮平均提取量为37.09 mg/g(37.01、37.12、37.15 mg/g),与预测值接近。说明该方程与实验情况拟合很好,响应面对茄蒂黄酮提取条件的优化是可行的。
2.2 茄蒂提取物抗氧化能力
2.2.1 对·OH自由基的清除能力
按茄蒂黄酮最佳提取条件提取3批次,提取液合并,定容,然后配制不同浓度黄酮溶液,考察茄蒂黄酮溶液抗氧化能力。按方法1.2.2.1项测定样品在510 nm处吸光度值,代入清除率d的计算公式,结果见图1。
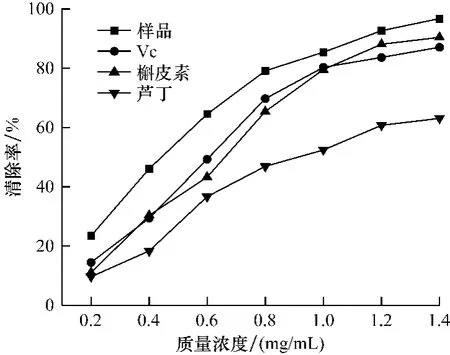
图1 乙醇提取物对·OH清除作用Fig.1 Scavenging effect of ethanol extracts on·OH radical
由图1可知,样品液与对照品羟自由基的清除率随浓度增大而增大,样品中黄酮浓度在0.2~1.4 mg/mL范围内液清除率高于芦丁,与Vc和槲皮素相近。当样品中黄酮质量浓度为大于1.4 mg/mL时,样品清除率达到了96.70%。由Origin分析软件对实验结果线性回归,相关系数在P<0.001水平时都在R2>0.92。计算得样品、Vc、槲皮素和芦丁的IC50值分别为0.47、0.66、0.68和0.99 mg/mL。由IC50值判断清除羟自由基能力依次为:样品>Vc>槲皮素>芦丁。
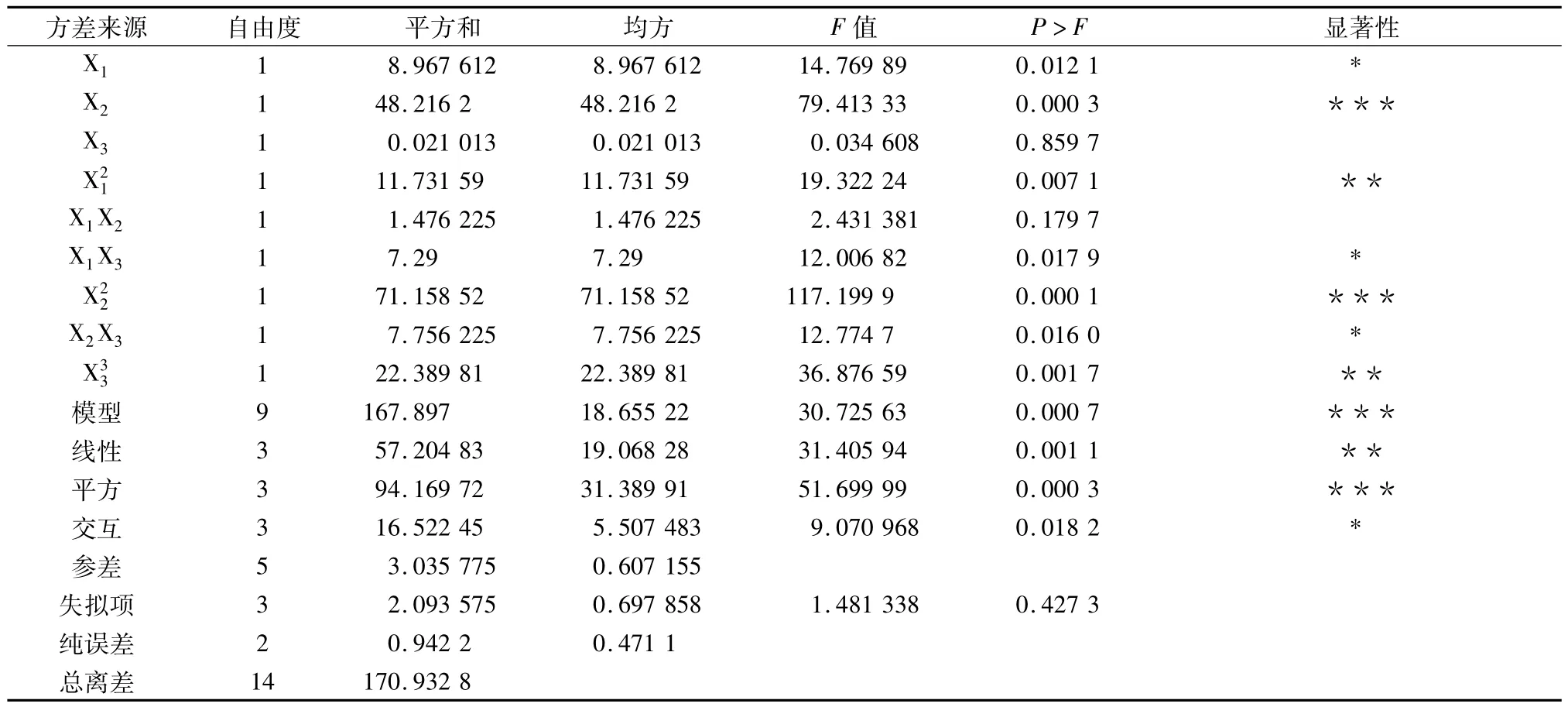
表4 回归方程方差分析结果Tab.4 The variance analysis results of regression equation
2.2.2 对O-2·自由基的清除能力
邻苯三酚自氧化过程中,在400~420 nm处会形成有光吸收的中间物,抗氧化剂抑制作用越强中间产物会越少,则吸光度值越低[8]。本试验测定420 nm处吸光度,并计算其清除率。见图2。
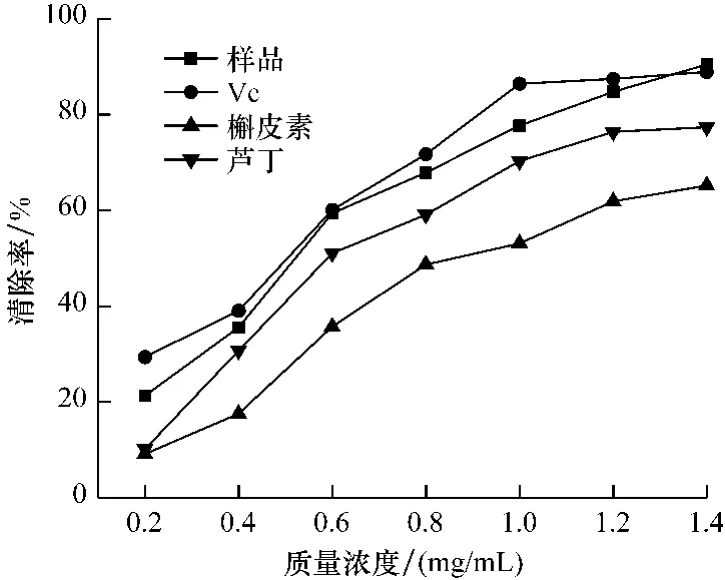
图2 乙醇提取物对·清除作用Fig.2 Scavenging effect of ethanol extracts on·radical
2.2.3 对DPPH·自由基的清除能力
DPPH自由基是一种稳定的以氮为中心的自由基,DPPH自由基乙醇溶液为深紫色,则在517 nm处有最大吸收峰。见图3。当有自由基清除剂存在时,DPPH自由基接受清除剂电子,而使氮原子上单电子配对呈现抗磁性,使溶液颜色变淡,吸光度值变小[13]。
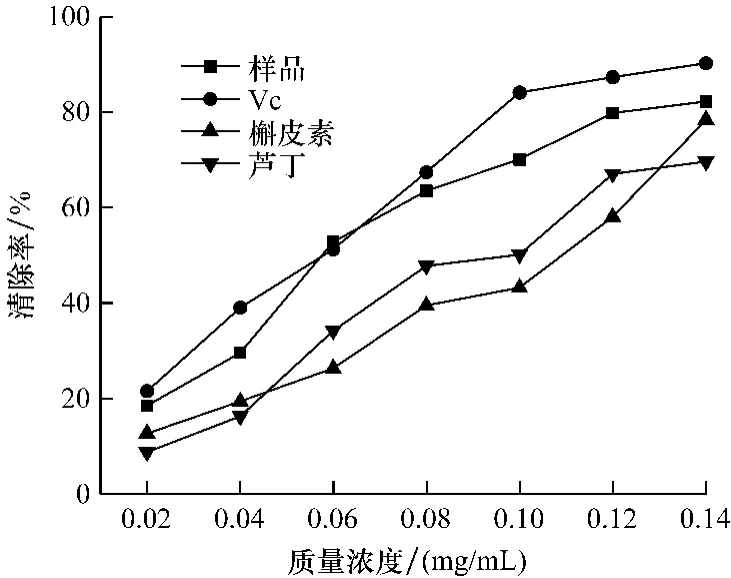
图3 乙醇提取物对DPPH清除作用Fig.3 Scavenging effect of ethanol extracts on DPPH radical
图3可看出,各溶液清除率与浓度呈正相关,在测定范围内,Vc清除率最显著,样品液次之,槲皮素与芦丁交差上升。试验结果进行线性回归计算得样品黄酮、Vc、槲皮素和芦丁的IC50值分别为0.068、0.058、0.1和0.095 mg/mL。在P<0.001时,4个试验品的相关系数均>0.94。由IC50值确定的清除率大小依次为:Vc>样品>芦丁>槲皮素。
2.2.4 提取物还原能力
如果物质是电子给予体,它可将Fe(CN)63-还原成Fe(CN)64-,便与Fe3+形成普鲁士蓝,其在700 nm处有最大吸收峰。根据吸光度值大小可确定还原能力强弱,吸光度越大,抗氧化能力越强。见图4。
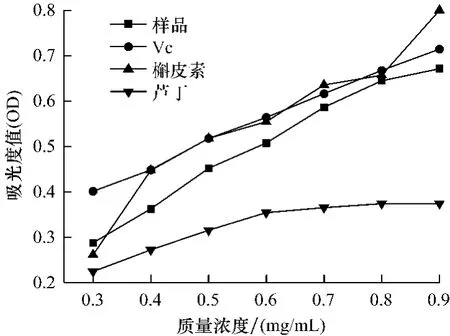
图4 乙醇提取物还原力Fig.4 The reduction energy of the ethanol extracts
从图4可以看出,样品液还原能力弱于Vc和槲皮素,远远强于芦丁。实验结果线性回归,得芦丁、槲皮素、Vc、样品相关系数分别为:R2=0.868 8(P<0.01)、R2=0.939 7(P<0.001)、R2=0.997 7(P<0.000 1)、R2=0.984 8(P<0.000 1)。经计算IC0.5值(吸光度值为0.5时,所需各试验品量)分别为:样品黄酮质量浓度0.60 mg/mL、Vc 0.48 mg/mL、槲皮素0.53 mg/mL和芦丁1.29 mg/mL,还原能力依次为:Vc>槲皮素>样品>芦丁,样品具有较强的还原能力。
3 结论
3.1 响应面分析法优化茄蒂黄酮提取工艺试验结果表明,黄酮的最佳提取工艺参数为:料液比1∶26(g/mL),乙醇73%,超声时间30 min,黄酮实际提取量为37.09 mg/g,与模型预测值接近,说明实验方法合理可行,可以用回归方程预测茄蒂黄酮实际产量。
3.2 实验采用几种体外抗氧化实验模型研究了茄蒂提取物的抗氧化能力,通过这些实验模型证明了茄蒂提取物具有较强的清除羟自由基、超氧阴离子自由基、DPPH自由基能力和还原力。由清除率的IC50值和还原力的IC0.5值,确定清除·OH自由基次序为:样品>Vc>槲皮素>芦丁;清除O-2·自由基次序为:Vc>样品>芦丁>槲皮素;清除DPPH自由基的IC50值次序为Vc>样品>芦丁>槲皮素;还原力为:Vc>槲皮素>样品>芦丁。茄蒂提取物清除·OH、O-2·、DPPH·的IC50值分别为0.47、0.58、0.068 mg/mL,相比之下提取液对DPPH·清除作用最为显著。还原力的IC0.5值为0.60 mg/mL。结果表明,茄蒂提取物具有良好的体外抗氧化作用,作为天然抗氧化剂具有很好开发利用价值。
[1]魏小伞,曹必好,雷建军,等.茄子抗病育种研究进展[J].中国蔬菜,2010,5(10):1-18.
[2]谢宇.本草纲目菜部妙用[M].北京:军事医学科学出版社,2009,101-103.
[3]吴冬青,安红钢,齐亚娥,等.九种药用植物花黄酮类物质提取及对羟自由基清除能力的研究[J].天然产物研究与开发,2008,260(3):514-517.
[4]刘军海,黄宝旭,蒋德超.响应面分析法优化艾叶多糖提取工艺研究[J].食品科学,2009,30(2):114-118.
[5]沈霞,张艳红,袁慧慧,等.响应面分析法优化艾叶粗多糖提取工艺的研究[J].中成药,2010,32(1):48-51.
[6]盛伟,方晓阳,吴萍.白灵茹、杏鲍茹、阿魏茹多糖体外抗氧化活性研究[J].食品工业科技,2008,29(5):103-109.
[7]乌兰格日乐,白海泉,翁慧,等.广霍香多糖的优化提取工艺及抗氧化作用[J].中成药,2010,32(7):1246-1248.
[8]沈玥,张永忠.红三叶草异黄酮抗氧化活性的研究[J].食品与发酵工业,2009,35(11):122-124.
[9]王桃花,王莹,钱玮,等.大豆荚壳异黄酮制备与体外抗氧化性研究[J].大豆科学,2009,28(5):913-916.
[10]谢辉,陈双林.杜仲内生球毛壳菌的抗氧化活性研究[J].菌物学报,2009,28(4):591-596.
[11]姚亚平,曹炜,陈卫军,等.花生壳水溶性膳食纤维不同提取工艺及其抗氧化活性研究[J].食品科学,2006,30(22):27-32.
[12]莫正昌,邓靖,汲广全,等.鹿蹄草提取物体外抗氧化活性评价[J].食品科学,2010,31(3):19-21.
[13]姚亚平,曹炜,陈卫军,等.不同品种荞麦提取物抗氧化作用的研究[J].食品科学,2006,27(11):49-52.
