菘蓝种子总多酚提取工艺的优化及抗氧化活性研究
2011-01-25李焘屈新运王喆之
李焘,屈新运,王喆之
(陕西师范大学药用资源与天然药物化学教育部重点实验室,西北濒危药材资源开发国家工程实验室,陕西西安710062)
植物多酚是一类广泛存在于植物体内的酚类化合物,主要存在于植物的皮、根、茎、叶及果中,在自然界中的储量十分丰富[1]。大量的研究结果表明,植物多酚具有清除自由基、抗脂质氧化、延缓衰老、预防心血管疾病、防癌、抗辐射等多种生物活性,人体摄入一定量的植物多酚可以有效地预防和控制某些疾病的发生[2-3]。菘蓝Isatis indigotica Fort.为十字花科Cruciferae菘蓝属Isatis的二年生草本植物,全国各地广泛栽种;其根、叶均供药用,分别称为板蓝根和大青叶[4]。目前,对于板蓝根、大青叶的植物化学及抗病毒、抗内毒素、抗菌等生物活性方面的研究工作开展的较多[5],而对于菘蓝种子的植物化学特性及相关活性的研究鲜见报道。
本研究在单因素实验的基础上,采用L9(34)正交试验设计对菘蓝种子中总多酚超声提取的条件进行了优化,并以DPPH法评价其抗氧化活性,为揭示菘蓝种子的药用价值和菘蓝药材资源的进一步开发利用提供了一定的实验依据。
1 材料与方法
1.1 实验仪器与材料
实验材料:购自陕西地道中药材种植有限公司。经“药用资源与天然药物化学”教育部重点实验室王炳利教授鉴定为十字花科Cruciferae菘蓝属Isatis植物菘蓝Isatis indigotica Fort.的干燥种子。没食子酸(纯度≥98%)、福林酚、DPPH等购自Sigma公司,甲醇、石油醚、无水碳酸钠等均为国产分析纯。
实验仪器:FW-400A高速万能粉碎机(北京科伟公司);UNICAM-UV300型分光光度计(美国热电公司);HH-1B型数显恒温水浴锅(国华电器有限公司);Q-BKYY31-2000型电热恒温鼓风干燥箱(上海跃进医疗器械厂);BT1245型电子天平(赛多利斯科学仪器北京有限公司);旋转蒸发仪(瑞士BUCHI公司);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司);MILLIPORE超纯水仪(密理博中国有限公司);索氏提取装置;KQ-600DB型超声清洗器(40.0 kHz,600W,昆山市超声仪器有限公司)等。
1.2 实验方法
1.2.1 菘蓝种子的脱脂预处理将充分干燥的菘蓝种子粉碎,过40目筛,取适量置于索氏提取器中,以石油醚为溶剂,80℃热回流处理8 h。脱脂后的种子粉末烘干至恒重,备用。
1.2.2 单因素试验分别选取料液比、甲醇质量分数、提取温度、提取时间等四个因素,以总多酚含量为评价指标进行单因素试验,考察不同因素对总多酚含量的影响,并确定各因素的适宜水平。各因素在不同水平变化时,均以料液比1∶15,甲醇质量分数80%,提取温度40℃和提取时间30 min为固定条件。单因素试验水平设置详见表1。
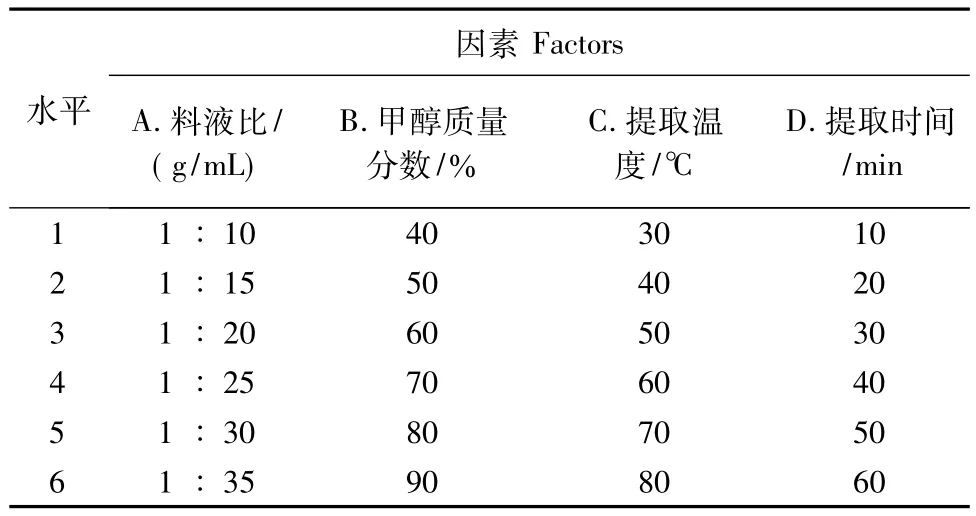
表1 单因素试验因素水平Tab.1 Factors and levels in the one-factor experiment
1.2.3 L9(34)正交试验在单因素试验的基础上,每个因素分别选取三个水平,设置四因素三水平L9(34)正交试验,同样以总多酚含量为评价指标,考察各因素在总多酚提取过程中的交互作用,确定最佳提取工艺。正交试验各因素水平设置详见表2。
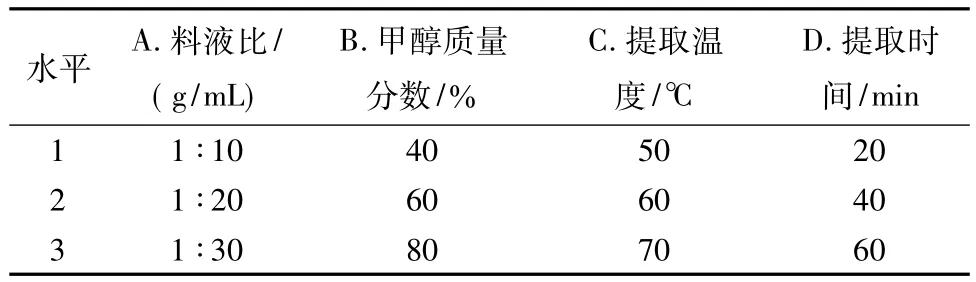
表2 正交试验因素水平Tab.2 Factors and levels in the orthogonal test
1.2.4 提取方法分别准确称取5.00 g脱脂种子粉末,依照单因素和正交试验设置的不同条件进行总多酚的超声提取,过滤,真空浓缩,得总多酚提取物,并以相应浓度甲醇补足减失质量;分别精密吸取1 mL置于25 mL量瓶中,同质量分数甲醇稀释至刻度,作为供试溶液。
1.2.5 总多酚含量的测定参照文献[6-7]描述的Folin-Ceocalteu法测定总多酚,结果以每克提取物中含有相当于没食子酸的毫克数表示。精密称取没食子酸对照品10.15 mg,加甲醇溶解并定容至5 mL,得质量浓度为2.03 mg/mL的标准液。分别吸取标准液0.4、0.6、0.8、1.0、1.2、1.4 mL置于5 mL棕色量瓶中,补足体积。从上述各量瓶中分别吸取0.5 mL不同浓度标准液,依次加入2.5 mL Folin-Ceocalteu试液和2.0 mL 75 g/L Na2CO3溶液,总反应体系为5 mL。将此混合液于50℃水浴5 min,在760 nm波长下测定吸光值。以吸光值对浓度进行线性回归分析,得到没食子酸质量浓度(X,mg/mL)与吸光值Y之间的回归方程为:Y=1.893 305X-0.119 67,相关系数r=0.999 3。没食子酸质量浓度在0.04~0.15 mg/mL之间与吸光值具有良好的线性关系。同法测定各样品的吸光值,依照标准曲线计算相应质量浓度,并依照下式计算样品中总多酚的含量(W,mg/g):
总多酚W=(C·V·n)/m
式中,W为总多酚质量分数(mg/g);C为菘蓝种子中总多酚质量浓度(mg/mL);V为体积(mL),n为稀释倍数;m为菘蓝种子粉末质量(g)。
1.2.6 DPPH法测总多酚的抗氧化活性采用DPPH法评价菘蓝种子总多酚的抗氧化活性。参照文献[8,9]的方法,配制浓度为1×10-4mol/L的DPPH·甲醇溶液。取最优工艺条件提取的总多酚提取液2.0 mL,加入2.0 mL DPPH·甲醇溶液,摇匀,室温静置30 min,以提取溶剂调零,517 nm处测定吸光值,记为As;同法取2.0 mL提取溶剂,加入2.0 mL DPPH·甲醇溶液,混匀,待反应稳定后,测吸光值,记为A0;取2.0 mL总多酚提取液,加入2.0 mL提取溶剂,混匀,待反应稳定后,测吸光值,记为Ar。每个浓度平行测3次,取平均值。以BHT作阳性对照,依照上述方法测定,并按照下式计算菘蓝种子总多酚和BHT对DPPH·的清除率(Y,%):
Y(%)=(1-(As-Ar)/A0)×100%
式中,As表示样品与DPPH·作用后的吸光值;Ar表示样品自身的吸光值;A0表示DPPH·的吸光值。
2 结果与分析
2.1 提取条件对菘蓝种子总多酚提取效率的影响
2.1.1 料液比对总多酚提取效率的影响不同料液比对总多酚的提取效率存在一定的影响。由图1可以看出,料液比在1∶10到1∶25之间,随着料液比的增加,总多酚的提取效率不断增大;而当料液比超过1∶25以后,总多酚含量的增加趋于平缓,并略有下降。在超声提取过程中使用的溶剂量越大,所产生的传质动力也越大,从而能够更大效率地使多酚类化合物充分溶解在提取溶剂中。然而,由于溶剂量的增大,在产生相同热量的前提下,提取温度相对较低,从而使得提取效率由于固液两相存在的吸附平衡而降低[10]。不同料液比对总多酚提取效率的影响作用表现为随着料液比的增加,提取效率在一定范围内不断增大;而当提取效率增大到一定水平时,增加料液比将不再提高提取效率。因此,综合考虑经济因素和实验结果,将正交试验中的料液比确定为1∶10、1∶20和1∶30三个水平。

图1 料液比对总多酚提取率的影响Fig.1 The effects of solid-liquid ratio on the contents of total polyphones
2.1.2 甲醇浓度对总多酚提取效率的影响提取溶剂浓度不同,总多酚的提取效率也存在差异。从图2可以看出,随着甲醇质量分数的升高,总多酚质量分数也随之升高。当甲醇质量分数为60%时,提取的总多酚质量分数为4.76 mg/g,而当甲醇质量分数上升至80%时,总多酚质量分数达到5.89 mg/g。但当甲醇质量分数大于80%以后,总多酚质量分数开始出现明显下降的趋势,至甲醇质量分数为90%时,总多酚降至4.24 mg/g。综合考虑,正交试验的甲醇质量分数水平确定为40%、60%和80%。
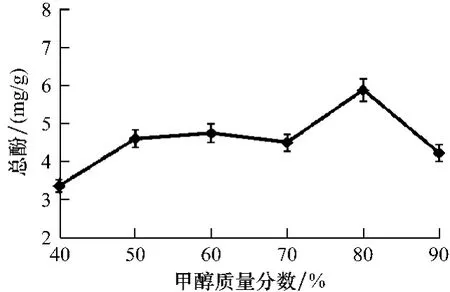
图2 甲醇质量分数对总多酚提取率的影响Fig.2 The effects of methanol concentration on the contents of total polyphones
2.1.3 提取温度对总多酚提取效率的影响不同温度对总多酚提取效率的影响结果见图3。从图3可以看出,温度在30~70℃之间,随着提取温度的升高,总多酚从2.66 mg/g升高到7.39 mg/g,呈现不断升高的趋势。而当温度高于80℃以后,总多酚提取效率明显下降,最低下降至5.21 mg/g。随着温度的升高,总多酚在甲醇中的溶解度也随之升高;但当温度升高至一定水平,甲醇开始逐渐挥发,总多酚在甲醇中的溶解受到一定的影响,总多酚量开始下降。因此,综合考虑温度对总多酚提取效率的影响,正交试验的提取温度水平确定为50、60和70℃。
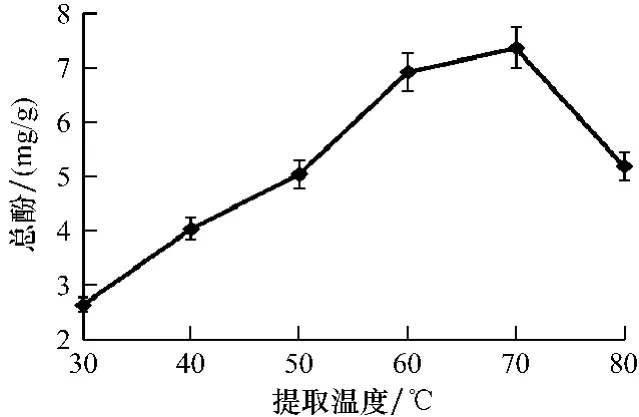
图3 提取温度对总多酚质量分数的影响Fig.3 The effects of extraction temperature on the contents of total polyphones
2.1.4 提取时间对总多酚提取效率的影响从图4可以看出,提取时间不同,总多酚的提取效率不尽相同。随着提取时间的延长,总多酚的量不断升高,当提取时间达到50 min时,总多酚质量分数最高达到7.39 mg/g;而当提取时间继续延长时,总多酚含量开始下降,60 min时,总多酚质量分数为6.21 mg/g,较最高值下降了18.8%。此外,提取时间过长,酚类物质容易被氧化,不利于总多酚的提取,因此,综合考虑提取时间对总多酚质量分数的影响,正交试验的提取时间确定为20、40和60 min 3个水平。
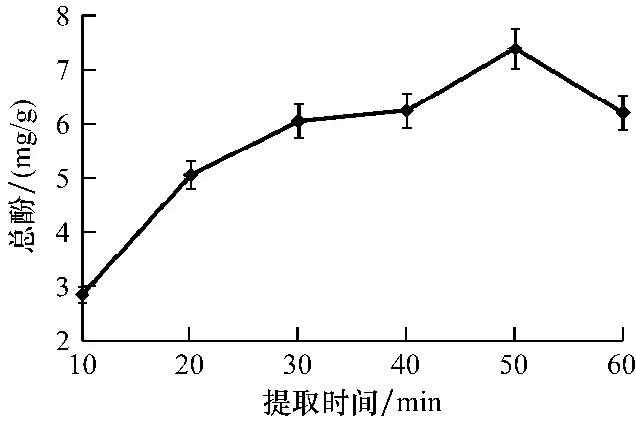
图4 提取时间对总多酚质量分数的影响Fig.4 The effects of extraction time on the contents of total polyphones
2.2 菘蓝种子总多酚提取的正交实验结果在单因素实验的基础上,分别确定了影响总多酚提取效率各因素的合理水平,拟定四因素三水平的L9(34)正交设计方案进行菘蓝种子总多酚的提取。以总多酚含量为考察指标,分析各因素的交互作用,确定最佳工艺参数,正交试验以及方差分析结果详见表3和表4。
从表的极差分析可知,菘蓝种子总多酚提取过程中各因素的最佳组合水平为:A1B2C1D2,即料液比1∶10,甲醇质量分数60%,提取温度50℃,提取时间40 min。各因素对总多酚提取效率的影响作用大小依次为:B>C>D>A。
通过直观分析发现,对菘蓝种子总多酚提取率影响最小的因素是料液比,故以料液比为误差进行方差分析,所得结果见表4。从表4可以看出,对菘蓝种子总多酚提取率具有较显著影响的因素是甲醇浓度(P<0.05)。
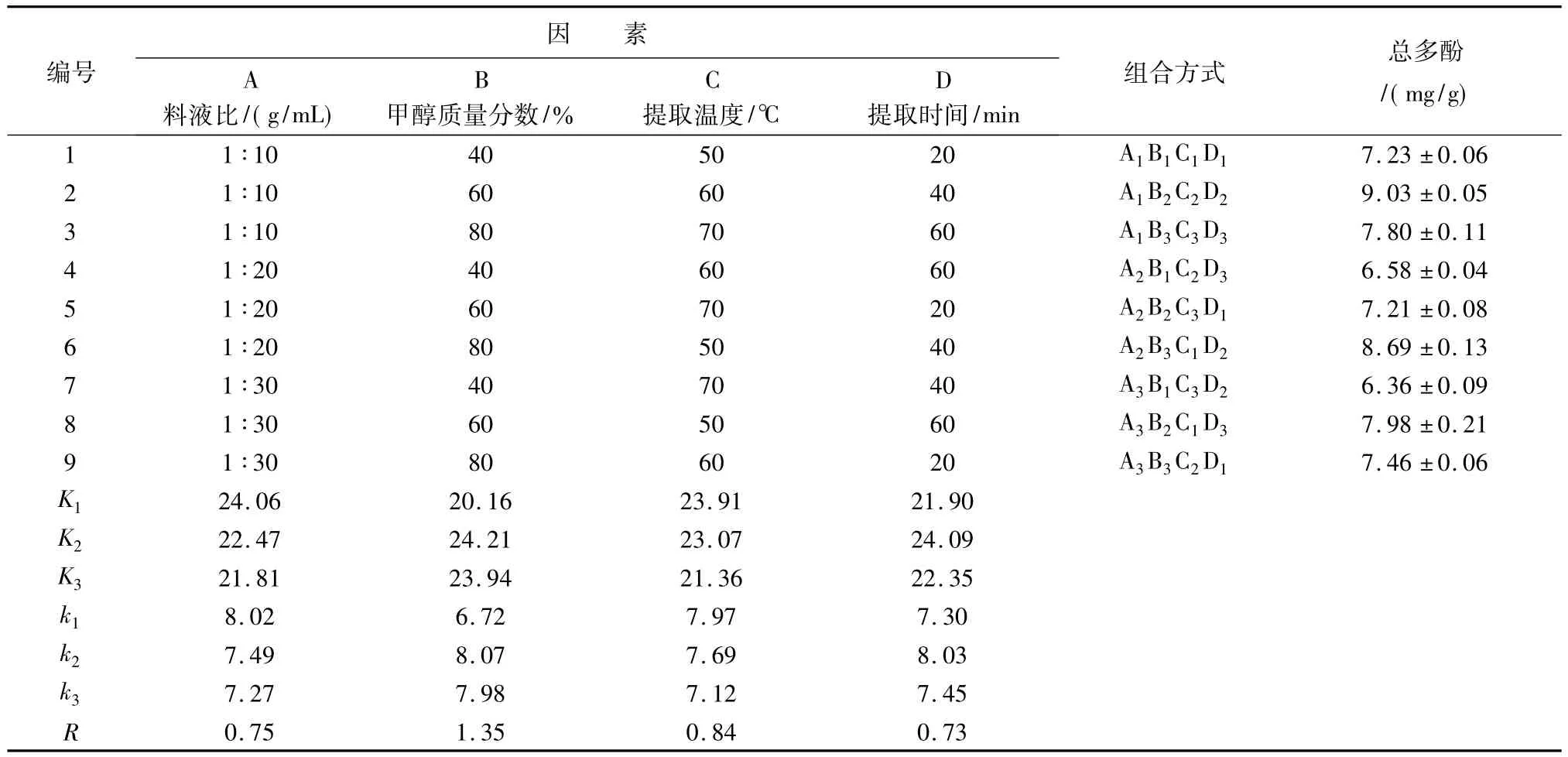
表3 正交实验结果分析(n=3)Tab.3 Results and analysis for orthogonal experiment
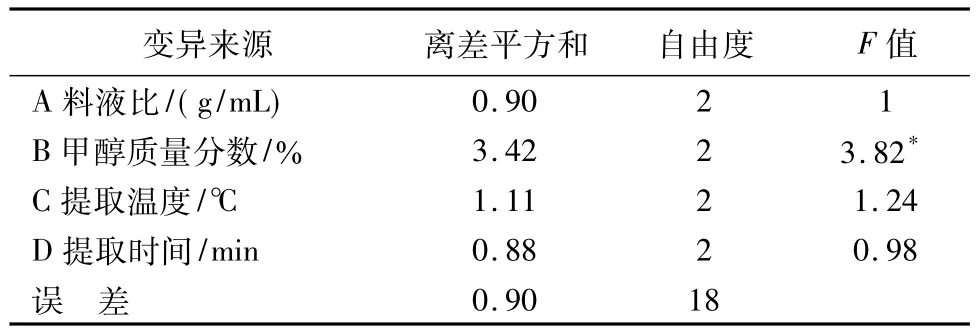
表4 方差分析Tab.4 Variance analysis
在上述最佳提取工艺条件下,进行3次重复实验,菘蓝种子总多酚得率如表5所示,其平均为(8.92±0.03)mg/g。因此,经过正交试验筛选得到的最佳提取工艺条件具有可操作性,且重复性好,适用于菘蓝种子总多酚的提取。
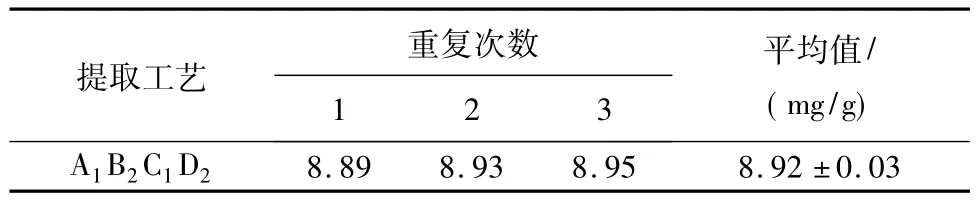
表5 验证试验结果Tab.5 Results of validation experiment
2.3 菘蓝种子总多酚的抗氧化活性评价用于样品抗氧化活性评价的方法很多[11-12],而DPPH·清除实验以其操作简单,耗时短等特点而成为当前广泛应用的方法之一。本实验以菘蓝种子总多酚提取物清除DPPH·的能力作为抗氧化活性评价指标,并以BHT为阳性对照,考察不同质量浓度总多酚提取物(0.003~1.000 μg/mL)对DPPH·的清除活性,测定结果见表6。从表6可以看出,菘蓝种子总多酚提取物对DPPH·具有一定的清除能力,且清除能力与质量浓度之间存在一定的量效关系;随着
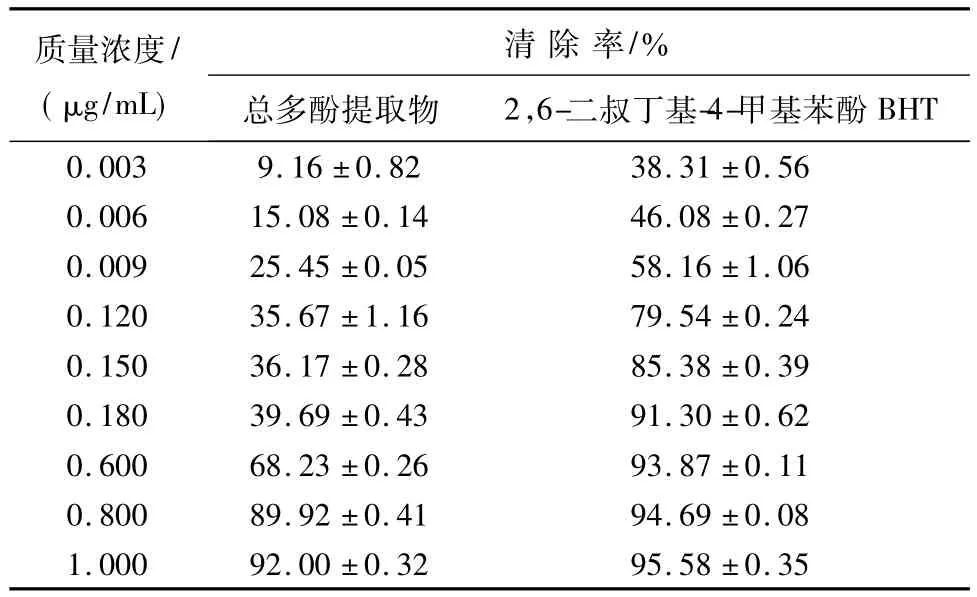
表6 菘蓝种子总多酚提取物与BHT对DPPH·清除作用的比较(n=3)Tab.6 Comparisons on capacity of DPPH·scavenging between total polyphones extracts and BHT
总多酚质量浓度的不断升高,其对DPPH·的清除能力也不断增大;当总多酚提取物的质量浓度为1.0 mg/mL时,对DPPH·的清除率可以达到92.00%,与BHT的清除效率基本相当。因此,菘蓝种子总多酚提取物具有一定的抗氧化活性,可以作为天然的抗氧化剂予以适当的开发利用。
3 结论
本实验采用超声提取技术制备菘蓝种子总多酚,同时考察料液比、甲醇质量分数、提取温度以及提取时间等四个因素对总多酚提取效率的影响,并最终确定其最佳提取工艺条件为:料液比1∶10,甲醇质量分数60%,提取温度50℃,提取时间40 min。在此工艺条件下,菘蓝种子总多酚得率为(8.92±0.03)mg/g。抗氧化活性评价实验结果表明,菘蓝种子总多酚具有一定的清除DPPH·能力,且当总多酚质量浓度为1.0 μg/mL时,其清除活性与人工抗氧化剂BHT基本相当,具有作为天然抗氧化剂开发利用的潜力。本研究工作为进一步揭示菘蓝种子的化学成分及生物学活性奠定了基础,同时也为菘蓝药材资源的合理开发利用提供了一定的实验依据。
[1]孙瑾,王总举,陈岗,等.橄榄中多酚类物质体外抗氧化活性研究[J].中国食品添加剂,2010,3:69-73.
[2]赵扬帆,郑宝东.植物多酚类物质及其功能学研究进展[J].福建轻纺,2006,11:107-110.
[3]Paul K,Gary W.Perspective polyphones dietary components with established benefits to health[J].J Sci Food Agric,2005,85:1239-1240.
[4]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:191.
[5]彭少平,顾振纶.板蓝根化学成份、药理作用研究进展[J].中国野生植物资源,2005,24(5):4-7.
[6]Lucija M,Mojca S K,Željko K.Antioxidant and antimicrobial activity of guarana seed extracts[J].Food Chem,2007,104:1258-1268.
[7]李西柳,庞明,王俊儒,等.柿子渣中多酚的提取工艺及其抗氧化性研究[J].西北植物学报,2010,30(7):1475-1480.
[8]Bernard F,Pierre W T,Francois H.Comparative study of radical scavenging and antioxidant prosperities of phenolic compound from Vitis vinifera cell cultures using in vitro tests[J].Life Sci,1997,61(21):3103-2110.
[9]Abdalbasit A M,Ramlah M I,Maznah I,et al.Antioxidant activities of phenolic rich fractions(PRFs)obtained from black mahlab(Monechma ciliatum)and white mahlab(Prunus mahaleb)seedcakes[J].Food Chem,2010,118:120-127.
[10]伍春,徐立,刘峻池,等.响应曲面法优化新疆药桑桑皮总多酚提取工艺[J].食品科学,2011,32(2):104-107.
[11]Laetitia M D,Christian M.Antioxidant activity and phenol content of Crithmum maritimum L.leaves[J].Plant Physiol Biochem,2009,47,37-41.
[12]Naciye E,Guler A,Erol A.Antioxidant activities of rosemary(Rosmarinus Officinalis L.)extract,blackseed(Nigella sativa L.)essential oil,carnosic acid,rosmarinic acid and sesamol[J].Food Chem,2008,110,76-82.
