2009流行性感冒患者血清细胞因子的变化特点
2011-01-24毛会军陈良沈芳
毛会军,陈良,沈芳
上海市(复旦大学附属)公共卫生临床中心,上海 201508
2009年3月墨西哥暴发2009甲型H1N1流行性感冒(简称流感)后,全球多个国家相继出现疫情。2009年6月11日世界卫生组织(World Health Organization,WHO)将流感大流行警告级别提高至6级。我国卫生部也将其纳入《中华人民共和国传染病防治法》规定的乙类传染病,依照甲类传染病采取预防、控制措施。本研究检测了30例确诊2009甲型H1N1流感患者治疗前的血清细胞因子水平,并通过与健康对照者进行比较,初步探讨2009甲型H1N1流感易感人群血清细胞因子的变化及其可能的发病机制,同时检测经奥司他韦治疗后患者血清细胞因子的变化情况。
1 材料和方法
1.1 研究对象
选取2009年5月25日~2009年7月13日于上海市公共卫生临床中心确诊的2009甲型H1N1流感患者30例,其中男18例、女12例;年龄10~45岁,平均25岁;均口服抗病毒药物奥司他韦,75 mg/次,每日2次,疗程5 d。为观察药物对血清细胞因子的影响,将服药前所采血样作为治疗前组,服药后第3天所采血样作为治疗后组。采血时间为上午6∶00~8∶00。
诊断标准参照卫生部颁发的《甲型H1N1流感诊断治疗方案(2009试行版第1版)》[1],排除存在血液病史、免疫系统病史及其他疾病者。同时选择健康体检者20例作为对照,其中男8例、女12例;年龄14~43岁,平均27岁。
1.2 标本采集及病原学检测
采集患者咽拭子标本,送上海市疾病预防控制中心进行病毒核酸检测。实验室诊断标准:甲型流感病毒通用M基因阳性,猪H1N1流感病毒通用NP基因阳性,甲型H1N1流感病毒特异HA基因阳性。
1.3 血清细胞因子检测方法及原理
患者均于入院后第1天、经奥司他韦治疗第3天采血,3 500g离心10 min,分离血清,-20 ℃保存待检。使用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(欣博盛生物科技有限公司)检测白细胞介素10(interleukin-10,IL-10)、IL-2、IL-8、γ干扰素(interferon γ,IFN-γ)水平。原理为双抗体夹心ELISA,在450 nm处读取A值,浓度与A450值成正比。所有实验严格按照试剂盒操作步骤操作,酶标仪为Thermo公司的MK3型。为避免实验结果受曲线拟合的影响,直接采用A值。
1.4 统计学方法
治疗前、后组与对照组比较,均采用独立样本t检验;治疗前、后组比较,采用配对t检验。
2 结果
30例患者口服奥司他韦治疗后均恢复良好。
2.1 患者血清中IL-10变化
治疗前组血清IL-10平均A值为0.386±0.717,治疗后组平均A值为0.323±0.688,而对照组平均A值仅为0.040±0.010。与对照组比较,治疗前、后组血清IL-10水平均显著增高(P<0.05)。而治疗前、后组血清IL-10水平无统计学差异(P>0.05)(表1)。
表12009甲型H1N1流感患者治疗前后血清IL-10、IL-2和IFN-γ水平与健康者比较(A450值)
Tab.1IL-10,IL-2andIFN-γserumlevelsinhealthyindividualsandinfluenzavirusA/H1N1/2009-infectedpatientsbeforeandaftertreatment(A450value)
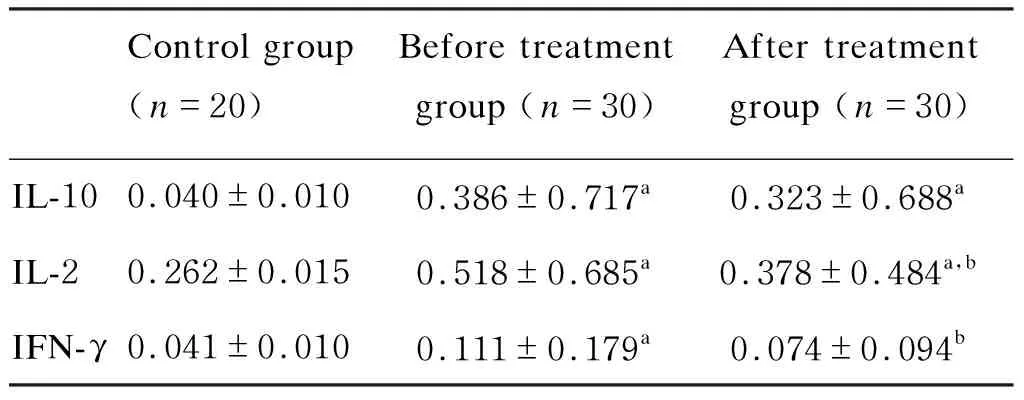
Control group (n=20)Before treatment group (n=30)After treatment group (n=30)IL-100.040±0.0100.386±0.717a0.323±0.688aIL-20.262±0.0150.518±0.685a0.378±0.484 a,bIFN-γ0.041±0.0100.111±0.179a0.074±0.094b
aP<0.05vscontrol group;bP<0.05vsbefore treatment group.
2.2 患者血清中IL-2变化
对照组血清IL-2平均A值为0.262±0.015,治疗前组平均A值为0.518±0.685,治疗后组平均A值为0.378±0.484。治疗前组血清中IL-2水平显著高于对照组,但经药物治疗后迅速下降。与对照组比较,治疗前、后组血清IL-2水平均显著升高 (P<0.05),但治疗后组血清IL-2水平较治疗前组显著降低(P<0.05)(表1)。
2.3 患者血清中IFN-γ变化
对照组血清IFN-γ平均A值为0.041±0.010,治疗前组平均A值为0.111±0.179,治疗后组平均A值为0.074±0.094。与对照组相比,治疗前组血清IFN-γ水平显著升高(P<0.05),但治疗后组与对照组无统计学差异(P>0.05)。治疗后患者血清IFN-γ水平较治疗前显著降低(P<0.05)(表1)。
2.4 患者血清中IL-8变化。
对照组血清IL-8平均A值为0.130±0.082,治疗前组平均A值为1.026±1.112,治疗后组平均A值为1.953±1.291。与对照组相比,治疗前、后组血清IL-8水平显著升高(P<0.01)。治疗后患者血清IL-8水平较治疗前显著升高(P<0.01)(表2、图1)。
表22009甲型H1N1流感患者治疗前后血清IL-8水平与健康者比较(A450值)
Tab.2IL-8serumlevelsinhealthyindividualsandinfluenzavirusA/H1N1/2009-infectedpatientsbeforeandaftertreatment(A450value)

Control group (n=20)Before treatment group (n=30)After treatment group (n=30)IL-80.130±0.0821.026±1.112a 1.953±1.291a,b
aP<0.01vscontrol group;bP<0.01vsbefore treatment group.

CG, control group; BTG, before treatment group; ATG, after treatment group.
图12009甲型H1N1流感患者治疗前后血清IL-8水平与健康者比较(A450值)
Fig.1ComparisonofIL-8serumlevelsinhealthyindividualsandinfluenzavirusA/H1N1/2009-infectedpatientsbeforeandaftertreatment(A450value)
3 讨论
1918年甲型流感病毒大流行,导致近千万人死亡。至今人类仍旧无法有效控制流感病毒,可能与病毒本身突变有关,也可能与其能在人与动物间传播并发生重组,且无法消除动物储存源有关。2009年3月墨西哥暴发的2009甲型H1N1流感是由变异的新型甲型H1N1流感病毒引起的急性呼吸道传染病。2009甲型H1N1流感病毒属正黏病毒科甲型流感病毒属,为单股负链RNA病毒,基因组约为1 316 kb, 由大小不等的8个独立片段组成[2]。2009甲型H1N1流感属于新发疾病,我们前期研究结果提示,2009甲型H1N1流感患者外周血T细胞亚群CD3+T细胞﹑CD4+T细胞和CD8+T细胞均较对照组显著降低[3]。
流感病毒侵入机体后,刺激机体产生一定的免疫反应,从而对机体的细胞因子分泌产生一定影响。在本研究中,30例2009甲型H1N1流感患者治疗前、后的血清细胞因子水平与对照组比较:治疗前血清IL-10、IL-2、IL-8和IFN-γ水平均显著升高。经奥司他韦治疗后3 d,患者血清IL-10、IL-2、IL-8水平仍较对照组显著升高;而IFN-γ水平变化不显著。治疗前、后组比较:IL-10水平变化不显著,IL-2和IFN-γ治疗后显著降低,IL-8治疗后却显著升高。结果提示,2009甲型H1N1流感患者血清细胞因子水平异常。本结果与某些国外研究报道相似,如Nakajima等对因2009甲型H1N1流感死亡患者尸检发现,其血清与肺组织中IL-10、IL-6、IL-2受体(IL-2 receptor, IL-2R)、IFN-α、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和IFN-γ诱导的单核因子(monokine induced by interferon γ,MIG)水平均升高[4]。de Jong等研究发现,H5N1流感重症患者和死亡病例与高细胞因子血症存在一定关联[5]。印度学者研究发现,2009甲型H1N1流感患者疾病严重程度与其血浆中IL-1R拮抗剂(IL-1 receptor antagonist,IL1RA)、IL-2、IL-6、巨噬细胞炎性蛋白-1α(macrophage inflammatory protein-1α,MIP-1α/CCL3)、巨噬细胞炎性蛋白-1β(macrophage inflammatory protein-1β,MIP-1β/CCL4)和 IL-10升高呈正相关[6]。Kawashima等报道的2例2009甲型H1N1流感患者重症病例,一例肺炎合并纵隔气肿和严重低氧血症,另一例肺炎合并脑病,两者早期肺分泌物中均有高水平的IL-8、MCP-1 和MIP-1β。住院5 d后,其IL-1β 、IL-6、IL-10、IL-17、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、粒细胞-巨噬细胞集落刺激因子 (granulocyte-macrophage colony-stimulating factor,GM-CSF)、IFN-γ、MCP-1 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)明显增加[7]。
IL-8是一种具有趋化活性的细胞因子,能够诱导中性粒细胞定向迁移[8],增加炎症反应。体外研究发现,在2009甲型H1N1流感前期,支气管上皮细胞NCI-H292表达的IL-6和IL-8在mRNA和蛋白水平升高不明显,但在感染后期均明显升高[9]。Hagau等研究发现,血清IL-8水平在2009甲型H1N1流感引起急性呼吸窘迫综合征患者中显著升高,轻症患者升高不明显,但肥胖患者中IL-8水平升高更明显[10]。2009甲型H1N1流感住院患者血清IL-8和IL-13水平较对照组和门诊患者显著升高[11]。我们前期研究表明,2009甲型H1N1流感患者白细胞、淋巴细胞、嗜酸性粒细胞无明显变化,中性粒细胞和单核细胞明显偏高[3]。本研究中,2009甲型H1N1流感治疗前、后组患者IL-8水平均较对照组显著升高,且治疗后组比治疗前组升高更显著。这一现象提示,在2009甲型H1N1流感患者体内,中性粒细胞显著升高可能与IL-8水平升高有关,而IL-8可能与奥司他韦抗病毒机制有一定关系。
IFN-γ和IL-8有促进抗病毒免疫作用,同时通过募集中性粒细胞和单核细胞引起呼吸道部位的炎症反应[12]。IFN-γ和IL-12在猪流感病毒的发病机制中起一定作用,可诱导急性反应蛋白的产生[13]。在北美猪流感病毒感染的猪血清中,IFN-γ水平升高并不明显[14]。本研究中,2009甲型H1N1流感治疗前组IFN-γ水平较对照组显著升高,这与A/Texas/36/1991 (H1N1)感染患者鼻腔冲洗液中IL-6、IL-10、IFN-γ和TNF-α均较对照组显著升高的结果类似[15]。治疗后组与对照组比较,IFN-γ水平变化不显著,但较治疗前组显著降低。此现象与Hagau等报道一致[10]。这些结果表明,IFN-γ可能与2009甲型H1N1流感的致病性有关;也可能与奥司他韦抗病毒机制有关。
IL-2主要由激活的CD4+T细胞产生,CD8+T细胞产生量较少,是T细胞自分泌和旁分泌细胞因子,主要生物学活性是刺激靶细胞增殖,增强靶细胞的辅助或杀伤功能,并可诱导杀伤细胞产生IFN-γ、TNF-α等细胞因子。IL-2是驱动颗粒酶B表达和穿孔素介导细胞裂解过程的必要细胞因子[16]。血清IL-1β、IL-2、IL-4和MCP-1水平在2009甲型H1N1流感合并严重肺炎的患儿中比合并轻度肺炎患者显著升高[17]。本文研究数据显示,2009甲型H1N1流感治疗前、后组患者血清IL-2水平均较对照组显著升高,而治疗后组较治疗前组显著降低。结果表明,IL-2可能参与2009甲型H1N1流感发病机制,同时可能是参与奥司他韦抗病毒机制的细胞因子之一。
IL-10是一种重要的抗炎细胞因子。病毒感染早期,IL-10的产生是机体控制和限制病毒感染所致炎症的重要机制之一[18]。IL-10 主要抑制IL-12和IFN-γ分泌,从而促进辅助T细胞(helper T cell,Th细胞)2型分化,而且它是B细胞终分化因子。在B细胞对抗流感病毒抗原时,IL-10起关键作用,有助于在感染中和感染后产生保护性抗体。McKinstry等在小鼠模型中研究发现,流感时IL-10抑制Th-17免疫反应且与保护机制相关[19]。2009甲型H1N1流感住院患者血清IL-10水平较对照组和门诊患者显著升高[11]。2009甲型H1N1流感合并肺炎患者血清 IFN-γ、IL-5、IL-6、IL-8、IL-10、IL-13和MCP-1较未合并肺炎者显著升高[17]。但Kawashima等报道的2例2009甲型H1N1流感患者重症病例中,肺分泌物中IL-4均在正常水平,而合并脑病患者IL-10在入院5 d后明显升高[7]。本研究结果表明,2009甲型H1N1流感治疗前、后组患者血清IL-10水平均显著高于对照组,但治疗前、后组之间血清IL-10水平变化无显著差异。IL-10可能也参与2009甲型H1N1流感的发病机制。
本文初步结果显示,人感染2009甲型H1N1病毒后,外周血清中IL-10、IL-2、IL-8和IFN-γ均显著升高;治疗后由T细胞亚群产生的IL-10、IL-2和IFN-γ均显著降低或无变化,而单核-巨噬细胞产生的IL-8却显著升高,是否与单核-巨噬细胞吞噬病毒有关,值得进一步研究。另外,我们发现2009甲型H1N1流感患者治疗前、后血清细胞因子水平个体差异较大,提示在后续研究中,应该适当增加样本量;选用多种细胞因子检测方法,如核酸检测、生物活性检测等。
本文不足之处是检测时间点不足,未能作完全动态观察。如能在治疗前,治疗后第1天、第3天、第6天采血测定细胞因子水平,就能深入了解人感染2009甲型H1N1流感病毒后外周血清中细胞因子水平的动态变化。
综上所述,本研究结果推测:IL-10、IL-2、IL-8和IFN-γ可能与2009甲型H1N1流感的发病机制有关;IL-2、IFN-γ和IL-8可能参与奥司他韦的抗2009甲型H1N1流感作用。
[1] 卫生部.甲型H1N1流感诊疗方案(2009年试行版第1版) [EB/OL]. http: //www1moh1gov1cn/publicfiles/business/htmlfiles/mohyzs/s3585/200905/40478.htm.
[2] Peris JS, Poon LN, Guam Y. Emergency of a novel swine-origin influenza A virus (S-OIV) H1N1 virus in humans [J]. J Clin Virol, 2009, 45: 169-173.
[3] 沈芳,金鑫,毛会军,高琼,陈戴红.2009甲型流行性感冒病毒感染者常规免疫学检测的临床意义[J].微生物与感染,2009,4(4):198-202.
[4] Nakajima N, Hata S, Sato Y, Tobiume M,Katano H, Kaneko K, Nagata N, Kataoka M, Ainai A, Hasegawa H, Tashiro M, Kuroda M, Odai T, Urasawa N, Ogino T, Hanaoka H, Watanabe M, Sata T. The first autopsy case of pandemic influenza (A/H1N1 pdm) virus infection in Japan: detection of a high copy number of the virus in type Ⅱ alveolar epithelia cells by pathological and virological examination [J]. Jpn J Infect Dis, 2010, 63(1): 67-71.
[5] de Jong MD, Simmous CP, Thanh TT, Hien VM, Smith GJ, Chau TN, Hoang DM, Chau NV, Khanh TH, Dong VC, Qui PT, Cam BV, Hado Q, Guan Y, Peiris JS, Chinh NT, Hien TT, Farrar J. Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia [J]. Nat Med, 2006, 12(10):1203-1207.
[6] Arankalle VA, Lole KS, Arya RP, Tripathy AS, Ramdasi AY, Chadha MS, Sangle SA, Kadam DB. Role of host immune response and viral load in the differential outcome of pandemic H1N1 (2009) influenza virus infection in Indian patients [J]. PLoS One, 2010, 5(10): e13099.
[7] Kawashima H, Go S, Kashiwagi Y, Morishima Y, Miura T, Ushio M, Nishimata S, Takekuma K. Cytokine profiles of suction pulmonary secretions from children infected with pandemic influenza A (H1N1) 2009 [J]. Crit Care, 2010, 14(2): 411.
[8] 王兰兰,吴健民,许化溪,刘辉,李双庆,李金明,胡洪亮,姜傥,唐中,陶志华,康红,曾常茜.临床免疫学与检验[M].北京:人民卫生出版社,2008,192-193.
[9] Lam WY, Yeung AC, Chu IM, Chan PK. Profiles of cytokine and chemokine gene expression in human pulmonary epithelial cells induced by human and avian influenza viruses [J]. Virol J, 2010, 7:344.
[10] Hagau N, Slavcovici A, Gonganau DN, Oltean S, Dirzu DS, Brezoszki ES, Maxim M, Ciuce C, Mlesnite M, Gavrus RL, Laslo C, Hagau R, Petrescu M, Studnicska DM. Clinical aspects and cytokines response in severe H1N1 influenza A virus infection [J]. Crit Care, 2010, 14(6): R203.
[11] Bermejo-Martin JF, Ortiz de Lejarazu R, Pumarola T, Rello J, Almansa R, Ramírez P, Martin-Loeches I, Varillas D, Gallegos MC, Serón C, Micheloud D, Gomez JM, Tenorio-Abreu A, Ramos MJ, Molina ML, Huidobro S, Sanchez E, Gordón M, Fernández V, del Castillo A, Marcos MA, Villanueva B, López CJ, Rodríguez-Domínguez M, Galan JC, Cantón R, Lietor A, Rojo S, Eiros JM, Hinojosa C, Gonzalez I, Torner N, Banner D, Leon A, Cuesta P, Rowe T, Kelvin DJ. Th1 and Th17 hypercytokinemia as early host response signature in severe pandemic influenza [J]. Crit Care, 2009, 13(6): R201.
[12] GeurtsvanKessel CH, Bergen IM, Muskens F,Boon L, Hooqsteden HC, Osterhaus AD, Rimmelzwaan GF, Lambrecht BN. Both conventional and interferon killer dendritic cells have antigen-presenting capacity during influenza virus infection [J]. PLoS One, 2009,4(9): e7187.
[13] Barbé F, Atanasova K, van Reeth K. Cytokines and acute phase proteins associated with acute swine influenza infection in pigs [J]. Vet J, 2011, 187(1): 48-53.
[14] Wesley RD, Lager KM, Kehrli ME Jr. Infection with porcine reproductive and respiratory syndrome virus stimulates an early gamma interferon response in the serum of pigs [J]. Can J Vet Res, 2006, 70(3): 176-182.
[15] Fritz RS, Hayden FG, Cafee DP, Cass LM, Peng AW, Alvord WG, Strober W, Straus SE. Nasal cytokine and chemokine responses in experimental influenza A virus infection: Results of a placebo-controlled trial of intravenous zanamivir treatment [J]. J Infect Dis, 1999, 180(3): 586-593.
[16] Brown DM, Kamperschroer C, Dilzer AM, Roberts DM, Swain SL. IL-2 and antigen dose differentially regulate perforin- and FasL-mediated cytolytic activity in antigen specific CD4+T cells [J]. Cell Immunol, 2009, 257(1-2): 69-79.
[17] Takano T, Tajiri H, Kashiwagi Y, Kimura S, Kawashima H. Cytokine and chemokine response in children with the 2009 pandemic influenza A (H1N1) virus infection [J]. Eur J Clin Microbiol Infect Dis, 2011, 30(1):117-120.
[18] Graham MB, Dalton DK, Giltinan D, Braciale VL, Stewart TA, Braciale TJ. Response to influenza infection in mice with a targeted disruption of the interferon-γ gene [J]. J Exp Med, 1993,178(5):1725-1732.
[19] McKinstry KK, Strutt TM, Buck A, Curtis JD, Dibble JP, Huston G, Tighe M, Hamada H, Sell S, Dutton RW, Swain SL. IL-10 deficiency unleashes an influenza-specific Th17 response and enhances survival against high-dose challenge [J]. J Immunol, 2009, 182(12): 7353-7363.
