肠道病毒71型和柯萨奇病毒A16型多重反转录-聚合酶链反应的建立及初步应用
2011-01-24王婷婷朱汝南钱渊邓洁赵林清王芳邓莉
王婷婷,朱汝南,,钱渊,,邓洁,赵林清,王芳,邓莉
1. 北京大学首都儿科研究所教学医院,北京 100020; 2. 首都儿科研究所病毒研究室,北京 100020; 3. 首都儿科研究所附属儿童医院,北京 100020
手足口病(hand, foot and mouth disease, HFMD)是由肠道病毒引起的一种儿科常见传染病,于1957年首次在加拿大发现暴发病例而被正式研究报道[1]。普通型患者临床一般表现为手掌、足底、臀部皮肤及口腔黏膜的疱疹或疱疹性咽峡炎,症状较轻,病程一般在1周左右,预后良好。但少数重症患儿可引起急性弛缓性瘫痪、脑膜炎、脑干脑炎等神经系统并发症及肺水肿、循环系统障碍,病情危重时可引起死亡[2]。引起手足口病的病原体属于小RNA病毒科肠道病毒属,如柯萨奇病毒A组的2、4、5、7、9、10和16型,B组的1、2、3、4和5型,埃可病毒及新型肠道病毒71型(enterovirus 71,EV71),其中以柯萨奇病毒A16型(coxsackievirus A16,CA16)及EV71为最主要的病原型别。EV71感染被广泛认为是引起手足口病重症及死亡的主要病原。
1974年Schimidt[3]等从美国加利福尼亚地区的1例脑炎患儿中首次分离鉴定EV71,随后,世界上许多国家相继报道了EV71在不同地区的流行情况。近年来,EV71流行在整个东南亚地区呈上升趋势[4-5]。我国于1981年首次报道了上海手足口病病例,1995年武汉病毒研究所首次从手足口病患者中分离出EV71。2008年,安徽省阜阳地区发生了较大规模的手足口病暴发,同年5月手足口病正式列为我国丙类法定传染病。根据卫生部手足口病监测公布的数字,2008年全国共上报488 955例感染,126例死亡[6]。此后, 2009年全国共报告1 155 525例感染,353例死亡[7]。2010年增加至1 774 669例感染,905例死亡[8]。手足口病近年在全国多个省、市的流行越发强势,疾病预防控制形势不容乐观。
本研究室自2007年起开始对首都儿科研究所附属儿童医院接诊的手足口病患儿进行病原学监测。结果显示,北京地区儿童手足口病主要与CA16及EV71感染有关[9],两者常呈交替流行。每年流行优势株略有差异,2007年主要以CA16型为主(占总检测阳性的95.45%)[10],2008年主要以EV71感染为主(占总检测阳性的82.4%)[11],2009年CA16与EV71感染阳性比为2.37∶1[12]。病原的确定除了应用经典的临床标本病毒分离方法外,还应用套式反转录-聚合酶链反应 (reverse transcriptase-polymerase chain reaction,RT-PCR)方法同时进行分子生物学检测。套式或半套式RT-PCR方法检测敏感度高,是目前手足口病病原检测的常用方法。然而在实际操作中,由于其高敏感度,随着监测时间延长,样本量增大,PCR污染问题日益严重;且套式RT-PCR操作过程繁复,1份标本至少要进行6、7个不同的反应,不适合大量样本的检测,故本研究通过建立一种较简便的多重RT-PCR检测方法,用于临床手足口病病原的监测。
1 材料和方法
1.1 标本采集
2010年3~10月,采集首都儿科研究所附属儿童医院感染消化科门诊和急诊中临床诊断或临床疑似手足口病患儿的咽拭子、鼻咽部吸出物(或气管插管深部吸出物)或脑脊液标本,于4 ℃暂存,12 h内送至病毒研究室。
1.2 标本处理
咽拭子及鼻咽部吸出物标本于2 700g离心5 min(脑脊液标本无需离心),吸取150 μl上清液至1.5 ml Eppendorf管内用于RNA提取;吸取600 μl上清液至另一1.5 ml Eppendorf管中用于病毒分离;其余上清液吸取至2 ml Eppendorf管中,-20 ℃暂存,-80 ℃长期保存。标本处理在二级生物安全实验室中进行,操作过程注意无菌操作。
1.3 病毒分离
取标本液0.3 ml接种到培养至长满单层的Vero细胞进行病毒分离,每份标本接种2管;37 ℃吸附2 h后,更换为细胞维持液1 ml,置37 ℃培养;于倒置显微镜下每日观察细胞病变效应(cytopathic effect,CPE),至细胞病变达+++~++++收获,置-80 ℃保存。对培养第7天仍未出现CPE的,盲传2代,每代观察7 d,CPE仍阴性者认为病毒分离结果阴性。
1.4 标本或病毒培养液RNA提取
取标本液或毒株150 μl,采用减量TRIzol法提取RNA,具体操作参照使用说明。
1.5 标本及毒株cDNA合成(反转录反应)
反转录反应采用M-MLV反转录酶试剂盒(InvitrogenTM),反应总体积为40 μl。首先用22 μl DEPC水将提取的RNA充分溶解,加入10 μmol/L随机引物(InvitrogenTM)4 μl,dNTP(各10 μmol/L)2 μl,于65 ℃预反应5 min后,加入5×M-MLVBuffer 8 μl,0.1 mol/L二硫苏糖醇(dithiothreitol,DTT)4 μl,RNA酶抑制剂(TRANSTM)0.1 μl,M-MLV反转录酶 0.4 μl,混合后进行反转录反应。条件为25 ℃ 4 min,37 ℃60 min,70 ℃ 15 min。
1.6 引物设计及多重PCR
从GenBank中下载肠道病毒常见型别5′端非翻译区(untranslated region,UTR)、CA16及EV71基因VP1区序列,应用DNAStar-Megalign进行序列比较分析,用Primer Premier 5.0软件设计针对5′UTR区的1对肠道病毒通用引物pan5′UTR,并在VP1区设计CA16和EV71的型特异性引物,引物序列见表1。引物由上海英骏生物技术有限公司合成。
表1多重RT-PCR反应引物序列
Tab.1PrimersusedinthemultiplexRT-PCR

PrimerSequence (5'→ 3')*Amplicon sizeMelting temperature (℃)pan5'UTR-sAGCACTTCTGTTTCCCCGpan5'UTR-asAGTAGTCGGTTCCGCTGCCA16-vp1-sGTGAAYAAYCAAGTGAAYCGCA16-vp1-asGATGRTTCAACACACATCTMGTYEV71-vp1-sTTCCATAGGAGATAGCGTGAEV71-vp1-asGTGCCYTCAAGAGGGAGAT382 bp55.5184 bp52270 bp52.8
s,sense primer; as, anti-sense primer.
*Degenerate primer abbreviations are as follows: Y, T/C; R, A/G; M, A/C.
多重PCR系统包括:2×GoTaq®Green Master Mix(Promega,USA)12.5 μl,引物均稀释为10 μmol,通用引物pan 5′UTR-s及pan 5′UTR-as各0.05 μl,型特异性引物 CA16-vp1-s、CA16-vp1-as、EV71-vp1-s及EV71-vp1-as各0.5 μl,加无核酸酶水至总体积为22 μl,以3 μl标本反转录反应产物为模板进行扩增。核酸扩增反应条件为94 ℃ 40 s、51.5 ℃ 40 s、72 ℃ 50 s,先进行10个循环;然后以94 ℃ 40 s、49.5 ℃ 40 s、72 ℃ 50 s反应40个循环;反应初先经94 ℃ 6 min预变性,反应最后进行72 ℃ 7 min终延伸。毒株核酸扩增反应条件为94 ℃ 30 s、51.5 ℃ 30 s、72 ℃ 40 s,进行30个循环;反应初先经94 ℃ 5 min预变性,反应最后进行72 ℃ 7 min终延伸。PCR产物用2%琼脂糖凝胶电泳进行分析。
1.7 反应敏感度及特异度检测
将含EV71和CA16目的基因的质粒进行5倍稀释,稀释浓度为5-4~5-12。每浓度取3 μl作为反应模板,按照上述方法进行多重RT-PCR的敏感度检测。
选取既往临床标本中经直接免疫荧光法或PCR法分别鉴定为CA16,EV71,呼吸道合胞病毒,副流感病毒1型、3型,鼻病毒,轮状病毒,爱知病毒(aichivirus)阳性的标本反转录产物和腺病毒3型、7型,人Boca病毒,巨细胞病毒阳性标本作为多重RT-PCR特异性检测模板。
1.8 应用多重RT-PCR进行标本检测
选取临床标本中经病毒分离阳性的毒株和标本,应用多重RT-PCR进行核酸检测。
2 结果
2.1 多重RT-PCR的敏感度研究
含肠道病毒5′UTR基因质粒的初始浓度为20 μg/ml,pan 5′UTR引物检测到的模板最高稀释度为5-11(即浓度为0.41 pg/ml);含CA16-vp1基因质粒的初始浓度为52 μg/ml,CA16-vp1引物可检测到的最高模板稀释度为5-10(即浓度为5.32 pg/ml);含EV71-vp1基因质粒的初始浓度为31.1 μg/ml,EV71-vp1引物可检测到的最高模板稀释度为5-11(即浓度为0.64 pg/ml)。敏感度实验结果见图1。
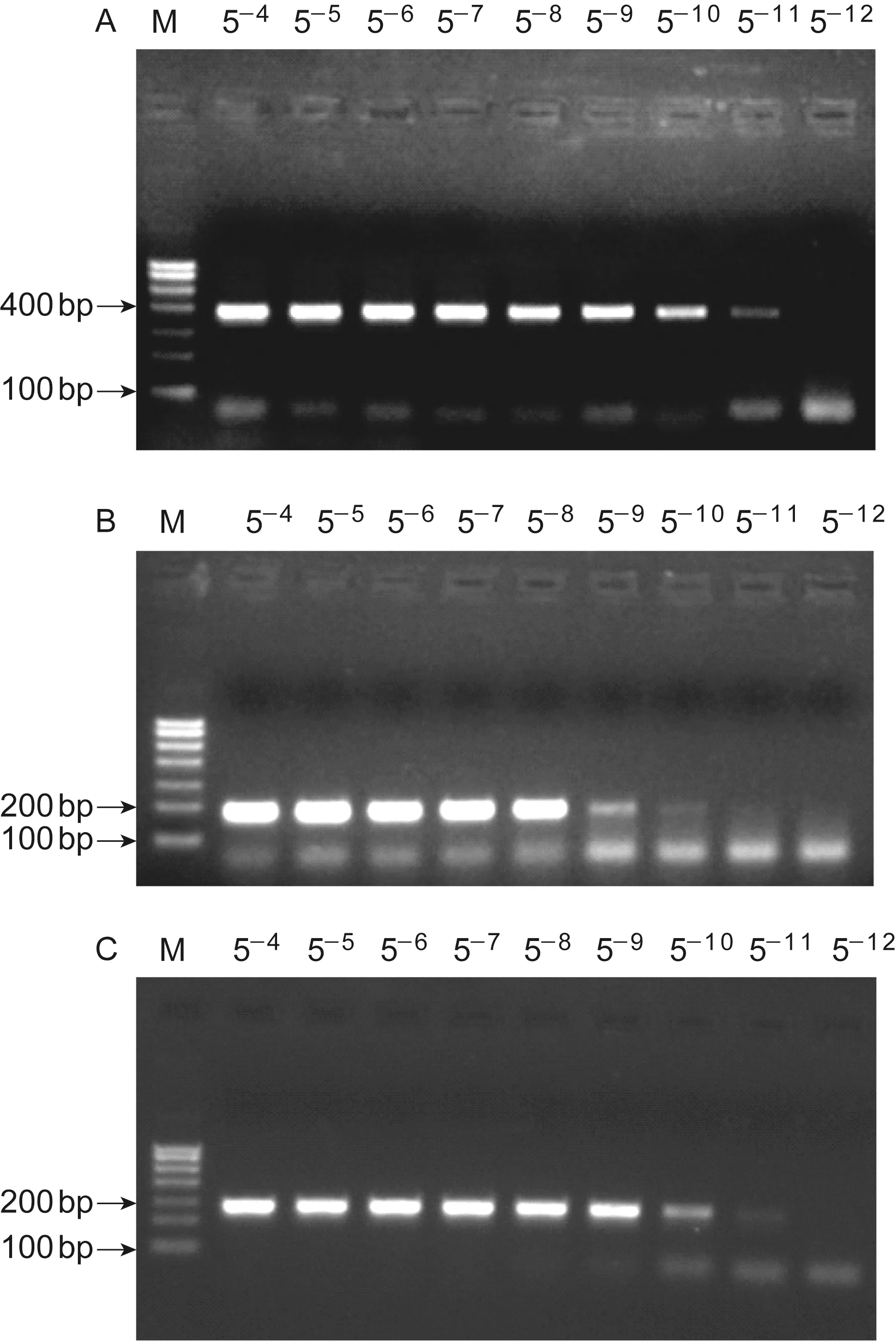
A: Primer pan 5′UTR. B: Primer CA16-vp1. C: Primer EV71-vp1.
图1多重RT-PCR的敏感度
Fig.1ThesensitivityofmultiplexRT-PCR
2.2 多重RT-PCR的特异度研究
本研究建立的多重RT-PCR结果判读标准:通用引物及CA16-vp1引物扩增均阳性者为CA16阳性;通用引物及EV71-vp1引物扩增均阳性者为EV71阳性;仅通用引物阳性者判定为小RNA病毒科肠道病毒感染;3对引物扩增均无阳性条带者判定为阴性。CA16阳性标本经多重RT-PCR扩增后,在400 bp及200 bp附近均有阳性条带,与设计时预期的多重RT-PCR CA16检测阳性结果相符(第1孔);EV71阳性标本扩增后,在400 bp及300 bp附近均有阳性条带,与设计时预期的多重RT-PCR EV71检测阳性结果相符(第2孔);特异性检测中除CA16及EV71外,其他病毒阳性标本均无阳性扩增条带出现,显示本反应系统的特异度为100%(图2)。

Lanes 1-12, PCR products obtained by multiplex RT-PCR from clinical samples previously positive for CA16, EV71, respiratory syncytial virus, parainfluenza virus type 1 and type 3, adenovirus type 3 and type 7, rhinovirus, rotavirus, aichivirus, cytomegalovirus, and human bocavirus, respectively; M, PCR markerⅠ(TRANSTM); NC, negative control using DEPC H2O as the template.
图2多重RT-PCR的特异度
Fig.2ThespecificityofmultiplexRT-PCR
2.3 多重RT-PCR检测临床手足口病标本
选取2010年3~10月本研究室收集的371例手足口病患儿标本381份(包括咽拭子标本353份、痰或肺深部吸出物19份、脑脊液9份),采用多重RT-PCR方法进行病毒RNA检测。结果显示,通用肠道病毒核酸阳性295份,RT-PCR检测总阳性率77.4%。其中CA16阳性121份,检测阳性率为31.8%(121/381);EV71阳性135例,检测阳性率为35.4%(135/381);CA16与EV71检测阳性率之比为1∶1.1。不同类型标本具体检测情况见表2。381份标本中共有165份病毒分离鉴定阳性,病毒分离阳性率为43.3%。选取病毒分离阳性的标本154份,同时进行标本和毒株的多重RT-PCR检测。结果显示,154份标本中,多重RT-PCR共检测出80份CA16阳性、69份EV71阳性。而以病毒分离为标准,154份毒株中,共检测出84份CA16阳性、70份EV71阳性。多重RT-PCR反应检测CA16的准确率为95.2%,检测EV71的准确率为98.6%,见表3。部分标本及毒株多重RT-PCR结果见图3。

A: Clinical samples. B: Cell culture supernatant.
Lanes 1-6, S569, S584, S585, S586, S587, and S588, which were positive for EV71, CA16, CA16, CA16, EV71, and EV71, respectively; M, PCR marker I (TRANSTM).
图3多重RT-PCR检测部分标本及毒株中CA16和EV71
Fig.3DetectionresultsofCA16andEV71inclinicalsamplesandcellculturesupernatantusingmultiplexRT-PCRassay
表2多重RT-PCR检测不同类型标本中CA16和EV71
Tab.2DetectionresultsofCA16andEV71indifferentsampletypesbymultiplexRT-PCR

Sample typeNumber of samplesNumber of positive samplesCA16 EV71 Throat swab353121(34.3%)130(36.8%)Nasopharyngeal aspirate1905(26.3%)Cerebrospinal fluid900
表3应用多重RT-PCR进行标本与毒株检测的结果对比
Tab.3ComparisonofthedetectionofCA16andEV71fromclinicalsamplesandcellculturesupernatantisolatedfromthesamesamplesusingmultiplexRT-PCR

Number of positive clinical samples Number of positive cell culture supernatantDetection accuracyCA16808495.2%EV71697098.6%Total14915496.8%
3 讨论
本研究设计时将CA16及EV71型特异性引物的扩增片段位于2种病毒核酸序列的相同位置上,在同一管中反应,可形成一定的模板竞争,减少非特 异性产物的扩增。在预实验中,5′UTR-s及5′UTR-as的敏感度较高,达到5-13,故在反应体系配制时,通用引物浓度仅为其余2对型特异性引物的1/10。这样的配制方法可防止通用引物过度扩增造成dNTP和酶过量消耗,既达到5′UTR区目的片段有效扩增,又保证CA16及EV71型特异性引物充分扩增。多重RT-PCR反应系统比单一PCR的反应复杂,在进行扩增时,一般选用的退火温度比引物理论退火温度低2 ℃左右。受降落PCR(touchdown PCR)原理提示,本实验在反应中采用2个退火温度,最初在较高退火温度先进行10个循环的目标片段富集,之后在较低温度进行扩增,这样既可提高特异度,又保证扩增效率。
在相同条件下,本实验室以往使用的套式PCR的敏感度可达5-12,而本实验方法的敏感度为5-10~5-11。虽有一定差别,但由于套式PCR操作繁复、工作量大、污染问题较严重,故对大量标本,套式PCR的高敏感度有些“得不偿失”。本实验方法仅需2个反应即可得到阳性结果,适用于大量标本筛查。对于筛查阴性的标本,可适当增大模板量,进行二次检测,提高检出率,弥补其敏感度较低的缺点。
本实验有5例标本经病毒分离鉴定为阳性,但标本多重RT-PCR检测为阴性。其中有3例经套式PCR检测为阳性(EV71阳性1例、CA16阳性2例),考虑与实验敏感度不同且标本模板含量过少有关;另有2例CA16病毒分离阳性的标本按本实验及套式PCR方法经多次扩增结果均为阴性,因其毒株PCR扩增为阳性,认为标本中可能含有PCR抑制物。Xiao等[13]通过研究发现,约2.3%的咽拭子标本中存在PCR抑制物,一般处理难以去除,导致普通PCR扩增产生假阴性结果。此时,病毒分离及血清学检测是病毒感染重要的参考指标。
核酸检测是目前病毒检测的常用方法之一,方便、快捷,普通实验室即可进行,在基层单位及医院实验室同样适用。病毒分离技术要求较高,检测周期长,不适用于一般临床检测。但是核酸检测需要待检标本核酸的目标片段与实验设计的引物相符,在不明病原感染或常见病毒发生显著变异、产生新的毒株或型别时,PCR具有一定的局限性。故病毒分离技术作为病毒检测的“金标准”,仍有着其他技术不可替代的重要作用,尤其是对于网络监测实验室及各级疾病预防控制中心,病毒分离与核酸检测、血清学检测等技术相结合,才能更好达到病毒检测及监测的目的。
随着近年来EV71的流行,各国对EV71检测方法的探讨也逐渐深入。多数学者认为,核酸检测的敏感度高、操作简便、检测时间短,适用于EV71的快速实验室诊断。血清学诊断方面,多采用急性期与恢复期双份血清中和抗体效价检测方法,不适用于疾病的早期诊断。重症EV71患儿多在发病1~5 d出现神经系统症状,此时血清中IgM抗体已可检测到。Wang等[14]采用捕获酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测EV71感染患者的血清IgM抗体,敏感度和特异度分别达到97.7 %和93.3%,且多数抗体阳性血清采集于发病7 d内。本实验室检测血清IgM抗体采用的是间接免疫荧光法,操作简便,耗时短(2 h左右),在累积一定判读经验后,与核酸检测相结合,在手足口病流行季节起重要的辅助诊断作用。另外,标本的选择和采集质量对于病毒分离和核酸检测至关重要。对于肠道病毒,尤其是CA16及EV71,临床标本中以咽拭子的核酸检出率和病毒分离率最高[15],这与病毒在疾病初期常在扁桃体处大量复制有关。因为其采集方便,尤其适用于手足口病普通型患儿的临床筛查和疾病监测。疱疹液的检出率次之,且仅限于有明显皮肤疱疹的患儿。对于重症患儿,如果入院时已出现抽搐、昏迷或需进行呼吸机辅助通气,不利于咽拭子采集,且又无疱疹病变,因肠道病毒多在肠道淋巴结处大量复制,粪便中有排毒,此时可留取粪便标本或肛拭子进行病原检测,检出率及分离率也较高。对于出现明显神经系统症状的患儿,许多临床医师会选择脑脊液标本检测,但因EV71多引起脑实质病变,在脑脊液中含量较低。许多文献[13,16,17]均反映脑脊液标本检测的阳性率低,病毒分离困难,这也与本实验室在实际工作中遇到的情况相似。故对于临床疑似EV71感染患儿,不推荐首选脑脊液标本送检;对于送检的脑脊液标本,应试用敏感度更高的实时PCR 方法[18,19]检测病毒核酸及多种细胞联合培养进行病毒分离[15,20],以获得更好的检出率。EV71引起的呼吸困难、呼吸衰竭多由神经源性肺水肿引起,肺内并无病毒感染灶,故痰液及肺深部吸出物等呼吸道标本中病毒含量低(特别是肺泡灌洗液),核酸检出率及病毒分离率也较低。临床在选择标本时,对呼吸道分泌物标本的送检应仔细斟酌;实验室在提取呼吸道分泌物标本RNA时,建议加大提取RNA的初始标本量;使用QIAamp®Viral RNA Mini Kit等薄膜吸附法,使痰液中的病毒核酸得以富集,以提高检测率。对于重症患儿,建议选择2种不同的标本同时送检,如咽拭子加疱疹液或咽拭子加肛拭子,并及时留取血清标本,既可提高辅助诊断效率,又可给后期的基础研究提供材料。
多重RT-PCR检测成本低廉,适用于较大量样本的筛查及监测。但本研究通过标本与毒株的多重RT-PCR检测结果对比发现,标本的多重RT-PCR检测结果条带不如毒株清晰,有时会出现杂带及假阴性结果,需重复检测,这与标本中杂质较多且病毒含量不稳定有关。规范的临床标本采集和更高效的病毒核酸提取方法有助于提高多重RT-PCR检测阳性率;也可在本实验基础上,进一步研究多重One-Step RT-PCR方法,有望将检测过程进一步缩短、优化。
[1] Robinson CR, Doane FW, Rhodes AJ. Report of an outbreak of febrile illness with pharyngeal lesions and exanthem: Toronto, summer 1957—isolation of group A coxsackie virus [J]. Can Med Assoc J, 1958, 79(8): 615-621.
[2] Huang CC, Liu CC, Chang YC, Chen CY, Wang ST, Yeh TF. Neurologic complications in children with enterovirus 71 infection [J]. N Engl J Med, 1999, 341(13): 936-942.
[3] Schmidt NJ,Lennette EH,Ho HH. An apparently new enterovirus isolated from patients with disease of the central nervous system [J]. J Infect Dis,1974, 129(3): 304-309.
[4] Chen KT, Chang HL, Wang ST, Cheng YT, Yang JY. Epidemiologic features of hand-foot-mouth disease and herpangina caused by enterovirus 71 in Taiwan, 1998-2005 [J]. Pediatrics, 2007,120(2): e244-e252.
[5] Ang LW, Koh BK, Chan KP, Chua LT, James L, Goh KT. Epidemiology and control of hand, foot and mouth disease in Singapore, 2001-2007 [J]. Ann Acad Med Singapore, 2009, 38(2): 106-112.
[6] 中华人民共和国卫生部.卫生部公布2009年1月及2008年度全国法定报告传染病疫情(EB/OL). http: //www.moh.gov.cn/publicfiles/business/htmlfiles/mohbgt/s3582/200902/39079.htm.
[7] 中华人民共和国卫生部.卫生部公布2010年1月及2009年度全国法定传染病疫情(EB/OL). http: //www.moh.gov.cn/publicfiles/business/htmlfiles/mohbgt/s10639/201002/46043.htm.
[8] 中华人民共和国卫生部.卫生部公布2011年1月及2010年度全国法定传染病疫情概况(EB/OL). http: //www.moh.gov.cn/publicfiles/business/htmlfiles/mohjbyfkzj/s3578/201102/50646.htm.
[9] 朱汝南,钱渊,邓洁,邢江峰,赵林清,王芳,廖斌,任晓旭,李颖,张琪,李杰.北京市儿童手足口病与肠道病毒71型和柯萨奇病毒A组16型感染有关[J]. 中华流行病学杂志,2007,28(10): 1004-1008.
[10] 赵惠欣,张艳玲,张奕,邓洁,朱汝南,钱渊. 2007年北京儿童中流行的手足口病病原学及临床特点[J]. 临床儿科杂志,2008,26(6): 467-469.
[11] 邓洁,朱汝南,钱渊,孙宇,李玉运,邓莉,黄荣妍,王芳,赵林清,张燕玲. 2007~2008年北京地区儿童手足口病的病原学分析[J]. 中华检验医学杂志,2009,32(10): 1124-1127.
[12] 伏瑾,张艳玲,孙春荣,刘燕燕,崔小岱,王天有.实时RT-PCR检测159例手足口病患儿样本中肠道病毒的结果分析[J]. 中华实验和临床病毒学杂志,2009,23(6): 488-490.
[13] Xiao XL, He YQ, Yu YG, Yang H, Chen G, Li HF, Zhang JW, Liu DM, Li XF, Yang XQ, Wu H. Simultaneous detection of human enterovirus 71 and coxsackievirus A16 in clinical specimens by multiplex real-time PCR with an internal amplification control [J]. Arch Virol, 2009,154(1): 121-125.
[14] Wang SY, Lin TL, Chen HY, Lin TS. Early and rapid detection of enterovirus 71 infection by an IgM-capture ELISA [J]. J Virol Methods, 2004,119(1): 37-43.
[15] Ooi MH, Solomon T, Podin Y, Mohan A, Akin W, Yusuf MA, del Sel S, Kontol KM, Lai BF, Clear D, Chieng CH, Blake E, Perera D, Wong SC, Cardosa J. Evaluation of different clinical sample types in diagnosis of human enterovirus 71-associated hand-foot-and-mouth disease [J]. J Clin Microbiol, 2007, 45(6): 1858-1866.
[16] Wang JR, Tsai HP, Chen PF, Lai YJ, Yan JJ, Kiang D, Lin KH, Liu CC, Su IJ. An outbreak of enterovirus 71 infection in Taiwan, 1998. II. Laboratory diagnosis and genetic analysis [J]. J Clin Virol, 2000, 17(2): 91-99.
[17] Fujimoto T, Chikahira M, Yoshida S, Ebira H, Hasegawa A, Totsuka A, Nishio O. Outbreak of central nervous system disease associated with hand, foot, and mouth disease in Japan during the summer of 2000: detection and molecular epidemiology of enterovirus 71 [J]. Microbiol Immunol, 2002,46(9): 621-627.
[18] Verstrepen WA, Bruynseels P, Mertens AH. Evaluation of a rapid real-time RT-PCR assay for detection of enterovirus RNA in cerebrospinal fluid specimens [J]. J Clin Virol, 2002, 25 (Suppl 1): S39-S43.
[19] Dierssen U, Rehren F, Henke-Gendo C, Harste G, Heim A. Rapid routine detection of enterovirus RNA in cerebrospinal fluid by a one-step real-time RT-PCR assay [J]. J Clin Virol, 2008, 42(1): 58-64.
[20] Terletskaia-Ladwig E, Meier S, Hahn R, Leinmüller M, Schneider F, Enders M. A convenient rapid culture assay for the detection of enteroviruses in clinical samples: comparison with conventional cell culture and RT-PCR [J]. J Med Microbiol, 2008, 57(pt8): 1000-1006.
