HPLC法测定大鼠肝微粒体中洛伐他汀含量的方法学研究
2011-01-24姚卓贤夏宗玲于锋
姚卓贤,夏宗玲,于锋
(1.中国药科大学,南京市 210009;2.江苏常州市第一人民医院药剂科,常州市 213001)
HPLC法测定大鼠肝微粒体中洛伐他汀含量的方法学研究
姚卓贤1,2*,夏宗玲2,于锋1#
(1.中国药科大学,南京市 210009;2.江苏常州市第一人民医院药剂科,常州市 213001)
目的:考察测定大鼠肝微粒体中洛伐他汀含量的方法学。方法:采用高效液相色谱法,内标为地西泮,色谱柱为UltimateXB-C18,流动相为乙腈-水(70∶30),流速为1.0mL·min-1,检测波长为238nm,柱温为30℃,进样量为20μL。结果:大鼠肝微粒体中洛伐他汀检测浓度的线性范围为2.5~40μmol·L-1(r=0.9983),低、中、高浓度洛伐他汀溶液的日内RSD分别为5.44%、2.89%、2.83%,日间RSD分别为5.48%、1.84%、1.91%,方法回收率分别为(109.24±3.28)%、(104.82±5.92)%、(102.17±1.92)%,绝对回收率分别为(104.65±2.93)%、(113.72±6.25)%、(101.92±1.89)%。结论:方法学考察结果表明,本方法简单易行、灵敏度高,可用于肝微粒体中洛伐他汀的含量测定。
高效液相色谱法;洛伐他汀;大鼠;肝微粒体;含量测定
他汀类药物为3-羟基-3甲基戊二酰辅酶A还原酶抑制剂,是目前临床上广泛应用于调节血脂的药物,占据了全球调节血脂类药物60%的市场份额[1]。其能使血浆胆固醇浓度降低,并已有文献[2]证明该类药物可降低高血脂患者发生心血管疾病的风险和冠心病患者的死亡率。在动脉粥样硬化形成的众多因素中,高血脂与动脉粥样硬化密切相关,也是冠心病的独立因素[3]。洛伐他汀(Lovastatin)是他汀类降脂药,该药物口服吸收后主要分布于肝脏中[4],经肝细胞色素P450(CYP)同工酶CYP3A4通道代谢成无活性的产物排出体外。近年来,随着医药学的发展进步,多药联用越来越普遍,发生药物相互作用及不良反应的可能性也随之增加,为此,笔者建立了在大鼠离体肝微粒体中测定洛伐他汀含量的方法并进行了方法学考察。虽然没有对大鼠肝微粒体中洛伐他汀的含量进行测定,但本方法可为其含量测定打下基础。
1 仪器与材料
1.1 仪器
高效液相色谱(HPLC)系统,包括2996紫外检测器、1525双元梯度泵、717自动进样器、Empower色谱工作站(美国Waters公司);电子分析天平(塞多利斯科学仪器(北京)有限公司,精密度:1×10-5g);5417R高速台式离心机(德国Effendorf公司);低温冰箱(日本Sanyo公司);旋涡混合器(上海医科大学仪器厂);恒温振荡水槽(上海精宏仪器设备有限公司);雪花制冰机(北京长流科学仪器公司)。
1.2 试药
洛伐他汀原料药(浙江省江北药业有限公司,批号:090301,纯度:96%);地西泮对照品(中国药品生物制品检定所,批号:230-9601,纯度:99%);乙腈(上海试一化学试剂有限公司,HPLC级,纯度:>99.7%);水为超纯水;枸橼酸三钠盐、枸橼酸脱氢酶、氧化/还原型辅酶Ⅱ均购于Sigma-Aldrich(上海)试剂公司。
1.3 动物
SD大鼠,♂,体重200~250g,月龄1.5个月,购于上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2003-0003。
2 方法与结果
2.1 色谱条件
色谱柱:Ultimate XB-C18(250mm×4.6mm,5µm);流动相:乙腈-水(70∶30);检测波长:238nm;流速:1.0mL·min-1;柱温:30℃;进样量:20µL。
2.2 溶液的制备
2.2.1 洛伐他汀贮备液。精密称取洛伐他汀原料药40.45mg,置于25mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。2.2.2地西泮溶液。精密称取地西泮对照品5.4mg,置于25mL容量瓶中,加甲醇溶解并稀释至刻度,混匀得216μg·mL-1的地西泮溶液,待用。
2.2.3 再生系统的制备。枸橼酸三钠盐2.8mg、枸橼酸脱氢酶0.5mg(相当于10u)、0.15mol·L-1氯化镁0.1mL、0.1mol·L-1三羟甲基氨基甲烷盐酸盐(Tris-HCl)缓冲液(pH7.4)0.9mL,混合,可根据需要按比例制备一定量,临用新配。
2.3 微粒体样品处理[5]
取大鼠离体肝微粒体适量,用新鲜制备的再生系统稀释成蛋白浓度为1.0mg·mL-1的混悬液,取此混悬液0.2mL,加洛伐他汀贮备液2μL,混匀,加启动剂(氧化/还原型辅酶Ⅱ的0.1%碳酸氢钠溶液,终浓度为0.25mmol·L-1/0.1mmol·L-1),放入温度为37℃的水箱中,孵育20min后取出,加入冰冷的乙腈0.2mL(含10μL地西泮,终浓度为5.4μg·mL-1)沉淀蛋白,涡旋1min,15000r·min-1离心10min,即得样品溶液。取上清液20μL进样测定。
2.4 色谱行为
取大鼠离体微粒体适量,用新鲜制备的再生系统稀释成蛋白浓度为1.0mg·mL-1的混悬液,将此混悬液沉淀蛋白后取上清液作为空白肝微粒体;然后在空白肝微粒体混悬液中加入洛伐他汀贮备液2μL、地西泮溶液10μL,再将此混悬液沉淀蛋白后取上清液;将上述2种上清液及样品溶液,按“2.1”项下色谱条件进样测定,记录色谱。结果,洛伐他汀与内标物地西泮的保留时间分别为12.42、6.07min,色谱峰分离良好,且空白肝微粒体中未见杂质峰干扰,色谱详见图1。

图1 高效液相色谱图A.空白肝微粒体;B.空白肝微粒体+洛伐他汀+地西泮;C.样品溶液;1.洛伐他汀;2.地西泮Fig1 HPLC chromatogramsA.blank liver microsome;B.blank liver microsome+lovastatin+diazepam;C.sample solution;1.lovastatin;2.diazepam
2.5 标准曲线的制备
取一定量洛伐他汀贮备液,加甲醇稀释成含洛伐他汀40、20、10、5、2.5μmol·L-1的系列溶液,按“2.3”项下方法处理后,取20µL进样,记录色谱。以溶液中待测物洛伐他汀浓度(X)为横坐标,待测物与内标物的峰面积比值(Y)为纵坐标进行回归分析,得回归方程为Y=0.0355X+0.0102(r=0.9983)。结果表明,大鼠肝微粒体中洛伐他汀浓度与峰面积比值在检测浓度2.5~40μmol·L-1范围内呈良好线性关系。
2.6 精密度试验
取一定量洛伐他汀贮备液,加甲醇稀释成含洛伐他汀3.75、10、30μmol·L-1的溶液,按“2.3”项下方法处理后,取20µL进样,同日内重复测定5次,连续测定3d,计算洛伐他汀的日内RSD和日间RSD。精密度试验结果见表1。
表1 精密度试验结果(±s,n=5)Tab1 Results of precision tes(t±s,n=5)
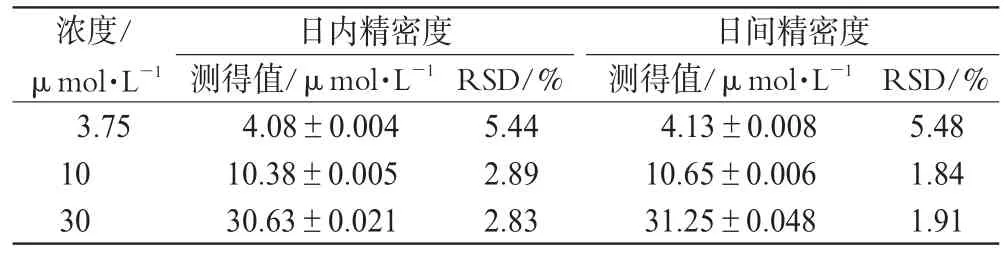
表1 精密度试验结果(±s,n=5)Tab1 Results of precision tes(t±s,n=5)
浓度/μmol·L-1 3.751030日内精密度测得值/μmol·L-1 4.08±0.00410.38±0.00530.63±0.021RSD/%5.442.892.83日间精密度测得值/μmol·L-1 4.13±0.00810.65±0.00631.25±0.048RSD/%5.481.841.91
2.7 回收率试验
取一定量洛伐他汀贮备液,加甲醇稀释成含洛伐他汀3.75、10、30μmol·L-1的溶液,按“2.3”项下方法处理后,取20µL进样,每个浓度进行5个样本分析,计算方法回收率(即将所得信号比值代入回归方程,求得测定值,与加入量比较)及绝对回收率(即测得洛伐他汀和内标物峰面积的比值与相同浓度的洛伐他汀和内标物的纯溶液的峰面积比值比较),结果见表2。
表2 回收率试验结果(±s,n=5)Tab2 Results of recovery test(±s,n=5)

表2 回收率试验结果(±s,n=5)Tab2 Results of recovery test(±s,n=5)
RSD/%2.995.641.87加入量/μmol·L-1 3.751030测得值/μmol·L-1 4.09±0.1210.48±0.5930.74±0.58绝对回收率x/%104.65±2.93113.72±6.25101.92±1.89RSD/%2.805.491.86方法回收率x/%109.24±3.28104.82±5.92102.17±1.92
2.8 稳定性考察
制备浓度为3.75、10、30μmol·L-1的洛伐他汀溶液,按“2.3”项下方法处理后,将样品放置在室温及4℃冰箱内,于0、1、5、24、30、48、72h分别进样分析。结果,RSD均<5.41%,表明样品溶液在室温及4℃下放置72h内稳定。
3 讨论
有文献[6]报道,以乙腈-磷酸为流动相采用线性梯度洗脱法测定洛伐他汀的含量,但此法操作比较烦琐,不利于常规实验室测定。笔者分别尝试使用甲醇-水=50∶50、70∶30,以及乙腈-水=50∶50、70∶30作为流动相进行测定,结果表明,当乙腈-水=70∶30为流动相时,色谱分析在14min内完成,洛伐他汀、内标物和杂质分离完全,可用于大鼠肝微粒体中洛伐他汀的含量测定。
本试验结果表明,本文所建立的肝微粒体中洛伐他汀含量的测定方法,简单易行,灵敏度高,具有可操作性,便于在临床上推广应用。
[1]蔡德山.“他汀类”调血脂药物市场分析[J].中国医药技术经济与管理,2008,2(7):9.
[2] 庞国强.他汀类药物的药理与临床应用[J].中国医药导报,2010,7(1):11.
[3] 王忠全,丁卓玲.4种他汀类药物治疗高血脂症成本-效果分析[J].中国药房,2007,18(26):2008.
[4] 邓万俊.他汀类药物与其他药物的相互作用[J].中国新药与临床杂志,2006,25(2):131
[5] 夏宗玲,许建平,邹素兰.探针药物法测定CYP4503A的活性[J].药学与临床研究,2010,18(2):142.
[6] 张西如,高燕霞,姜建国.RP-HPLC测定洛伐他汀及片剂的有关物质[J].中国现代应用药学,2009,26(13):1148.
Methodological Study of Content Determination of Lovastatin in Rat Liver Microsomes by HPLC
YAO Zhuo-xian,YU Feng
(China Pharmaceutical University,Nanjing 210009,China)
YAO Zhuo-xian,XIA Zong-ling
(Dept.of Pharmacy,Changzhou First People’s Hospital in Jiangsu Province,Changzhou 213001,China)
OBJECTIVE:To investigate the methology of the content determination of lovastatin in rats liver microsomes.METHODS:HPLC method was adopted with diazepam as internal standard.The determination was performed on UltimateXB-C18column with mobile phase consisted of acetonitrile-water(70∶30)at a flow rate of 1.0mL·min-1.The detection wavelength was set at 238nm and column temperature was 30℃.The injection volume was 20μL.RESULTS:The calibration curves of lovastatin were linear in the range of 2.5~40μmol·L-1(r=0.9983).The intra-day RSD of lovastatin at low,medium and high concentrations were 5.44%,2.89%and 2.83%,and the inter-day RSD were 5.48%,1.84%and 1.91%,respectively.The relative recoveries were(109.24±3.28)%,(104.82±5.92)%,(102.17±1.92)%,and the absolute recoveries were(104.65±2.93)%,(113.72±6.25)%,(101.92±1.89)%,respectively.CONCLUSION:Results of methological study show that the method is simple,sensitive and suitable for the content determination of lovastatin in rat liver microsomes.
HPLC;Lovastatin;Rat;Liver microsomes;Content determination
R972+.6;R969
A
1001-0408(2011)17-1562-02
*药师。研究方向:医院药学。电话:0519-68870866。E-mail:sylvia2819@hotmail.com
#通讯作者:教授,博士。研究方向:临床药学和药理学。电话:025-83271299。E-mail:yufengcpu@163.com
2010-07-12
2010-10-10)
