早期胃癌的还氧合酶-2、抑癌基因P16和肝细胞生长因子表达
2011-01-23韩玉龙尹家俊
韩玉龙 ,孙 雷 ,尹家俊
(1.大连大学 附属中山医院 普外二科,辽宁 大连 116001;2.大连医科大学 病理学教研室,辽宁 大连 116044)
胃癌是影响人类健康的常见的恶性肿瘤,其在消化系统恶性肿瘤中占第1位,每年死于胃癌者25.16/10万。随着环境、饮食等因素的变化,其发病率正逐年增高。胃癌的发生发展是一个多基因参与的多步骤的过程,与其他恶性肿瘤一样,其发病机制尚不完全清楚。能够找到在胃癌的发生发展中众多基因相互作用的机制,一直是人们潜心研究的重要课题和努力方向。
还氧合酶(COX-2)、抑癌基因P16以及肝细胞生长因子(HGF)和胃癌的发生有一定的关系。但研究结论并不一致,而且有关早期胃癌中COX-2、P16 和HGF三者之间蛋白表达的相关性的研究至今未见报道。本研究试图通过免疫组化方法检测早期胃癌组织中COX-2、P16 和HGF蛋白表达,旨在探讨三者之间的相关性及意义。
1 材料和方法
1.1 一般资料
随机选取大连大学附属中山医院及大连市中心医院2005~2007年间手术切除的早期胃癌30例。所有患者术前均未行放疗及化疗。同时,选择同期10例不典型增生胃组织和10例正常胃组织作为对照。
1.2 试剂和方法
采用免疫组织化学SP法,COX-2一抗为鼠抗人单克隆抗体,购自福州迈新生物技术开发有限公司,P16一抗为鼠抗人单克隆抗体,购自北京中杉金桥生物技术有限公司,HGF一抗为兔抗人多克隆抗体,购自武汉博士德生物工程有限公司,均为即用型试剂,SP超敏试剂盒:内源性过氧化物酶阻断剂、正常非免疫动物血清、生物素标记的第二抗体、链霉素抗生物素蛋白-过氧化酶、DAB显色试剂,均购自福州迈新生物技术开发有限公司。
1.3 结果判定
COX-2和HGF阳性染色者在细胞膜和细胞浆有棕黄色颗粒沉着,P16阳性染色者在细胞核或细胞浆有棕黄色颗粒沉着,两位病理医师独立观察每张切片随机选区的10个高倍视野,采用双评分半定量法,根据染色程度及染色细胞的百分率进行评分,基本不着色者为0分,着色淡者为1分,着色深者为2分;着色细胞占计数细胞百分率<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。将每张切片着色程度得分与着色细胞百分率各自相乘,为其最后得分。0~1为阴性(-),2~3为低度阳性(+),4~5为中度阳性(++),6以上为高度阳性(+++)。
1.4 统计学方法
3样本各自在3种之间的比较,采用多组有序变量资料的秩和检验方法,P<0.05为差异有统计学意义,两样本间相关性分析,采用Kendall's tau-b 相关分析方法,当P<0.05、R接近+1或-1时表明有显著的相关性。所有统计均由SPSS 11.5统计软件包完成。
2 结 果
2.1 COX-2的表达情况
正常胃组织呈阴性表达;不典型增生胃组织阳性表达较多,且有3例强阳性表达,早期胃癌组织主要呈弱阳性至强阳性表达,主要位于肿瘤细胞的胞浆,在高倍镜下呈棕黄色颗粒弥漫性的分布与癌细胞胞浆或沿核膜周边呈线状分布。由表1可见,正常胃组织→不典型增生胃组织→早期胃癌组织,COX-2呈上调趋势。早期胃癌组织与正常胃组织比较、不典型增生胃组织与早期胃癌组织比较,差异具有显著性意义(P<0.01),而正常胃组织与不典型增生胃组织比较,差异无显著性意义(P>0.05)。
2.2 P16的表达情况
在正常胃组织中,P16从不表达至强阳性,位于细胞核或细胞浆,也是呈现棕黄色颗粒弥漫性分布;在不典型增生胃组织中,呈不表达或弱阳性表达;在早期胃癌组织中,不表达和弱阳性表达率明显升高,仅有2例强阳性表达。由表1可见,正常胃组织→不典型增生胃组织→早期胃癌组织,P16的表达呈下调趋势。正常胃组织与不典型增生组织比较,差异无显著性意义;不典型增生胃组织与早期胃癌组织比较、早期胃癌组织与正常胃组织比较,差异具有显著性意义(P<0.01)。
2.3 HGF的表达情况
正常胃组织主要呈阴性表达,不典型增生胃组织呈阳性表达,且有2例强阳性表达;早期胃癌组织主要呈弱阳性至强阳性表达,仅有2例不表达。不典型增生胃组织和早期胃癌组织匀称弥漫性分布于细胞的胞浆内,在高倍镜下呈棕黄色颗粒。由表1可见,正常胃组织→不典型增生胃组织→早期胃癌组织,HGF的表达呈上调趋势。正常胃组织与不典型增生组织比较、不典型增生胃组织与早期胃癌组织比较、早期胃癌组织与正常胃组织比较,差异都具有显著性意义。
2.4 COX-2、P16和HGF三者之间蛋白表达的相关性
通过相关性统计分析,在早期胃癌组织中, HGF与COX-2的表达呈正相关(r=0.628,P<0.01),HGF 与P16的表达呈负相关(r=-0.490,P<0.01)。
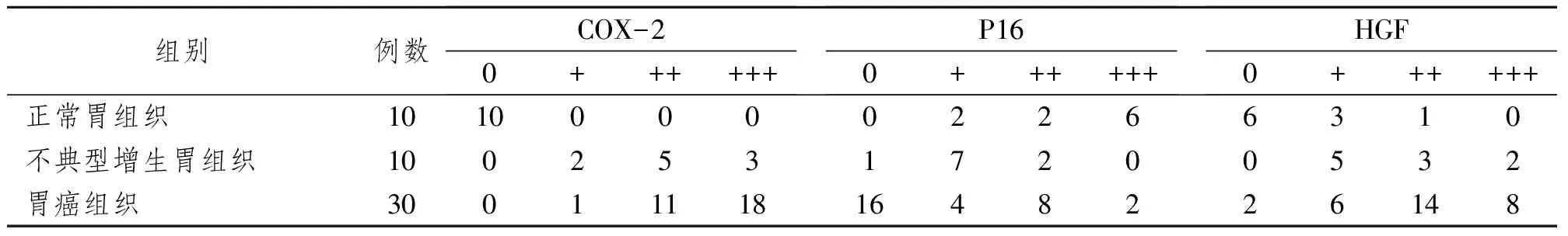
表1 COX-2、P16、HGF在早期胃癌组织、不典型增生胃组织和正常胃组织中的表达差异性的比较
COX-2:不典型增生胃组织比胃癌组织,P<0.01;胃癌组织比正常胃组织,P<0.01;P16:不典型增生胃组织比胃癌组织,P<0.01;胃癌组织比正常胃组织,P<0.01;HGF:正常胃组织比不典型增生组织,P<0.05;不典型增生胃组织比胃癌组织,P<0.01;胃癌组织比正常胃组织,P<0.01
3 讨 论
环氧合酶(cyclooxygenase,COX)是花生四烯酸合成前列腺素(prostaglangins,PG)过程中的一个限速酶,目前已知 COX 至少有两种同种异构体,结构型 COX-1 和诱导型 COX-2。COX-2在多种肿瘤尤其是消化系统肿瘤组织及其相应的肿瘤细胞株中表达上调[1]。本研究结果,COX-2在正常胃组织至早期胃癌组织的表达呈上调趋势,该结果和Sun等[2]的报道相一致,提示COX-2基因的激活可能是胃癌发生发展的重要因素,而正常胃组织与不典型增生胃组织相比,COX-2表达差异无显著性意义,结果与张合喜等[3]的报道一致,但确切原因尚未知。
P16 基因位于人类第 9 号染色体短臂 2 区 1 带(9p21)。人类 75%的癌细胞株有 p16 基因的缺失或突变。有研究报道在 p16 蛋白缺乏时肿瘤细胞的持续增殖能力可明显提高[4],证明了 P16 蛋白是一种抑癌蛋白。本研究结果显示,P16在正常胃组织至早期胃癌组织的表达呈下调趋势,P16基因的失活可能是胃癌发生发展的重要因素。其失活机制可能为:①基因缺失或突变:包括纯合缺失、杂合缺失、基因内碱基缺失、点突变。②甲基化:p16基因突变和缺失具有肿瘤类型的倾向性,但在某些肿瘤中其突变和缺失较少见[5]。
HGF是一异二聚体,HGF蛋白分子由A链和B链通过二硫键相连接,由728个氨基酸组成,HGF现在已被认为是一种具有多种功能的细胞因子[6],原癌基因c-Met编码产物是HGF的受体,因此HGF的受体也称为c-Met受体[7]。本研究发现,HGF在正常胃组织至胃癌组织的表达呈上调趋势。结果与Kermorgant S[8]报道一致,提示HGF蛋白表达与胃癌的发生发展有关。其可能的机制如下:HGF生物学活性是由原癌基因c-Met编码的跨膜受体蛋白所介导[7],构成HGF-c-Met通路。HGF-c-Met通路的激活对促进肿瘤细胞的增殖、分化,在其生长、侵袭过程中发挥重要作用。
本研究发现,在早期胃癌组织中,HGF蛋白表达随COX-2蛋白表达的增高而上调,具有明显的正相关性。说明HGF可能通过COX-2的相关调节途径对胃癌的发生发展起一定作用。其可能的机制是:①肿瘤细胞产生大量的前列腺素E2,作用于基质成纤维细胞,使成纤维细胞生成大量的HGF,而COX-2 是前列腺素合成的限速酶[9];②HGF能显著的诱导COX-2蛋白的表达和前列腺素的释放[10]。 ③HGF-c-Met信号通路可能通过细胞外信号调节激酶的激活作用所介导,上调COX-2及增加胃癌中前列腺素E-2(PGE-2)的生成[11]。
本研究结果显示,在不典型增生胃组织到早期胃癌组织中,HGF的表达呈上调趋势而P16呈下调趋势。此途径可能与P16对细胞周期的调控有关。真核细胞分裂必须通过 G1期→S期的转换开始进行 DNA合成,通过G2期→M期转换进入有丝分裂期,在这些转换过程中,CDK起着重要作用,CDK通过调节底物Rb蛋白的磷酸化而促使G1→S和G2→M期的转换,导致细胞增殖。P16蛋白与cyclinD 竞争结合 CDK4,能够特异性抑制 CDK4 的活性从而阻止细胞从G1期进入S期,抑制细胞增殖;相反cyclinD与CDK4结合时,刺激细胞生长、分裂,当p16基因由于缺失或突变不能表达时,cyclinD与CDK4的结合占优势,过度刺激细胞分裂,使细胞呈失控性生长而形成肿瘤[12]。
本研究结果提示,COX-2、P16和HGF与胃癌的发生发展有关。HGF可能通过调节COX-2和P16的相关途径在胃癌的发生发展起到一定的作用。但COX-2、P16和HGF是否通过同一条信号途径在胃癌的发生发展中起作用的机制尚不十分清楚,有待于进一步研究。
[1] 肖炜华,施瑞华,丁岩,等.胃癌组EGFR和COX-2表达的意义及其相关性[J].世界华人消化杂志,2007,15(2):123-128.
[2] Sun WH,Yu Q,Shen H,et al.Roles of Helicobactor pylori infection and cyclooxygenase-2 expression in gastric carcinogenesis[J].World J Gastroenterol,2004,10:2809-2813.
[3] 张合喜,王友洁,赵卫星.COX-2蛋白在胃黏膜癌前病变与胃癌中表达的意义[J].新乡医学院学报,2005,22(1):13-15.
[4] Lukas J,Aagaard L,Strauss M,et al.Oncogenic aberrationsof p16 ink4/CDKN2 and cyclinD1 cooperate to deregulateG1 control [J].Cancer Res,1996,55(1):1355-1357.
[5] Kamb A,Liu QY,Harshman K,et al.Rates of p16(MTS1) mutations in primary tumors with 9Ploss [J].Science,1994,26(5):415-417.
[6] Boros P,Miller CM.Hepatocyte growth factor:a multifunctional cyto-kine [J].Lancet,1995,345(8945):293-295.
[7] Bottaro DP,Rubin JS,Faletto DL,et al.Identification of hepatocyte growth factor receptor as the c-met proto-oncogene product [J].Science,1991,251(4995):802-804.
[8] Kermorgant S,Cadiot G,Lewin MJ,et al.Expression of hepatocyte growth factor and its receptor,c-Met in human digestive tissues and different gastric and colonic cancer cell lines [J].Gastroenterol Clin Biol,1996,20(5):438-445.
[9] 尹家俊,王晓波,宗成国,等.前列腺素E2对肝细胞生长因子生成的促进作用研究[J].中国实验诊断学,2005,8 9(4):541-543.
[10] Zhang A,Wang MH,Dong Z,et al.Prostaglandin E2 is a potent inhibitor of epithelial-to-mesenchymal transition:interaction with hepatocyte growth factor[J].Am J Physiol Renal Physiol,2006,291(6):F1323-F1331.
[11] Chen JH,Liu TY,Wu CW,et al.Nonsteroidal anti-inflammatory drugs for treatment of advanced gastric cancer:cyclooxygenase-2 is involved in hepatocyte growth factor mediated tumor development and progression[J].Med Hypotheses,2001,57(4):503-505.
[12] Lukas J,Aagaard L,Strauss M,et al.Oncogenic aberrationsof p16 ink4/CDKN2 and cyclinD1 cooperate to deregulateG1 control [J].Cancer Res,1996,55(1):1355-1357.
