芦丁对罗丹明6G的荧光猝灭机理研究及其含量测定
2011-01-22刘晓慧吕庆銮王怀友
刘晓慧 吕庆銮 王怀友
(山东师范大学实验室管理处,济南 250014) (鲁南煤化工研究院,济宁 272000) (山东师范大学化学化工与材料科学学院,济南 250014)
芦丁(又名维生素P)是一种分布广泛的黄酮类化合物,存在于槐米、芸香叶、烟叶、枣、杏、橙皮、番茄等物质中。芦丁具有降低毛细管的通透性和脆性,改善微循环的作用,还可作为抗氧剂和天然食用黄色素[1],在临床上主要用于糖尿病、高血压的辅助治疗[2]。芦丁除了在食品工业中可作保健品外,在化妆品行业,芦丁是目前较为理想的一种天然广谱防晒剂[3]。
芦丁的测定方法主要有电化学发光法[4]、荧光光度法[5]、分光光度法[6]、高效液相色谱法[7],毛细管电泳法[8]等。芦丁本身荧光很弱,因此分析工作者采用敏化芦丁荧光的方法对其测定。目前,荧光探针猝灭法测定芦丁还未见报道。罗丹明6G(Rhodamine 6G,Rh6G)是一种水溶性阳离子荧光染料,在水中可发强绿色荧光,光稳定性好,对pH不敏感,Stokes位移大,荧光量子产率高等,因而被广泛用于荧光标记或定量分析[9]。笔者研究发现芦丁对罗丹明6G的荧光具有显著猝灭作用,并确定了荧光猝灭类型,据此建立了测定芦丁的新方法。该方法简便、快速、灵敏度高,用于片剂中芦丁含量的测定,结果满意。
1 实验部分
1.1 主要仪器与试剂
荧光分光光度计:LS-50型,美国Perkin-Elmer公司;
紫外可见分光光度计:UV-265型,日本岛津公司;
酸度计:pHS-3C型,上海雷磁仪器厂;
超纯水系统:Direct-Q3型,美国Millipore公司;
罗丹明6G储备液:1.0 mg/mL,上海国药化学试剂有限公司,临用前用水稀释100倍;
芦丁标准溶液:1.0 mg/mL,准确称取100.0 mg芦丁(BR,北京化学试剂公司),溶于适量无水乙醇中,移入100 mL容量瓶中,用无水乙醇稀释至刻度,混匀;
芦丁片:购于药店;
Na2HPO4-KH2PO4缓冲液:pH 5.29,将Na2HPO4(1/15 mol/L)和KH2PO4(1/15 mol/L)以体积比5∶95混合均匀;
除特别注明,实验所用其它试剂均为分析纯;
实验用水为超纯水,电阻率不小于18.2 MΩ·cm。
1.2 实验方法
(1)步骤Ⅰ
取不同浓度的芦丁溶液于10 mL比色管中,依次加入pH 5.29的Na2HPO4-KH2PO4缓冲液1.0 mL,10 mg/L罗丹明6G溶液0.1 mL,用水稀释至刻度,摇匀,放置30 min后于荧光分光光度计上,以λex338 nm、λem540 nm进行扫描,记录荧光发射光谱。激发和发射狭缝皆为15 nm,扫描速度为500 nm/min。
(2)步骤Ⅱ
于10 mL比色管中,依次加入pH 5.29的Na2HPO4-KH2PO4缓冲液1.0 mL,10 mg/L罗丹明6G溶液0.1 mL,用水稀释至刻度,摇匀,记作溶液A;加入不同浓度的芦丁溶液于另一10 mL比色管中,再按照上述试剂量依次加入,定容摇匀,记作溶液B;另一10 mL比色管中,以1.0 mL 1.0 mg/mL的芦丁溶液代替溶液A中的罗丹明6G溶液,定容摇匀,记作溶液C。以水为参比,在紫外可见分光光度计上绘制其吸收光谱,狭缝宽度为2 nm。
1.3 样品溶液的制备
取本品5片,研细,准确称取细粉50 mg,加无水乙醇使之溶解, 转移至50 mL 容量瓶中,定容,过滤,作为待测液。
2 结果与讨论
2.1 荧光光谱
按照分析步骤Ⅰ,分别绘制在芦丁(浓度为10 μg/mL)存在和不存在下罗丹明6G的荧光光谱,结果见图1。
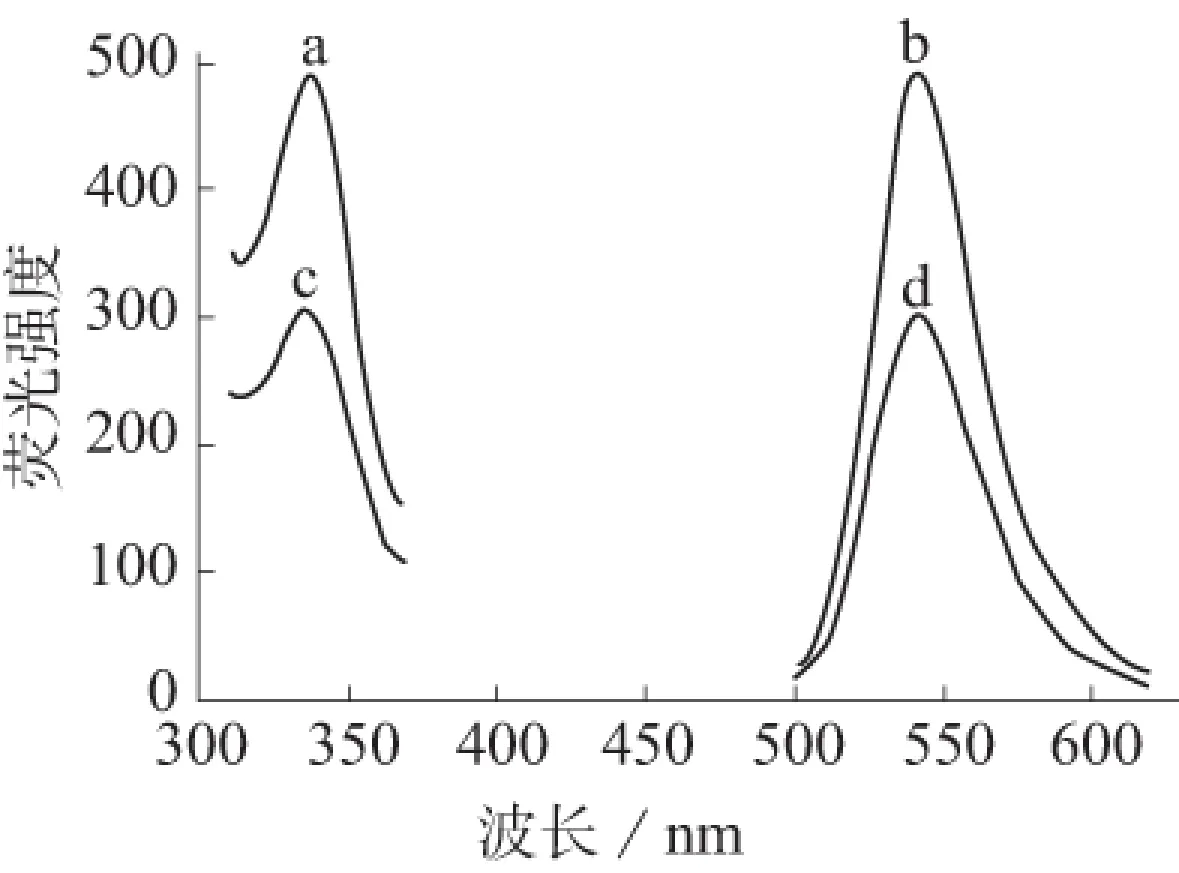
a、b—分别为罗丹明6G的激发和发射光谱;c、d—分别为加入芦丁后罗丹明6G的激发和发射光谱图1 罗丹明6G的激发和发射光谱
2.2 荧光猝灭机理探讨
实验表明,芦丁对罗丹明6G的荧光有猝灭作用。猝灭机理分为静态猝灭、动态猝灭和静态动态混合猝灭[10];静态和动态猝灭Stern-Volmer曲线的特征都是直线,混合猝灭Stern-Volmer曲线的特征是向上弯曲的非线性关系[11]。为了确定荧光猝灭机理的类型,进行了荧光猝灭实验。按照实验步骤Ⅰ,测定F0及F的值(F、F0分别为猝灭剂存在和不存在下罗丹明6G的相对荧光强度),得到Stern-Volmer图,如图2所示。由图2可知,Stern-Volmer图为线性,所以芦丁对罗丹明6G的荧光猝灭机理不是静态动态混合猝灭。

图2 F0/F与猝灭剂浓度的关系
区分动态和静态猝灭的方法可以用荧光物质在猝灭剂不存在和存在时吸收光谱的变化。通常发生静态猝灭形成了非荧光化合物,会引起荧光物质吸收光谱的变化[10]。按照步骤Ⅱ,扫描罗丹明6G在芦丁存在和不存在下的吸收光谱,结果见图3。由图3可见,加入芦丁后,罗丹明6G的吸收光谱发生红移,并随着芦丁浓度的增大,红移越显著,表明芦丁与罗丹明6G发生了作用,形成了复合物。故二者之间的猝灭类型为静态猝灭。

1~6—芦丁浓度分别为0、20、40、60、80、100 μg/mL; 7—芦丁图3 罗丹明6G加入不同浓度的芦丁后的吸收光谱
对于静态猝灭反应,如果假定在分子中有相似的且不相关的结合点,那么荧光强度和猝灭介质之间可推断出式(1)[10]:
nQ+B→Qn+B
(1)
B是有荧光的染料分子,Q是具有猝灭作用的分子,Qn+B是猝灭的分子,其形成常数K可用式(2)表示:
(2)
如果染料分子的总浓度(包括游离的和与猝灭分子反应的)是[B]0,则[B]0= [Qn+B]+[B],[B]是未反应的染料分子的浓度,那么荧光强度与未反应的分子的浓度之间的关系是[B]/[B]0=F/F0,则有:
lg[(F0-F)/F]=lgK+nlg[Q]
(3)
K是芦丁与罗丹明6G的结合常数,可通过lg[(F0-F)/F]对lg[Q]作图(见图4)。从公式(3)可得,斜率为n,截距为lgK,由此可得芦丁与罗丹明6G的结合常数K=5.55×105L/mol,结合点数n=1.26,相关系数r=0.998 7。
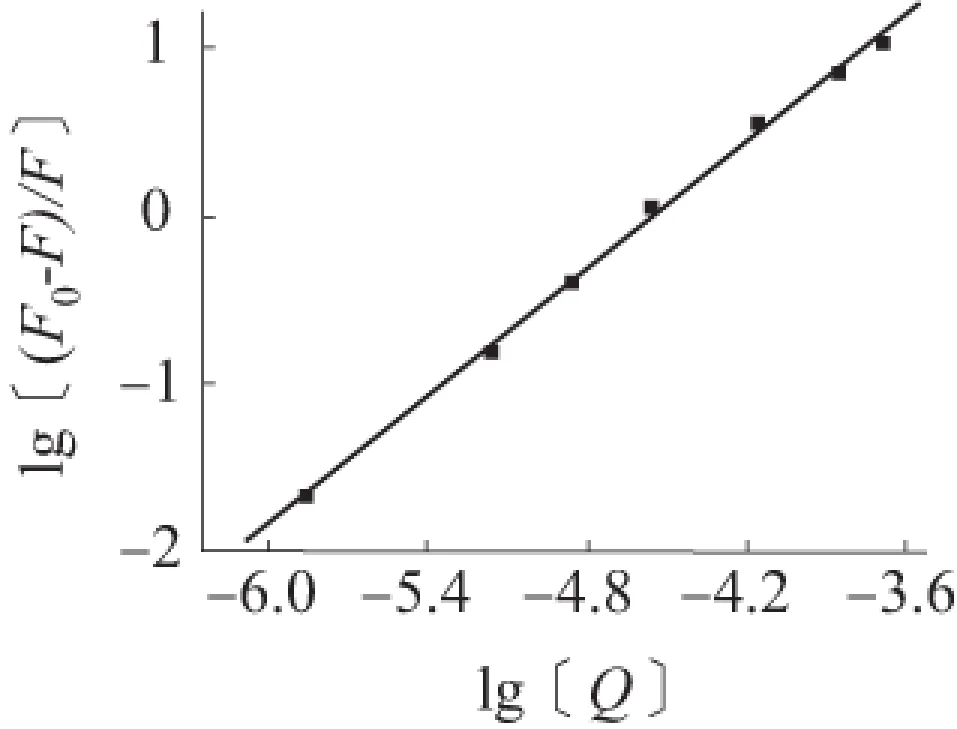
图4 lg[(F0-F)/F]与lg[Q]的关系
2.3 实验条件优化
(1)酸度
芦丁在碱性条件下会变成金黄色,实验中发现,当pH>6.5时就变色,所以实验了pH在2.0~6.5间的影响。当pH在5.0~5.5间时荧光猝灭最大,因此选择pH 5.29的Na2HPO4-KH2PO4缓冲液控制体系酸度,并且发现1.0 mL为最佳用量。
(2)试剂加入顺序
实验了3种反应物的6种加入顺序,结果表明最佳加入顺序为芦丁、缓冲液、罗丹明6G。
(3)放置时间
按照分析步骤Ⅰ,每5 min 测定体系相对荧光强度。实验发现,在30 min内体系相对荧光强度略有下降,随后不再变化,且于室温下至少稳定3 h。故选择最佳放置时间为30 min。
2.4 共存物质的干扰试验

2.5 工作曲线
在所选实验条件下,芦丁的浓度在0.92~137.8 μg/mL范围内与F0/F呈良好的线性关系,线性回归方程为F0/F=0.802+0.0797c,相关系数为0.999 6。F0和F分别为芦丁不存在和存在下的罗丹明6G的荧光强度。
2.6 精密度和检出限
按照分析步骤,将同一样品测定11次,测得待测液中芦丁的平均含量为434.4 μg/mL,相对标准偏差为0.45%。检出限为0.90 μg/mL。
2.7 样品测定
取一定量芦丁溶液,按实验方法进行测定,其结果与UV法[8]一致,测定结果见表1。置信度为95%时,用Cochran检验[12],两种方法间不存在显著性差异。

表1 本法与UV法测定结果的比对(n=3)
2.8 回收试验
用标准加入法进行了回收试验,结果见表2。由表2可知,芦丁的回收率为92.4%~96.3%,说明该方法准确可靠,因此该方法可用于芦丁片的测定。

表2 芦丁片回收试验结果(n=3)
3 结语
以罗丹明6G为荧光探针测定了芦丁含量,结果表明方法具有较高的灵敏度,对芦丁的检出限为0.90 μg/mL;测定结果与UV法测定结果相符合,该法可用于芦丁片剂含量的测定。
[1] Frericks C T, Tillotson I G, Hayman J M. The effect of rutin on capillary fragility and permeability[J]. J Lab Clin Med,1950,35(6):933-939.
[2] Stanley Mainzen Prince P, Kamalakkannan N. Rutin improves glucose homeostasis in streptozotocin diabetic tissues by altering glycolytic and gluconeogenic enzymes [J]. J Biochem Mol Toxic, 2006, 20 (2):96-102.
[3] Choquenet B, Couteau C, Paparis E, et al. Quercetin and Rutin as Potential Sunscreen Agents: Determination of Efficacy by an in Vitro Method[J]. J Nat Prod, 2008, 71(6):1 117-1 118.
[4] Xu D, Gao Z L, Li N, et al. Tris (2,2’-bipyridyl) ruthenium (Ⅱ) electrochemiluminescence (ECL) enhanced by rutin on platinum electrode[J]. Chinese Chem Lett, 2007,18(5):561-564.
[5] Yang J, Zou H, Jie N, et al. Study on the fluorescence system Be-rutin-SDS-Triton X-100 and the determination of rutin[J].J Anal Chem, 1994, 348 (5-6): 377-379.
[6] Liu D J, Zhang A M, Tian L Q.Catalytic kinetic spectrophotometric determination of rutin by potassium periodate-butyl rhodamine B system[J]. Chinese J Anal Chem, 2003, 31 (10):1 224-1 227.
[8] Wang Q, Ding F, Li H, et al. Determination of hydrochlorothiazide and rutin in Chinese herb medicines and human urine by CZE-AD[J]. J Pharm Biomed Anal,2003,30(5):1 507-1 514.
[9] Stracke F, Heupel M ,Thiel E. Singlet molecular oxygen photosensitized by Rhodamine dyes: correlation with photophysical properties of the sensitizers[J].J Photoch Photobio A,1999,126(1-3):51-58.
[10] Xu J G, Wang Z B. Method of fluorescence analysis[M].3rd ed.Beijing:Science Press,2006:64-70.
[11] Lakowicz J R. Principles of fluorescence spectroscopy[M].2nd ed. Newyork:Plenum Press,1999:243.
[12] Zheng Y X. The method of mathematical statistics in analytical chemistry[M].Beijing:Science Press,1986:122,231,308.
