硫普罗宁与牛血清白蛋白相互作用的研究*
2011-01-22周能周振
周能 周振
(玉林师范学院化学与生物系,天然产物研究所,玉林 537000)
硫普罗宁(Tiopronin)用于脂肪肝、早期肝硬化、急性、慢性、病毒性、酒精性及药物性肝炎及重金属中毒的治疗。血清白蛋白是血浆中含量最丰富的载体蛋白,具有贮运内源代谢产物和外源药物小分子等重要生理功能[1]。探讨有机小分子与蛋白质等生物大分子的相互作用模式与特征一直是目前生物化学和医学界共同关注和感兴趣的课题。笔者应用荧光光谱法研究了在生理条件下(pH 7.4)不同温度时,硫普罗宁与牛血清白蛋白(BSA)的相互作用,结果表明,硫普罗宁对BSA内源荧光的猝灭机制属于动态猝灭与静态猝灭相结合,计算了硫普罗宁与牛血清白蛋白之间的结合常数K,并根据热力学参数确定了硫普罗宁与牛血清白蛋白之间的主要作用力类型为疏水作用力。同步荧光结果表明,硫普罗宁对BSA的构象没有影响。此外,讨论了共存金属离子和甘草次酸对硫普罗宁与BSA结合作用的影响,为探讨硫普罗宁在生物体内与蛋白质的作用机理和生物学效应提供了理论依据。
1 实验部分
1.1 主要仪器与试剂
荧光分光光度计:F-2500型,日本Hitachi公司;
双光束红外分光光度计:WGH-30/6型,天津市港东科技发展有限公司;
石英比色皿:1 cm;
微量注射器:上海高鸽工贸有限公司;
旋涡混合器:XH-C型,金坛市医疗仪器厂;
精密天平:CP324S型, 德国赛多利斯股份公司;
数字酸度计:pHS-3D型,上海雷磁仪器厂;
牛血清白蛋白(BSA):电泳纯,以水配成2×10-5mol/L的溶液,于4℃保存备用;
硫普罗宁:生化试剂,纯度为99%,河南省新谊药业股份有限公司,以水配成8×10-3mol/L的溶液;
三羟甲基氨基甲烷(Tris)固体:AR,加浓盐酸配制成pH 7.40的Tris-HCl缓冲溶液;
甘草次酸:生化试剂,纯度不小于97%,以90%甲醇配成8.0×10-4mol/L的溶液;
实验用其它试剂均为分析纯;
实验用水为双重蒸馏水。
1.2 实验方法
(1)硫普罗宁与BSA作用
在10 mL容量瓶中依次加入2 mL 0.50 mol/L NaCl溶液(用于维持离子强度)、2 mL pH 7.40的Tris-HCl缓冲溶液、2 mL BSA溶液,以水定容为10 mL,摇匀,在一定温度下静置30 min。取该溶液1 mL于石英比色皿中,以微量注射器依次加入一定体积的硫普罗宁等药物,旋涡混匀,测定不同温度下硫普罗宁对BSA的荧光猝灭光谱强度,同时测定同步荧光。设定荧光激发与发射的狭缝为2.5/2.5 nm,光电倍增(PMT)设为700 V,在280 nm的激发波长下,扫描290~420 nm荧光光谱,结果为3次平行实验的平均值。
(2)甘草次酸、金属离子对硫普罗宁与BSA作用的影响
取BSA溶液1 mL于石英比色皿中,以微量注射器分别加入定量Mg2+、Co2+、Mn2+、Cu2+、Zn2+和甘草次酸(GA)溶液(加入体积小于3 μL),再以微量注射器依次加入一定体积(0、2.5、5、10、15、20、25、30 μL)的硫普罗宁等药物,旋涡混匀,测定硫普罗宁对BSA的荧光猝灭光谱强度。
2 结果与讨论
2.1 硫普罗宁对BSA的荧光猝灭作用
牛血清白蛋白中含有色氨酸、酪氨酸和苯丙氨酸残基[2],其相对强度之比为100∶9∶0.51[3],所以蛋白具有内源荧光,其荧光主要来自色氨酸残基,该残基位于BSA的疏水腔内。当激发波长为280 nm时,通常认为蛋白质的色氨酸和酪氨酸产生荧光。
在浓度固定的BSA溶液中,依次加入不同体积(0、2.5、5、10、15、20、25、30 μL)的硫普罗宁溶液,按实验方法测得硫普罗宁对BSA的荧光猝灭光谱见图1。在此过程中,最大发射峰位于340 nm且保持不变。在激发波长为280 nm时,BSA的最大荧光发射波长为340 nm。在BSA溶液中,随着硫普罗宁浓度的增加,BSA荧光发射峰强度有规律地降低,说明体系对BSA的内源荧光有猝灭作用。
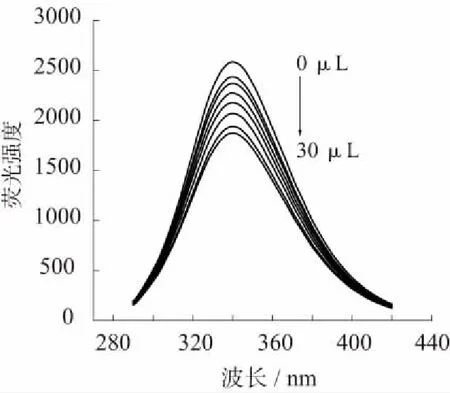
图1 硫普罗宁对BSA的荧光猝灭作用
2.2 荧光猝灭作用的Stern-Volmer分析
含色氨酸残基的蛋白质的内源性荧光及其变化直接反映了蛋白质中色氨酸残基本身和周围的亲水性和疏水性的变化。在有其它物质存在时,荧光给体的荧光强度降低的现象称作荧光猝灭,如药物存在情况下也会发生荧光猝灭。假设硫普罗宁对BSA荧光的猝灭是由于猝灭剂分子与BSA分子相互碰撞而引起的动态猝灭,式(1)为Stern-Volmer[4]方程:
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
(1)
采集295K和299K温度下硫普罗宁对BSA荧光猝灭光谱中340 nm处各曲线的荧光强度数据,并求出(F0-F)/F(F0和F分别为不加入和加入硫普罗宁时BSA的荧光强度),经过线性拟合得图2。由方程斜率求得猝灭速率常数为:T=295K,Ksv=4.79×102L/mol,Kq=4.79×1010L/(mol·s);T=299K,Ksv=1.47×103L/mol,Kq=1.47×1011L/(mol·s)。结果显示硫普罗宁对BSA的猝灭速率常数大于各类猝灭剂对生物大分子最大扩散碰撞猝灭速率常数2.0×1010L/(mol·s)[5],但与该值相差不大,考虑到猝灭常数随温度升高而升高,推断硫普罗宁对BSA的猝灭是动态猝灭与静态猝灭[6]相结合的结果。

图2 硫普罗宁对BSA荧光猝灭的Stern-Volmer分析
2.3 硫普罗宁与BSA的结合常数和结合位点数
药物与血清蛋白存在的非共价作用,一般采用位点结合模型解释。设硫普罗宁与BSA形成n个结合位点的复合物,且这种复合物无荧光,则可推导得求算结合常数和结合位点数n见式(2):
(2)
在此,K表示某类结合位点的结合常数;n表示一个BSA中某类结合位点能够结合的小分子数目,即结合位点数;[Q]表示游离小分子浓度,在研究中通常以其总浓度代替。
2.4 硫普罗宁与BSA的结合力
药物小分子与生物大分子的作用力包括氢键、范德华力、静电引力、疏水作用力等,不同药物与牛血清白蛋白作用力类型不同。当温度变化不大时,反应的焓变可以视作常数。根据Van′t Hoff热力学方程[7][见(3)式和(4)式]可以计算出药物小分子与生物大分子作用间的有关热力学常数:
ΔG=-RTlnK=ΔH-TΔS
(3)
ln(K2/K1)=(1/T1-1/T2)ΔH/R
(4)
ΔH、ΔG、ΔS分别表示焓、自由能和熵的变化。K为表观结合常数,R为摩尔气体常数。根据295K和299K两个温度下的结合常数可以计算出硫普罗宁与BSA相互作用的热力学函数值,结果列于表1。

表1 硫普罗宁与BSA相互作用的相关热力学参数
Ross等根据大量的实验结果总结出判断生物大分子与小分子结合性质的热力学规律[2],即ΔH>0,ΔS>0主要表现为疏水作用力;ΔH<0,ΔS<0主要表现为氢键和范德华力;ΔH<0,ΔS>0主要表现为静电作用力。据此可以判断,硫普罗宁与BSA的结合是一个自发过程(ΔG<0),而它与BSA结合的ΔH>0,ΔS>0,说明该体系中硫普罗宁与BSA之间的主要作用力是疏水作用;反应的ΔH>0,表明反应为吸热反应。
2.5 同步荧光研究硫普罗宁对BSA构象的影响
同步荧光光谱可用来判断发射团周围环境的极性是否发生变化。激发和发射波长差是一个重要的参数。同步荧光光谱法可被用于蛋白质构象的分析,主要是基于Δλ的变化来加以考察[8]。蛋白质的荧光主要来自色氨酸、酪氨酸残基,氨基酸残基的最大荧光波长与其所处环境的疏水性有关[9]。在同步荧光光谱中,根据Miller建议,激发波长和发射波长的差值(Δλ)不同,反映不同荧光团的光谱。当Δλ=15 nm时,所得同步荧光光谱只显示酪氨酸残基的特征荧光;Δλ=60 nm时,所得同步荧光光谱只显示色氨酸残基的特征荧光[10]。而色氨酸、酪氨酸残基的最大发射波长与其所处的微环境紧密相关,因此可以据此考察蛋白质构象变化情况。
固定BSA的浓度,逐渐增加硫普罗宁的浓度,绘制BSA的同步荧光光谱,分别为酪氨酸和色氨酸残基的荧光光谱。结果表明,BSA的荧光主要由色氨酸残基所贡献,且随硫普罗宁浓度的增大,色氨酸和酪氨酸残基的同步荧光光谱的最大波长分别为286 nm和280 nm,并保持不变,表明在研究的范围内,硫普罗宁的加入没有引起BSA的构象变化。而从荧光猝灭的幅度看,Δλ=15 nm和Δλ=60 nm的荧光降幅分别为21.6%和26.0%,相差不大,说明硫普罗宁与BSA的作用可能为非特异结合。
2.6 甘草次酸和金属离子对硫普罗宁与BSA结合的影响
从临床医学和药学的角度考虑,若金属离子的存在使药物在血浆中的贮留时间相应延长,药物释放得更缓慢,药效更持久。本实验考察了一些常见金属离子和治疗乙肝的药物甘利欣的体内代谢产物甘草次酸(GA)对硫普罗宁与BSA结合的影响,试验在299K下进行,结果如表2所示。结果表明,在Mg2+、Mn2+、Cu2+存在的情况下,减小了药物与蛋白质间的结合常数,Mn2+存在使得结合常数明显减小;在Co2+、Zn2+、GA存在的情况下,却增大了药物与蛋白质间的结合常数,GA存在使得结合常数明显增大。考虑到硫普罗宁与BSA结合常数很小,这些物质的共存不会对其药效产生大的影响。
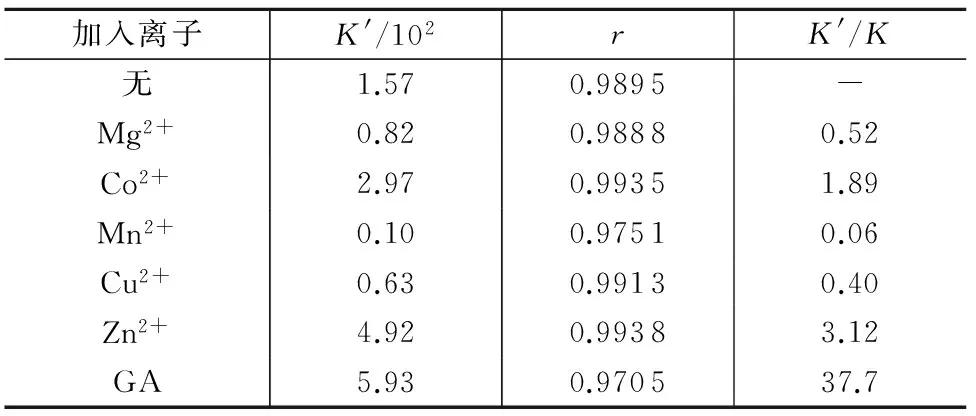
表2 金属离子和GA对硫普罗宁与BSA结合常数的影响
注:K′表示有干扰的表观结合常数值;K表示没有干扰的表观结合常数值。
3 结论
采用荧光技术研究了硫普罗宁与BSA之间结合作用,得到了反应的结合常数、结合热力学性质和结合位点等参数。根据热力学常数确定了该药物与血清白蛋白之间的作用力类型,并探究金属离子的介入对硫普罗宁与牛血清白蛋白的结合影响,结果将有助于深入了解硫普罗宁在动物体内结合、运输、排泄和毒理。
[1] 周秀清,程建华,孙磊,等.用光谱法研究异鼠李素与牛血清白蛋白的相互作用及几种金属离子对反应的影响[J].吉林大学学报(理学版),2008,46(5):983-986.
[2] 张晓星,何苗,刘爱林,等. 荧光法对姜黄素与牛血清白蛋白相互作用的研究[J].光谱实验室,2010,27(2):395-401.
[3] 陈国珍,黄贤智,许金钩,等.荧光分析法[M].第2版.北京:科学出版社,1990:65-68.
[4] 杨频,高飞.生物无机化学原理[M].北京:科学出版社,2002:164.
[5] 陈宁生,郑欣,傅应强.荧光法研究阿维菌素与血清蛋白的作用[J]. 分析化学, 2009, 37(A01):278.
[6] 安普丽,张剑,蒋晔,等.荧光猝灭法研究A1受体拮抗剂与牛血清白蛋白的相互作用[J].华西药学杂志,2008,23(1):37-40.
[7] 孟丽艳,屈凌波,杨冉,等.紫外吸收光谱和荧光光谱法研究大黄酚与牛血清白蛋白相互作用机制[J].理化检验:化学分册,2009,45(10):45-48.
[8] 费燕,陆国才,范国荣,等.西那沙星与牛血清白蛋白的相互作用及共存金属离子影响的研究[J].光谱学与光谱分析,2008,28(11):2 609-2 614.
[9] 汪双双,倪永年.光谱法研究11-羟基喜树碱与牛血清白蛋白的相互作用[J].分析试验室,2010,29(1):10-13.
[10] 张根成,许洁艳.Cr(VI)与牛血清白蛋白的相互作用[J].应用化学,2010,27(2):192-196.
