骨化性气管支气管病一例报道及文献复习
2011-01-19郭述良
敖 敏 郭述良
骨化性气管支气管病(tracheobroncheopathia osteochondroplastica)是指气管、支气管黏膜下有多发性骨质或软骨组织结节样增生并突向管腔的气道病变,是一种气管支气管的良性疾病,但随着病情进展可引起管壁变硬、管腔狭窄甚至阻塞[1-2]。骨化性气管支气管病是一种病因未明的少见病,由 Rokitansky等于 1855年首次发现。近年来,随着对该病认识程度的不断提高及支气管镜和肺部 CT的广泛应用,陆续有病例被发现及报道。近期本院诊断 1例骨化性气管支气管病,现结合文献复习进行分析讨论。
资料与方法
一、临床资料
患者,男性,31岁,因“咳嗽、咳痰 1周”就诊。患者于 1周前受凉后出现咳嗽,咳较多白色黏痰,伴流涕、盗汗、轻微夜间气促,但无发热、咯血,无声嘶、潮热,无消瘦、胸痛,无恶心、呕吐,在门诊给予抗生素输注后症状反复,遂入我院进一步诊治。患病后夜间睡眠稍差,食欲无明显减退,大小便正常。有慢性鼻炎病史,吸烟3包 1年,已戒 2年,无酗酒史,无特殊个人史及家族史。入院时查体:一般情况好,生命体征平稳,浅表淋巴结无肿大,胸廓无畸形,双肺呼吸音稍粗,未闻及干湿性啰音,心率 80次 /m in,节律整齐,未闻及杂音,腹部平软,肝脾肋下未及,无杵状指(趾),双下肢无水肿。辅助检查:血常规、肝肾功能、电解质、抗核抗体谱、血清蛋白电泳、癌谱、血清免疫球蛋白、血 κ轻链、血 λ轻链、血沉、血结核抗体、血糖、D2-聚体均无异常。腹部 B超未见异常。肺功能:通气功能、残气百分比、弥散功能均正常,气道阻力增高。支气管舒张试验阴性。胸部CT示:气管支气管壁增厚,并见点条状钙化,支气管腔不规则变窄或扩大(图1)。
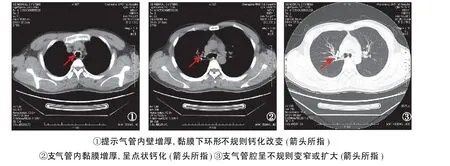
图1 胸部 CT平扫Figure 1 Thoracic CT scans
纤支镜检查示:气管及左右主支气管内弥漫分布大小不等的白色结节,质硬,突向管腔,大部分融合,呈溶洞样改变;部分叶支气管内壁也有散在分布白色结节,而段支气管及亚段支气管管腔及黏膜正常,活检时质地坚硬,不易钳夹,气管后壁(膜部)无异常(图2)。组织活检病理示慢性炎症伴鳞化及灶状钙化(图3),结合病人的胸部影像学表现临床诊断为骨化性气管支气管病,给予抗感染及对症治疗后症状好转出院,目前随访中。

图2 电子支气管镜下所见F igure 2 Lmage of electronic bronchoscope
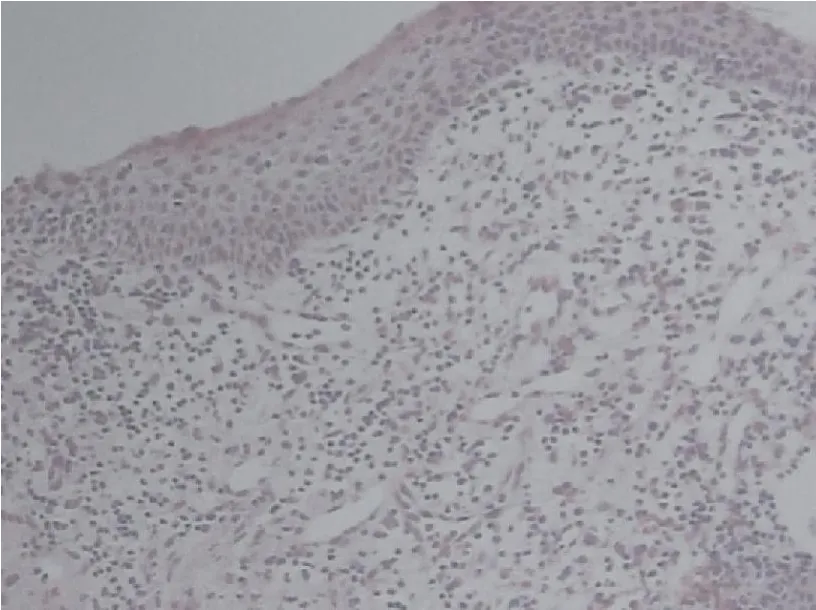
图3 病理切片(HE×100)(提示慢性炎症伴鳞化及灶状钙化)F igure 3 Pathological Section(HE×100)
二、文献复习
复习国内 2000年以后报道 32例骨化性气管支气管病的 21篇文献资料,结合本例报道共 33例,进行分析总结。
结 果
33例患者中男 20例,女 13例,比例为 3:2,提示男性患病率明显高于女性。临床症状有:咳嗽 93.9%(31/33),咳痰 57.6%(19/33),咯血 31.0%(9/33),反复肺部感染 27.6%(10/33),气促 15.1%(5/33),声嘶 9.0%(3/33)。除未作胸片的病例,其他病例胸片无 1例发现气管支气管病变。而胸部 CT检查发现:气管、支气管前、侧壁有散发或多发结节突向管腔,部分钙化,结节直径为 1~7 mm,大多为 1~3 mm。气管镜检查均可见气管及左右主支气管内前壁及侧壁上有形状、大小不一的黄白色结节突向管腔,质硬,无蒂,散在分布或融合成片,活检时感结节质地坚硬,管壁变窄或不规则,呈溶洞样改变,气管膜部均正常。病理检查显示,黏膜下骨质和软骨组织结节状增生,黏膜上皮基本完整。其中有 13例患者伴有鳞状上皮化生。
讨 论
一、流行病学
骨化性气管支气管病是一种大气道的良性病变,1855年 RoR itanky首次在尸检中发现并描述此种疾病,1857年W ilks首次对此病作了组织学描述,1896年Von Schroetter经喉镜首次诊断骨化性气管支气管病。1964年 Secrest等正式定义为骨化性气管支气管病并得到广泛认可,1983年 Onitsuka等首次报道了骨化性气管支气管病的 CT表现。关于本病的文献报道很少,迄今国内外报道本病的文献不足 500例,以国外报道为主,有 400多例,主要在北欧地区,尤其是在芬兰该病的患病率要最高,约占所有病例的 25%[3]。国内的报道病例较少,自 2000年以后才陆续有人报道,可能与该病的认识不足从而漏诊或误诊以及未报道有关[4]。该病的发病人群多在中年,许多患者确诊的年龄多在 40~70岁之间[5,6],平均年龄为 51岁。但也有青年和儿童病例的报道,性别上国外无显著差异[7-9]。但国内有男性易发的倾向,男女发病率为 3:2。
二、病因及发病机制
目前为止骨化性气管支气管病的病因及发病机制尚不清楚。可能与慢性炎症、慢性感染、变性过程、先天异常、化学物质刺激、遗传、代谢紊乱和机械刺激等有关。国外有专家认为是在黏膜下层和固有层的弹性层中未分化的结缔组织细胞经过化生,形成软骨细胞,从而导致钙质聚积和骨化作用的发生[10]。也有专家提出骨化性气管支气管病是淀粉样变的晚期阶段,依据是在局限型淀粉样变中,偶尔见到骨化中心[11-13]。体内内分泌激素水平或钙磷代谢的异常等与骨化性气管支气管病有一定的关系[14]。也有人认为油烟可能也是致病因素之一[15]。部分骨化性气管支气管病患者有长期化学物质接触史,当改变工作环境一段时间后,症状明显改善。因此慢性刺激在骨化性气管支气管病的发生、发展中可能起一定的作用。骨形成蛋白 2可能在结节的形成过程中起了重要作用,并与转化生长因子 β1协同促进了黏膜下结节的生长[16]。骨化性气管支气管病患者出现黏膜鳞状上皮化生较常见,如国内 33例患者有 14例存在黏膜鳞状上皮化生(42%),国外资料为 48%。黏膜鳞状上皮化生并出现软骨和骨的化生,提示原发性黏膜鳞状上皮化生有参与骨化性气管支气管病发病[5,17]。
三、临床表现
骨化性气管支气管病的临床症状差异很大且无特异性,许多病例在死后尸检时发现,仅有 51%的患者是在生前诊断,而约有 0.02% ~0.41%病例是在行支气管镜时偶尔发现的,更有患者是因其他疾病就诊时无意中被发现[7,8]。也有病例有明显的呼吸道症状,估计这与患者的气道狭窄的速度及程度有关[18]。国内报道的主要症状为咳嗽、咳痰、痰血、气促、声嘶和反复感染。本文统计发生率分别为 96.6%、55.2%、31.0%、10.3%、6.9%和 27.6%,而国外报道的发生率分别有 79%、67%、44%、56%、22%和 78%,可以发现最常见症状为咳嗽、咯痰,而国外肺部反复感染也有较高的发病率,但这些症状无明显特异性,常无法引起患者及临床医师的重视而致漏诊或误诊。此外,骨化性气管支气管病患者可合并其他疾病,Jabbardrjan等报道10例患者中就有合并肺结核 3例,合并萎缩性鼻炎 2例,合并碳末沉着症 3例[7]。国内也有报道合并肺结核导致漏诊的病例,这些合并症与骨化性气管支气管病是否存在因果关系尚不清楚。
四、影像学资料
在影像学方面常规胸片通常无异常,只能间接发现肺部感染或叶段不张。在病变严重时,可以在侧位片或断层摄片显示气管和主支气管的钙化或胸内气管不规则狭窄[7]。胸部 CT对本病的诊断有重要价值,尤其是薄层螺旋CT对骨化性气管支气管病具有诊断价值。薄层螺旋 CT可以早期发现气管及支气管壁的增厚,典型病例表现为气管及支气管前、侧壁散发或多发直径 1~3 mm小结节突向管腔,伴或不伴钙化。随着病情进展气管壁弥漫增厚,结节融合并导致管腔狭窄,气管内径减小,管腔缩小[19]。病变主要发生在气管中、下段的前、侧壁,后壁一般不累及。如果受累及,则要考虑其他疾病的可能,如淀粉样变、复发性多发软骨炎,支气管肉瘤病、乳头状瘤病[20]。
五、肺功能
骨化性气管支气管病患者肺功能表现无特异性,部分可能正常,部分表现为阻塞性通气障碍,残气、弥散功能通常正常。而在常规肺功能检查正常的病例中,发现部分病例存在气道阻力增高[4],例如本例中患者的肺功能检查基本正常,而通过强迫震荡法发现气道阻力增高,这提示气道阻力增高可能为较敏感的指标。
六、支气管镜检查
骨化性气管支气管病气管镜下具有特征性的改变,其镜下图像具有诊断价值[21]。常表现为气管及支气管的前壁和侧壁有多发大小不等、分布不均的黄白结节突向管腔,无蒂,结节直径 1~10mm,可散发或融合成片;质硬,不易钳取,很少累及声门、声门以上组织及段支气管以下的气道。较大的融合结节突向管腔,呈溶洞样改变,导致管腔可变窄或不规则,出现活动后气促表现,因此气管镜下特征性改变对骨化性气管支气管病具有诊断意义。本例中患者的声门裂下 1cm起气管的前侧壁就表现为弥漫分布的白色结节突向管腔,大部分融合,管腔不规则狭窄,结节间黏膜充血,隆突部分累及,左右主支气管及叶支气管均有累及;结节质硬,活检钳钳夹时困难,而气管膜部、声门及声门以上、段支气管及亚段支气管均正常,本例的支气管镜下改变符合典型的骨化性气管支气管病表现。
七、组织病检
骨化性气管支气管病病理检查具有进一步确诊的作用。典型病理检查可见黏膜下软骨和骨组织结节状增生,黏膜上部大量淋巴细胞、组织细胞等炎症细胞浸润,部分黏膜鳞状上皮化生及不典型增生。由于结节质地坚硬,活检时不易钳取到黏膜下软骨或骨质结节,例如本例病理检查仅为慢性炎症伴鳞状化生及钙化,可能与一般活检钳太小,钳取时没能取得满意标本有关,故国内有报道使用鳄齿钳能取得较满意标本,但易出血,同时部分病例需重复活检才能明确诊断[4]。
八、诊断及鉴别诊断
骨化性气管支气管病的诊断主要依靠典型的影像学表现、特征性的支气管镜下改变和组织病理表现。由于其是一种良性疾病,起病隐匿,病程长,临床上常因无症状或症状无特异性而被漏诊或误诊,因此只有提高临床上对骨化性气管支气管病的认识。在对慢性咳嗽、咳痰、咯血、反复发生肺部叶段感染或不张、难以解释的呼吸困难病例用其他疾病无法解释时,要及时行胸部 CT和支气管镜检查。在阅读 CT片时,应特别注意气管壁有无较广泛的增厚及结节状钙化,若有应考虑到本病可能,并进一步行支气管镜检查明确。所以,对于骨化性气管支气管病的诊断,提高认识是关键,胸部 CT是诊断的重要手段,尤其是薄层 CT能提供重要的线索。支气管镜下发现特征性改变即可初步诊断,结合组织学检查结果即可确诊。
鉴别诊断时应注意与气管支气管结核、气管-支气管淀粉样变、气管与支气管扩张症、气管软化、结石、气管乳头状瘤等鉴别。
九、治疗
在治疗方面,目前尚无特效治疗方法,主要是对有症状患者进行对症支持处理。包括抗感染、解痉等药物的使用,同时根据不同情况采用放射、冷冻、激光、微波、皮质类固醇、气道支架、手术等方法[14]有一定治疗效果。但目前对于骨化性气管支气管病的治疗缺乏标准化的治疗指南,对疗效的判定结果也不一致。这需要有更多的数据和长时间的疗效观察来进一步完善、评估每一种治疗方法[21]。
1 Cronfton J,Doug lasA.Respiratory disease[M].Philadephia:BlackW ell Scientific PublicationsL td,1969:639-641.
2 JabbardarjaniHR,Radpey B,Kharabian S,et al.T racheobronchopathia osteochondroplastica:presentation of ten cases and review of the literature[J].Lung,2008,186(5):293-297.
3 P rakash UB.T racheobronchopathia osteochondroplastica[J].Sem in ResirCritCareM ed.2002,23(2):167-175.
4 李时悦,欧阳能太,钟南山.骨化性气管支气管病[J].中华结核和呼吸杂志,2001,24(7):414-416.L ISh-i yue,OU-YANG N eng-ta,i ZHONG Nan-shan.T racheobroncheopathia osteochondroplastica[J].Chin JTubR esD is,2001,24(7):414-416.
5 Leske V,LazorR,Coe tmeur D,et al.Tracheobronchopathia osteochondroplastica:a study of 41 patients[J].M edicine(Balt imore),2001,80(6):378-390.
6 H¾r m¾ RA,Suurkari S.Tracheopathia chondro-osteoplastica:a clinical study of thirty cases[J].A cta O tolaryngo,l 1977,84(1-6):118-123.
7 JabbardarjaniHR,Radpey B,Kharabian S,et al.T racheobronchopathia osteochondroplastica:presentation of ten cases and rev iew of the literature.Lung,2008,186:293-297.
8 W il lmsH,W iech mann V,Sack U,et al.Tracheobronchopathia osteochondroplastica:a rare cause of chronic cough w ith haemoptysis. Cough,2008,4:4.
9 S imsek PO,OzcelikU,Demirkazik F,et al.T racheobronchopathia osteochondroplastica in a 9-year-old g ir.l PediatrPu lmono,l 2006,41:95-97.
10 曹孟淑,蔡后荣.骨化性气管支气管病的临床特征[J].中国呼吸与危重监护杂志,2009,8(3):307-309.MENG Shu,CA IHou-rong.C linical features of tracheobroncheopathia osteochondroplastica[J].Chin JR espirCrit Care,2009,8(3):307-309.
11 Sakula A.T racheobroncheopathia osteoplastica:its relationship to pr imary tracheobronchial amyloidosis[J].Thorax,1968,23(1):105-110.
12 JonesAW,ChatterjiAN.Pr imary tracheobronchial amy loidosisw ith tracheobroncheopathia osteoplastica[J].Br J D is Chest,1977,71(4):268-272.
13 A lroy GG,L ichtig C,Kaftori J K.T racheobroncheopathia osteoplastica:end stage of pr imary lung amy loidosis[J].Chest,1972,61(5):465-468.
14 S m id L,Larencak B,ZargiM.Laryngo tracheobronchopathia chondroosteoplastica[J].JLaryngolO to,l 1992,106(9):845-848.
15 Jepsen O,SorensenH.Tracheopathia osteoplastica and ozaena[J].A cta O to laryngo,l 1960,51(1):79-83.
16 Ta j ima K,YamakawaM,K atag iriT,etal.I mmunohistochem icaldetection ofbonemorphogenetic protein-2 and transfor ming growth beta-1 in tracheopathia osteochondroplastica[J].V irchows Arch,1997,431(5):359-363.
17 RoseY,Roucou Y,Roujeau J,et al.Metaplasic ossiflante de la muqueuse trach o-bronchique et oz ne[J].Rev FrM al Resp,1974,2(6):637-645.
18 Lundgren P,Stjenberg NL.Trachobroncheopathia osteo-chondroplastica:a clinical brinchoscopic and spirometricstudy[J].Chest,1981,80(6):706-709.
19 M anning J E,Goldin J G,ShpinerRB,et al.Case report:tracheobronchopathia osteochondroplastica[J].Clin R adio,l 1998,53(4):302-309.
20 W hite BD,Kong A,Khoo E,etal.Computed tomography diagnosis of tracheobronchopathia osteochondrop lastica.AustralasRadio,l 2005,49(4):319-321.
21 Abu-H ijiehM,Lee D,Braman SS.T racheobronchopathia osteochondroplastica:a rare large air way disorder[J].Lung,2008,186(6):353-359.
