呼吸衰竭的临床诊断与治疗
2011-01-19任成山钱桂生
任成山 钱桂生
呼吸衰竭(respiratory failure)是由于肺通气不足、弥散功能障碍和肺通气 /血流比失调等因素,使静息状态下吸入空气时出现低氧血症和/或二氧化碳潴留,从而引起一系列生理功能和代谢紊乱的临床综合征。在临床上,呼吸衰竭通常是指外呼吸衰竭。因气体在血液中运输以及血液或组织液与细胞间的气体交换异常,称为内呼吸障碍。呼吸衰竭的判断标准为:在海平面大气压下,于静息条件下呼吸室内空气,并排除心内解剖分流和原发于心排血量降低等情况后,动脉血氧分压(PaO2)低于60mm Hg(8.0 kPa),或伴有二氧化碳分压(PaCO2)高于 50mm Hg(6.67 kPa),即诊断为呼吸衰竭。呼吸衰竭是临床经常遇到的一种临床综合征,也是导致死亡的主要原因之一。严重呼吸衰竭如不及时有效救治,可发生多器官功能障碍综合征,甚至死亡。在美国,慢性阻塞性肺疾病(chronic obstructive pu lmonary disease,COPD)因呼吸衰竭的病死率逐年递增。肺炎患者因呼吸衰竭而死亡者超过 70%。美国每年有 34%的重症监护病房约 500 000人因呼吸衰竭而接受机械通气治疗。在我国如何判断呼吸衰竭的程度,有学者建议采用公式计算,根据吸氧时动脉氧分压水平推算吸氧前 PaO2水平,以判断呼吸衰竭患者的缺氧程度。具体方法为:

上述公式中 PaO2为肺泡气氧分压,PB为大气压〔通常为 760 mm Hg(101 kPa)〕,PH2O为饱和水蒸气分压〔通常为 47 mm Hg(6.27 kPa)〕,F iO2为吸入氧分数,R为呼吸商(通常为 0.8)。
(1)式中 PaO2吸氧后系实结果(已知),PaO2吸氧后可按公式(2)计算得出;(2)式中 F iO2为实际吸氧浓度,PaCO2实测。同样,按照公式 (2)可以推算出吸氧前 PaO2,这时 PB、PH2O、R均不变,F iO2为 0.21,假设吸氧前 PaCO2=吸氧后 PaCO2,最后可推算出吸氧前 PaCO2。再根据推算出来的吸氧前 PaO2判断患者原来到底是否符合呼吸衰竭标准。1998美国的《肺脏病学》则将高碳酸性呼吸衰竭定义为 PaCO2>45 mm Hg(6.0 kPa);而低氧性呼吸衰竭简单定义为吸氧浓度≥60%时,PaO2<55mm Hg(7.3 kPa)。
一、呼吸衰竭的临床分类
在临床上,根据动脉血气、病变部位、病程、病理生理和实验室检查,呼吸衰竭有以下几种分类方法。
1.按动脉血气分析分类
(1)Ⅰ型呼吸衰竭 缺氧无 CO2潴留,或伴有 CO2降低。标准为在海平面平静呼吸空气的条件下PaCO2正常或下降,PaCO2<60 mm Hg(8.0 kPa)。见于换气功能障碍(通气 /血流比失调、弥散功能损害和肺动-静脉样分流)的病例。
(2)Ⅱ型呼吸衰竭 缺O2伴有 CO2潴留。其标准为海平面平静呼吸空气的条件下 PaCO2>50 mm Hg(6.67 kPa),PaO2< 60mm Hg(8.0 kPa)。
Ⅰ型呼吸衰竭和Ⅱ型呼吸衰竭特点及临床表现比较,见表1。
2.按起病缓急病程分类
根据起病的缓急,呼吸衰竭可分为急性呼吸衰竭和慢性呼吸衰竭两类,两者之间无明确的时间界限。
(1)急性呼吸衰竭 是指呼吸功能原来正常,由于突发病因,引起通气或换气功能严重损害,一般在数分钟或数小时内发生,机体往往来不及代偿。如脑血管意外、药物中毒抑制呼吸中枢、呼吸肌麻痹、肺梗死、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)等,因机体不能很快代偿,如不及时抢救,会危及患者生命。
(2)慢性呼吸衰竭 是指一些慢性疾病,包括呼吸和神经肌肉系统疾病,导致呼吸功能损害逐渐加重,经过较长时间才发展为呼吸衰竭。多见于慢性呼吸系疾病,如 COPD、重症肺结核等。虽有缺 O2,或伴有CO2潴留,但通过机体代偿适应,仍能从事个人生活活动,称为代偿性慢性呼吸衰竭。一旦并发呼吸道感染,或因其他原因增加呼吸生理负担所致代偿失调,出现严重缺O2、CO2潴留和酸中毒的临床表现,称为失代偿慢性呼吸衰竭。

表1 Ⅰ型呼吸衰竭和Ⅱ型呼吸衰竭特点及临床表现比较Table 1 The characteristics and clinicalsituation of I,II respiratory failure
3.按病理生理分类
(1)泵衰竭 通气泵包括呼吸肌、胸廓和呼吸中枢等。泵衰竭主要因呼吸驱动力不足或呼吸运动受限制而引起,其呼吸功能障碍主要为通气量下降,常表现为缺氧和 CO2潴留(Ⅱ型呼吸衰竭)。由脑、脊髓、神经肌肉和胸廓疾患所引起的呼吸衰竭,均属于泵衰竭。近年来注意到呼吸肌疲劳在泵衰竭中起重要作用。呼吸肌疲劳系指呼吸肌的负荷增加所导致收缩力减小和 /或收缩速度降低,不能继续产生维持足够肺泡通气量所需的驱动压。发生呼吸肌疲劳的主要原因是,呼吸肌长期处于超负荷状态,其能量消耗超过能量供给,最终导致能量储备耗竭。也与神经肌肉连接部冲动传递障碍、兴奋-收缩偶联障碍、呼吸中枢驱动不足、酸中毒等因素有关。减轻呼吸肌的负荷或机械通气治疗,可使呼吸肌分别得到部分或充分休息。
(2)肺衰竭 主要因气道、肺脏、肺血管疾患引起的呼吸衰竭属肺衰竭。因上呼吸道阻塞引起的呼吸衰竭与泵衰竭相似,主要表现为通气量下降。因肺疾患本身引起的呼吸衰竭,其呼吸功能变化既有通气量下降,又有氧合功能障碍,通气/血流比值失调是后者的主要原因。因而,低氧血症是肺衰竭的共同表现,只有当通气量明显下降时才伴有CO2潴留。一般认为,COPD以外的肺疾患,如出现 CO2潴留,多提示病情危重。
4.按氧合与通气功能分类
主要是指氧合衰竭与通气功能衰竭。
根据呼吸功能的障碍是偏重于氧合功能不全,还是通气功能不全,可将呼吸衰竭分为氧合衰竭与通气衰竭。所有的泵衰竭均属于通气衰竭,上呼吸道阻塞引起的呼吸衰竭也属此类。肺疾患引起的呼吸衰竭主要表现为氧合衰竭,或与通气衰竭共存。
5.按病变部位分类
可分为中枢性和周围呼吸衰竭
(1)中枢性呼吸衰竭 由于呼吸中枢功能异常,呼吸肌功能异常引起的海平面静息状态下平静呼吸PaO2<60 mm Hg,见于脑干大面积梗死、乙型脑炎、格林巴利综合征等。
(2)周围性呼吸衰竭 由于呼吸器官的严重病变或呼吸肌麻痹而造成的通气和换气功能障碍,出现缺氧和二氧化碳潴留时,称为周围性呼吸衰竭。
二、呼吸衰竭的临床诊断
呼吸衰竭的确诊主要靠动脉血气分析。急性呼吸衰竭多有突发的病史,有时在发病现场即可作出诊断如异物吸入、溺水等。慢性呼吸衰竭则常有慢性呼吸系统疾病如 COPD。呼吸衰竭的临床表现因原发病的影响而有很大差异,但均以缺氧和/或 CO2潴留为基本表现,出现典型的症状和体征。
1.呼吸衰竭的临床表现
(1)呼吸困难 呼吸困难是呼吸衰竭的早期临床重要症状。患者主观感到空气不足,客观表现为呼吸用力,伴有呼吸频率、深度与节律的改变。辅助呼吸肌多参与呼吸运动,出现点头或提肩呼吸。有时可见鼻翼扇动、端坐呼吸。上呼吸道疾患常表现为吸气性呼吸困难,可有三凹征。呼气性呼吸困难多见于下呼吸道不完全阻塞如支气管哮喘等。胸廓疾患、重症肺炎等表现为混合性呼吸困难。呼吸肌疲劳时会出现呼吸浅快、腹式反常呼吸,如吸气时,腹壁内陷。呼吸衰竭并不一定有呼吸困难。如镇静药中毒,呼吸匀缓、表情淡漠或昏睡。
(2)紫绀 紫绀是缺氧的典型体征,因动脉血还原血红蛋白增加,至耳垂、口唇、口腔黏膜、指甲呈现青紫色的现象。缺氧并不一定有紫绀,因紫绀是由血液中还原血红蛋白的绝对值增多引起。
(3)神经精神症状 急性呼吸衰竭的神经精神症状较慢性明显。急性严重缺氧可出现谵忘、抽搐、昏迷。慢性者则可有注意力不集中、智力或定向功能障碍。CO2潴留出现头痛、扑翼样震颤、以及中枢抑制之前的兴奋症状如失眠、睡眠习惯的改变、烦燥等。
(4)循环系统症状 缺氧和 CO2潴留均可导致心率增快、血压升高。严重缺氧可出现各种类型的心律失常,甚至心脏停搏。CO2潴留可引起表浅毛细血管和静脉扩张,表现为多汗、球结膜水肿、颈静脉充盈等。长期缺氧引起肺动脉高压慢性肺心病、右心衰竭,出现相应体征。
(5)其他脏器功能障碍 严重缺氧和 CO2潴留可导致肝功能和肾功能障碍。临床出现黄疸、肝功能异常;血尿素氮、肌酐增高,尿中出现蛋白、管型;也可能出现上消化道出血等。
(6)酸碱失衡和血清电解质紊乱 因缺氧通气过度可发生呼吸性碱中毒。CO2潴留则表现为呼吸性酸中毒。严重缺氧多伴有代谢性酸中毒和血清电解质紊乱。
2.动脉血气分析
动脉血气分析是反映外呼吸功能的一项重要指标,也是诊断呼吸衰竭的主要手段。由于静脉血液的气体成分随各组织、器官的代谢率、血流灌注量不同而各异,通常采用动脉血气分析。血气分析仪仅能直接测定 pH、PaO2、PaCO2,其他指标均通过计算获得。如计算氧合指数。是以吸入氧浓度为尺度来衡量换气功能,是较为稳定的换气功能指标。这一指标的命名较为混乱,有称氧合指数,也有称呼吸指数,还有称最初通气 /灌注指数。PaO2/F iO2正常参考值为 400~500 mm H g(53.3~66.3 kPa)。目前比较公认的是 PaO2/F iO2<300 mm H g,排除左心衰后即可诊断为急性肺损伤;PaO2/F iO2<200 mm H g,结合临床其他条件即可诊断为 ARDS。
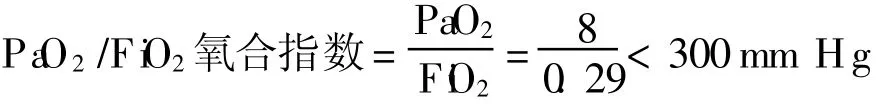
3.ARDS ARDS是属急性呼吸衰竭,其早期为急性肺损伤(acute lung injury,ALI),但因其发病机制,病理及临床表现具有特殊性,其ARDS的诊断标准如下:
(1)ALI/ARDS的高危因素 ①直接肺损伤因素:严重肺感染、胃内容物吸入、肺挫伤、吸入有毒气体、淹溺、氧中毒等;②间接肺损伤因素:脓毒症(sepsis)、严重的非胸部创伤、重型胰腺炎、大量输血、体外循环、DIC等。
(2)ALI/ARDS的诊断标准 ①有发病的高危因素;②急性起病,呼吸频数和/或呼吸窘迫;③低氧血症:ALI时 PaO2/F iO2≤300mm Hg,ARDS时 PaO2≤200 mm Hg;④胸部X线片检查两肺浸润阴影;⑤肺毛细血管楔压(PCWP)≤18mm H g或临床上能排除外心源性肺水肿。凡符合以上五项可诊断ALI或ARDS。
4.氧合指标的监测
(1)氧分压 (PO2)监测
PO2是指血浆中物理溶解的氧分子所产生的压力。动脉血氧分压(PaO2)正常值 80~100mm Hg(10.67~ 13.33 kPa),其正常值随着年龄增加而下降,预计 PaO2值(mm H g)=102-0.33×年龄 (岁)±10.0。静脉血氧分压(P vO2)正常值 40mm Hg(5.33 kPa),静脉血氧分压不仅受呼吸功能影响而且可受循环功能影响。呼吸功能正常的患者,当休克微循环障碍时,由于血液在毛细血管停留时间延长、组织利用氧增加,可出现PaO2正常,而静脉血氧分压明显降低。因此在判断呼吸功能时,一定要用动脉血氧分压,决不能用静脉血氧分压替代。联合应用 PaO2和 PaCO2可判断呼吸衰竭,即Ⅰ型呼吸衰竭时 PaO2<60 mm Hg(8.0 kPa),而PaCO2正常或下降;Ⅱ型呼吸衰竭时 PaO2< 60mm Hg(8.0 kPa),PaCO2> 50mm Hg(6.67 kPa)。
(2)血氧饱和度(SO2)
SO2是指血红蛋白实际上所结合的氧含量被全部血红蛋白能够结合的氧除得的百分率。SO2的计算公式为:

动脉血氧饱和度以 SaO2表示,正常范围为 95% ~99%,动脉 SO2与 PaO2间的关系即是氧离解曲线。动脉血氧饱和度可直接测定所得,但目前血气分析仪所提供的动脉血氧饱和度是依动脉血氧分压和 pH推算所得。依动脉血氧分压、血红蛋白和动脉血氧饱和度尚可以推算出全血氧含量(C-O2)。所谓全氧含量是指氧的化学结合量和物理溶解量的总和。理论上每克血红蛋白可结合 1.39mL氧,但实际上每克血红蛋白结合氧量为 1.34mL。故临床常用的动脉血氧合量(CaO2)由下列公式计算:CaO2=1.34mL/(g·100 mL)×Hb(g)×SaO2(%)+0.003 mL/(mm Hg· 100 mL)×PaO2(mm Hg)。按上述计算,在一般正常条件下每100mL的血约含 20mL氧。
脉搏血氧饱和度(SpO2)被称为 I CU的第五生命体征已经被广泛地应用。其监测仪的基本结构包括光电传感器、微处理器和显示器三个部分。传感器内有两个发光二极管和一个光电二极管,两个发光二极管作为光源,分别发射波长 640 n m的红光和 940 n m的近红外光,将传感器放置在患者手指(或足趾、耳垂等)监测部位,两束光穿透组织时被部分吸收,剩余光由光电二级管接收后,将信号输入微处理器,从显示屏上可直接读到患者即刻 SpO2和脉搏数值,并可观察到指脉波波形。
正常青壮年在静息状态呼吸空气,SpO2可达0.95~0.98,SpO2< 0.94,提示轻度不饱和;SpO2< 0.89,提示中度不饱和;SpO2<0.85,提示重度不饱和。60岁以上老年人在静息不吸氧情况下,以及夜间入睡以后,SpO2仅达 0.89~ 0.92,并无不适反应。
SpO2虽能准确反映 SaO2,但并不能完全取代动脉血气分析。需要了解 PaO2、PaCO2、p H时,以及有影响SpO2准确性的因素存在等情况下,仍需及时作血气分析。
(3)P50
P50是在pH=7.40,PaCO2=40mm Hg(5.3 kPa),氧饱和度为 50%时的血氧分压。它代表血红蛋白与氧的亲和力,与组织氧供直接相关,是内呼吸的一个指标,也可表明氧离曲线的位置。其正常参考值为 24~28 mm Hg(3.2~ 5.3 kPa)。P50升高,氧离曲线右移;P50降低,氧离曲线左移。P50受血液 pH、温度及红细胞 2,3-二磷酸甘油酸(2,3-DPG)等因素的影响。2,3-DPG是红细胞内葡萄糖酵解的有机磷酸化合物,它是影响Hb与O2亲和力最重要的因素。2,3-DPG能与H b相结合,稳定Hb分子结构,使Hb与O2的亲和力减弱。所以2,3-DPG增多,氧离曲线即右移,氧饱和度下降,因而释放O2增多。2,3-DPG增多的常见原因有酸血症、低氧血症、贫血等。反之,2,3-DPG减少,则释放 O2减少。2,3-DPG减少的常见原因有碱血症、输库存血等。
p H下降、PCO2升高时,氧离曲线右移有利于O2的释放。温度升高,组织代谢增加,需 O2量增加,氧离曲线也右移。反之,当 p H升高、PCO2降低或温度降低时,氧离曲线即左移。
(4)肺泡-动脉氧分压差(P(A-a)O2)
P(A-a)O2是肺换气功能指标,不能直接测定,可根据简化公式计算:
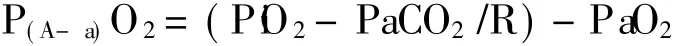
式中 P iO2为吸入氧分压,PaCO2为动脉血二氧化碳分压,R为呼吸商,括号内的部分计算结果为肺泡内氧分压。P(A-a)O2正常参考值约为 5~15mm Hg(0.7~2.0 kPa)。P(A-a)O2的大小可代表换气功能障碍的程度,也可代表分流量的大小。其影响因素较多,诸如 F iO2、/、ST、P50、弥散功能、氧耗量和心输出量等。临床使用时,应考虑这些影响因素。

CCO2为肺泡毛细血管氧含量,CCO2=SCO2(H b×1.34)+PCO2×0.0031,其中 SCO2为毛细血管血氧饱和度,可用 SaO2代替。PCO2为毛细血管氧分压,可用 PaO2代替。
5.CO2潴留指标监测
(1)PCO2测定
血浆中物理溶解的CO2所产生的张力称为二氧化碳分压(PCO2)。血液 PCO2测定由德气分析仪的二氧化碳电极完成,二氧化碳电极属于气敏电极,其基本结构是特殊形式的 p H玻璃电极,pH敏感膜是平板形,由一片充满[HCO-3]溶液的尼龙膜与气体可透过膜相隔。测量半电池是银-氯化银电极,外套一只有机玻璃套使电极浸浴在含有氯化钠的磷酸盐缓冲液中,参比半电池也是银-氯化银电极而不是甘汞电极,这一对半电池组装在一起,外面有一只顶端由硅胶 CO2可透膜封口的外套,套内充满电解液。当样品与之接触时,样品中的 CO2即可透过硅胶膜进入[HCO-3]液中,使[HCO-3]液的 pH发生改变,p H玻璃电极能检测出这一改变,进而推测样品中的 PCO2水平。正常范围,PaCO2为 35~45mm Hg(4.67~6.0 kPa)。中心静脉血二氧化碳分压 (P vCO2)为 42.7 ±0.8mm Hg(5.7 ±0.1 kPa),混合静脉二氧化碳分压为 42.3 ±1.7mm Hg(5.6±0.2 kPa)。中心静脉血气与混合静脉血的二氧化碳分压之间无显著差别,故临床上可用中心静脉血代替混合静脉血测定 PCO2。PaCO2是反映肺泡通气的良好指标。PaCO2<35 mm Hg(4.67 kPa)表明肺泡通气过度;PaCO2> 45 mm Hg(6.0 kPa)表明肺泡通气不足;PaCO2> 50 mm Hg(6.7 kPa)则表明 CO2潴留。
(2)经皮 PCO2(tcPCO2)测定
其测定原理是经皮PCO2探测器(sensor)内包括 p H电极和银 /氯化银参比电极,参比电极表面覆盖可以透过 CO2的薄膜。组织代谢产生的CO2经皮肤透过二氧化碳电极膜而弥散入电极内。当膜内外 PCO2相等时,弥散停止。CO2进入电极,使电解液的 p H发生变化,然后将 pH转化为相应的 tcPCO2值,并以数字形式连续显示出来。tcPCO2探测器内置一白金丝阴极,并以阳极为参比电极。当探测器加热超过正常体温时,毛细血管发生主动性扩张,毛细血管血动脉化。氧经过表皮和氧电极膜弥散入电解液内,并被阴极吸引,产生带负电荷的氧离子,进而产生微小电子流,并经放大后以 tcPCO2显示。
tcPCO2监测部位应选择皮肤薄、毛细血管丰富的区域,如胸、腹部或前臂屈侧皮肤。因电极温度需要保持在 43~45℃,在一个部位的贴附时间一般不超过 4 h,以免皮肤灼伤。严重水肿、休克及末梢循环不良的患者,皮肤缺乏足够的血液灌注,结果不可靠。
6.呼吸衰竭的影像表现
因引起呼吸衰竭的原发性疾病不同,所以呼吸衰竭的影像学表现各异。由于呼吸衰竭的临床表现缺乏特异性,其影像学表现也缺乏特异性。常规胸片可以帮助发现大部分呼吸衰竭的病因,但很难因此来鉴别心源性或非心源性的肺水肿,如X线表现为心影增大,血管影重分布,周围支气管袖带征,胸腔积液,Septal线和肺门蝴蝶影,常提示为肺静水压力升高致水肿,如果无上述 X线征象常提示为ARDS。ARDS的 CT表现可分为 5种基本类型:①毛玻璃样改变,云雾状高密度区,其间血管和支气管壁清晰;②实变,以肺实质密度显著增高为特征,肺血管纹显示不清,常有支气管气相;③网状改变,水肿或纤维化引起的小叶间隔增厚;④线状影,增厚的小叶间隔或纤维条索状影;⑤肺纹扭曲,表现为肺纹理扭曲或支气管扩张,即所谓的“牵引性支气管扩张”。
肺炎的病理是影像诊断的基础,病理上通常分为肺实质性炎症和间质性炎症。肺实质性炎症表现为肺泡壁毛细血管扩张与充血,肺泡内炎性渗出物聚积,形成肺实变,其 X线表现为结节影(腺泡)、斑片影(小叶)、大片影(小叶病灶融合)、肺段、肺叶阴影,病灶沿支气管血管束分布,动态变化较快。肺间质性炎症为支气管及肺的间质组织炎性浸润,而肺泡内渗出比较轻微,其 X线表现为小结节影(小叶中心结节)、网状、线状、磨玻璃样密度病灶,支气管血管束边缘模糊,动态观察变化较慢。
肺炎的影像表现可不同。多发粟粒或结节状影,可见于过敏性肺炎、细菌性肺炎或病毒性肺炎,粟粒阴影可见于外源性过敏性肺炎,结节阴影可见于肾移植术后巨细胞病毒性肺炎或细菌性肺炎,较大结节病灶可见于嗜酸性肺炎。单发结节或球形阴影,多见于细菌性肺炎,特别是化脓倾向的细菌性肺炎。肺段、肺叶阴影可见于细菌性肺炎、支原体肺炎、病毒性肺炎或卡氏囊虫肺炎,其中以细菌性肺炎多见。
典型的支气管肺炎在X线片上表现为两肺中、下野的内、中带沿支气管分布的斑点状致密阴影,密度不均匀,中心区略高,边缘较模糊,密集的病变可融合成大片。由于支气管及其周围间质的炎变,肺纹理增多、增粗、模糊,常见肺门影增大、模糊。由于细支气管的阻塞,常引起局限性肺气肿、肺大泡或肺不张。也有表现不典型者,如病灶很小,呈不规则的粟粒状影;有的病例仅表现为肺纹理增强和网状阴影的间质性炎症。
支原体肺炎 X线表现为:①初期主要表现为肺纹理增多、模糊,可呈网状改变;②继而出现边缘模糊的斑片状或斑点状肺泡实质浸润阴影,少数病例病变呈多数小片状病灶,有的融合成较大的片状阴影,病变分布较局限,多呈肺段分布,一般不超过肺叶;③病变在两周左右开始吸收消散,有时原病变区仍存在间质病变,需较长时间才能完全恢复正常。
三、呼吸衰竭的治疗
呼吸衰竭的治疗原则包括基础疾病(病因)治疗,去除诱发因素(诱因),保持呼吸道通畅,纠正缺氧,解除二氧化碳潴留,治疗与防止缺氧和二氧化碳潴留所引起的各种症状。
1.基础疾病治疗
(1)病因治疗 病因治疗是呼吸衰竭治疗的根本。呼吸衰竭的处理要依病情轻重掌握,基本原则是要改善氧气摄取和 CO2排出,同时进行针对原发病的治疗。治疗前首先要注意呼吸系统有无需要紧急处理的急症,如张力气胸,大量胸水,大片肺不张或大量痰堵等。早期或轻症病例,用一般内科疗法即可,晚期或危重病例,需根据病情做气管插管或气管切开,并不失时机地进行机械通气治疗。
(2)抗感染治疗 肺部感染在呼吸衰竭的发生、发展和预后中至关重要。由于支气管-肺感染病原及细菌耐药性的变迁,抗感染治疗的药物及方法也在不断变化。呼吸衰竭患者抗生素的经验性治疗不仅有赖于临床表现,还要关注本地区的细菌流行和耐药情况。有效的初始治疗、及时根据药敏试验更换抗生素有利于缩短平均住院日。
(3)保持气道通畅 采用纤维支气管镜清除呼吸道内痰栓、血凝块及分泌物,通畅气道,必要时冲洗并注入药物,可进行分泌物的培养、气道监护等。此措施在呼吸衰竭抢救中是安全、快捷、有效的。
(4)湿化与雾化吸入 呼吸道干燥时,气管黏膜纤毛清除功能减弱。通过向呼吸道输送适当水分,保持呼吸道正常生理功能,已成为呼吸衰竭综合治疗中的重要环节。湿化的方式有加温和雾化两种。
(5)胸部体疗 凡气道分泌物增多、黏稠,或分泌物的自然清除机制因疾病受到影响时,都可进行胸部体疗,如体位引流、拍击、振动、深呼吸等。
2.氧气治疗
氧气治疗(oxygen therapy)是应用氧气吸入纠正缺氧的一种治疗方法,简称氧疗。合理氧疗,可以纠正低氧血症,降低呼吸及心脏负荷。判断患者是否缺氧最客观的依据是动脉血气检查。呼吸衰竭〔PaO2<60 mm H g(8.0 kPa)〕是氧疗的绝对适应征。
(1)氧疗适应证 只要 PaO2低于正常就可给予氧疗,但在实际应用中更严格一些,临床上根据患者情况灵活掌握。但是呼吸衰竭患者 PaO2<60 mm Hg是氧疗的绝对适应证。氧疗目的也是要使 PaO2>60mm Hg。
(2)氧疗的方法 呼吸衰竭患者临床上最常用简便的方法是应用鼻导管吸氧,氧流量 1~3 L/m in,其吸氧浓度(FiO2)=21%+4% ×氧流量(L/m in)。有条件者也可用面罩吸氧。
(3)吸气浓度 对于呼吸衰竭应采用控制性氧疗,其吸氧浓度通常为 25% ~33%。对于Ⅰ型呼吸衰竭患者吸氧浓度可适当提高,尽快使 PaO2>60 mm H g,但一般也不超过 40%。对于Ⅱ型呼吸衰竭患者,宜从低吸氧浓度开始,逐渐加大吸气浓度,一般不超过 33%。其最终目标是 PaO255~60 mm Hg。而对升高的PaCO2没有明显加重趋势。
(4)鼻导管给氧 鼻导管给氧简便、易行,不影响咳痰、进食、说话,不存在重复呼吸,适于持续给氧。但吸氧浓度不恒定,当患者潮气量较大时易受影响,且高流一吸氧时对鼻腔局部黏膜有刺激。当鼻导管或鼻塞吸氧流量大于 5 L/m in时,宜改用面罩吸氧。中度缺氧时可用鼻导管给氧,氧流量 0.5~1 L/m in,吸入氧浓度约 30%。肺部有较广泛的实变,重度缺氧时用开式口罩给氧,流量要增至 3~5 L/m in(最好同时应用加温湿化器或雾化器增加吸入气的水分),吸入氧浓度可达 60%左右。
(5)面罩吸氧 Venturi面罩吸氧的氧浓度可调节且较恒定,重复呼吸少,但对咳痰、进食有一定影响。普通面罩吸氧的氧浓度可达较高水平,但氧浓度难以正确预计,适用于暂无条件行机械通气(mechanical ventilation,MV)的严重低氧而无CO2潴留的患者;面罩长时间佩戴会引起患者不适。通过吸入氧浓度,提高PaO2、增加氧弥散能力,提高 PaO2和 SaO2,增加组织供氧。在急性或慢性呼吸衰竭的氧疗中,以 SaO2>90%的吸入氧浓度为准,尽可能改善组织缺氧和减少 CO2中毒的发生。用面罩给氧仍不能解决问题,吸氧时PaO2低于 50~ 60mm Hg(6.7~ 8.0 kPa),可用呼吸道持续正压给氧(positive end expiratory pressure,CPAP),主要原理是利用呼吸道保持的正压(尤其是在呼气时),使减少的功能残气增加,避免肺泡早期闭合,并使一部分因渗出,痰堵等萎陷的肺泡扩张,减少肺内分流,改善氧的交换。通气不足的患者还可同时挤压橡皮囊进行辅助通气。
(6)高压氧治疗 主要适用于外呼吸功能正常,而氧在血液的运输发生障碍所导致的呼吸衰竭,如一氧化碳中毒、氰化物中毒、减压病等。提供氧疗的装置可分为低流量和高流量氧疗系统,应注意氧疗的监护与调整。在某些临床情况,被动地给予补氧,不能达到 SaO2的目标值,如双侧肺炎,ARDS导致严重的比例失调或分流等,此时需考虑采用其他方法来复张萎陷的肺泡,让其参加气体交换。应指出给氧只能提高PaO2,不能根本解决 CO2排出问题;在慢性呼吸衰竭时吸入高浓度氧还可以引起 CO2潴留。因此在改善缺氧的同时,必须同时注意改善通气功能。
3.机械通气治疗
机械通气(mechnical ventilation,MV)是借助于人工装置的机械力量产生或增强患者的呼吸动力和呼吸功能。机械通气是治疗急性呼吸衰竭和慢性呼吸衰竭急性加重最有效的手段。对于慢性呼吸衰竭患者正确使用机械通气治疗能十分有效地纠正缺氧和二氧化碳潴留,并能为原发支气管-肺部感染的治疗赢得时间,减少和避免缺氧和二氧化碳潴留对其他脏器造成的损害。如何根据呼吸衰竭的不同病因及其不同的病理生理变化,正确选用MV的策略和技术,及早防治各种并发症,是进一步提高呼吸衰竭抢救成功率的关键。
(1)肺保护性通气策略(lung protective ventilating strategy,LPVS) MV是治疗呼吸衰竭的重要手段,如应用不当可引起肺组织损伤,主要并发症为机械通气相差性肺损伤(ventilator-induced lung injury,V IL I),本质上是一种生物伤。其主要发生原因为压力伤(barotraum a)、容积伤(vo lutrauma)、不张伤(atelectraum a)和生物伤(biotraum a)。前三者都属于机械性损伤,后者属于生物性损伤。目前肺保护策略MV(小潮气量通气 )是循证医学中 A级的推荐意见。小潮气量通气,肺容积减少是AL I最重要的病理生理改变,AL I患者的肺实际上是“小肺”或“婴儿”肺。所以宜采用较小的潮气量(4~7 mL/kg)以避免肺泡的过度充气与损伤的发生。虽然目前对于小潮气量通气在 ALI的作用上研究结果证实它能降低气道压和病死率。小潮气量通气策略的应用已达到基本共识。通气参数设置和监测基本参数的设置应高度个体化,选用模式应视患者具体情况,以呼吸动力学参数和血气分析参数达到理想指标为根本目的。容许性高碳酸血症(perm issive hypercapnia,PHC)是指为避免气压-容量伤故意限制气道压或潮气量,容许 PaCO2逐渐升高>50 mm H g。小潮气量勇气不可避免的会引起 PHC和酸中毒,PH C是一种不得已而为之的手段,不能作为常规措施,若强求小潮气量和PaCO2升高,需大剂量的镇静剂和肌松剂,并可产生较多的负效应。适当的高碳酸血症对肺有保护作用,使其损伤减轻,其机制可能与肺组织抗氧化能力增强,脂质过氧化物损伤减轻等因素有关。
最佳呼气末正压通气(positive and expiratory pressdre,PEEP)的选择,最佳 PEEP的选择应以既能达到最大限度的肺复张,最大的氧合状态,不影响心排血量及诱发肺损伤为基本原则。但 PEEP过高使心排血量减少。另有所谓内源性 PEEP(intrinsic PEEP,PEEPi)则是指因呼吸道阻力增加和肺-胸廓弹性回缩力减弱,呼吸不畅且不完全,以致呼气末肺泡内残留气体增加,在肺弹性回缩下产生呼气末肺泡内正压。COPD患者的平均 PEEP i约为 7 cm H2O。若 COPD患者使用 PEEP治疗,其压力以 2~5 cm H2O为宜。选择最佳 PEEP的合理步骤,见图1。

表2 弥漫性通气减少和局部通气减少的特点Table 2 The characteristics of reducing diffuse ventilation and local ventilation
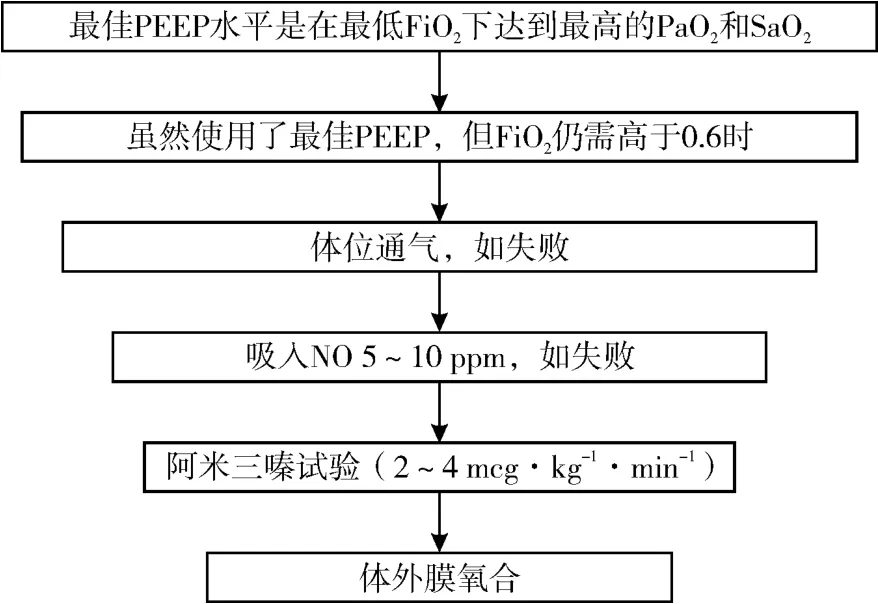
图1 选择最佳 PEEP的合理步骤
(2)间歇正压通气(interm ittent positive pressure ventilation,IPPV) 该通气是临床应用最早、最普遍的通气方式,也是目前机械通气最基本的通气模式,很多通气模式均是在此基础上的改良和进一步完善。它在吸气相是正压,呼气相压力降为零。临床上泛指的机械通气就是 IPPV。IPPV通气机可以配置同步或非同步、控制或辅助等装置,也可以配置各种特殊的呼吸模式。IPPV主要应用于各种以通气功能障碍为主的呼吸衰竭患者,肺心病是其最合适的应用对象。
(3)压力支持通气(pressure support ventilation,PSV) 该通气是一种辅助通气方式,即在自主呼吸的前提下,每次吸气都接受一定水平的压力支持,以辅助和增强患者的吸气能力,增加患者的吸气幅度和吸入气量,PSV既可以作为独立的一种通气模式单独应用,也可以作为一种通气功能与其他的通气模式同时使用。PSV的压力可以自行设置和任意调节。吸气压力随患者的吸气动作开始,并随吸气流速减少到一定程度或患者有呼气努力而结束。它与 IPPV有类似之处,但支持的压力恒定,受吸气流速的反馈调节。应用此种通气功能时,事先只需要设定吸气压力和触发灵敏度,患者可独立控制吸、呼气时间,并与支持压力共同调节吸气流量和潮气量。COPD并发慢性呼吸衰竭患者通常在脱机过程中应用 PS V,以训练呼吸肌力量,为正式脱机做好准备。
(4)容量控制通气(vdume control ventilation,VCV) 该通气模式预设呼吸频率,潮气量,吸气流速(或吸气时间),患者无需自主呼吸,由通气机提供全部通气支持。常用于麻醉、昏迷或瘫痪患者。
(5)辅助-控制通气(assis-t contrel ventilation,CV-AV) 该通气模式给患者固定的潮气量和进气流速,并预设呼吸频率和触发灵敏度。通气机将该通气频率与患者自主呼吸的频率相比较,如果反馈的呼吸频率比预设频率少,则通气机补充其不足,以使患者获得最低通气支持。该通气模式不考虑患者的吸气努力,每次进气量均为所设定的潮气量。
(6)压力控制通气(pressure control ventilation,PCV) 该通气模式预设每分钟气道压力上升幅度、上升次数和每分钟气通压力,同时预设吸呼比和吸气时间,主要也是用于麻醉或瘫痪的患者。但气道痉挛,痰液阻塞患者的患者通气量不能保证。
(7)压力控制反比通气(pressure control inverse ventilation,PCIRV) 该通气模式与常规的定压通气不同之处在于:呼气时间设定比吸气时间短,吸呼比为反比。该种通气模式可以使呼吸末的功能残气量增加,避免肺泡萎陷,改善/比,但使用不当可引起气压伤和循环不稳定。
(8)无创伤性正压通气(noninvasive positive pressure ventilation,NPPV) 及时实施 N IV与有创MV的相互交替,优势互补,使有创MV时间降到短,是降低与之有关的并发症和保证N IV与有创交替MV方式有效的主要措施,可减少并发症,降低死亡率,改善呼吸衰竭的预后。在临床上可参考采用Mehta etal工作程序:①合适的监护条件;②患者取坐位或卧位(头高 30度以上,注意上气道的通畅);③选择合适的连接器(罩或接口器等);④选择呼吸机和通气模式;⑤配带头带(鼓励患者扶持罩,避免固定带的张力过高);⑥开始和连接呼吸机;⑦开始用低的压力(容量),用自主触发(有后备频率)的模式(压力限制型:吸气压 8~12 cm H2O,呼气压 3~5 cm H2O;容量限制型:10 mL/kg);⑧按照患者的耐受性逐渐增加吸气压(至 10~20 cm H2O)或潮气量(至 10~15 mL/kg),以达到缓解气促,减慢呼吸频率,增加潮气量和理想的人机同步的目标;⑨监测血氧饱和度,需要时给氧,使 SatO2>90%;⑩检查漏气,必要时调整固定带的张力; 11有指征时加用湿化器; 12对燥动的患者考虑使用浅镇静剂(氯羟甲基安定 0.5mg); 13需要时反复鼓励和检查患者; 14间歇监测血气(开始1~2 h后,以后按需而定)。NPPV可以通气降低呼吸肌的负荷和帮助肺泡勇气降低 PaCO2,这一结果已被许多临床试验所证实。Brochard报道了一组大样本的随机临床试验,比较了NPPV和以往的 ICU治疗,发现采用NPPV可以降低在 ICU内并发症和病死率,对NPPV失败的患者病死率和插管组相似(25%和 30%)。Plan和他的同事最近发表的一个大样本前瞻性的随机研究,比较 COPD急性加重期采用NPPV和常规治疗,并在病房里应用NPPV前护士岗前培训 8 h,结果发现常规治疗组比 NPPV的治疗失败比为27%比 15%。因采用NPPV,患者住院病死率明显降低(20%比 10%)。
(9)间歇指令通气同步间歇指令通气(inter m ittent mandatory ventilation, IMV/synchronized interm ittent mandatory ventilation,S IMV) IMV/S IMV的工作原理大致相同,均是在每分钟内按操作者在通气机上设置的呼吸参数给予患者指令性呼吸,惟一不同点是: IMV没有同步装置,供气不需患者自主呼吸触发;S IMV设有同步装置,即使是上通气机提供的指令性通气,也由患者的自主呼吸触发,故可达到同步呼吸的目的,更好地保证患者的有效通气量。
S IMV/I MV主要用于慢性呼吸衰竭患者脱机前的训练和过渡,但并非所有脱机的患者均要经过 IMV/S IMV阶段,这主要取决于脱机的难易程度。脱机前,可将 IMV/S IMV的呼吸次数由正常水平逐渐减少,直至完全脱机。一般当指令呼吸次数降至 5次 /m in,患者仍可保持较好氧合状态时,即可考虑脱机。应用常规通气时,多与 PSV同时使用( IMV/S IMV+PSV),以避免或加重呼吸肌疲劳。
(10)“开放肺”通气策略 所谓“开放肺”(open lung)是让有萎陷趋势的肺复张,并在整个呼吸周期保持复张状态,以肺内分流<10%为理想水平,同时能在较低呼吸道压的情况下保持理想的气体交换。
肺泡复张手法(recruitment maneuver,RM)是指在MV过程中,间断地给予高于常规平均气道压的压力并且维持一段的时间(一般不超过 2m in)。
RM的方法包括持续充气(sustained inflation,SI)、叹气 (sigh)、高频通气 (high-frequency ventilation,HFV)、高频震荡通气(high frequency oscillatory ventilation,HFOV)、高水平 PEEP、控制性高平台压和间断大潮气通气等方法,及持续气道正压通气(CPAP)、PCV、双水平正压通气(B-i level positive airway pressure,B-i PAP)等通气模式。采用双水平气道正压通气,予以 S/T模式,即压力支持通气(PSV)+PEEP,这样既可改善氧合,又可防止肺泡及小气道萎陷,减少肺泡内渗出,防止/比例失调,还可避免气压伤的发生,增加患者的依从性,并使MV早期应用成为可能。
(11)不同疾病的机械通气策略 使用机械通气必须选择适合患者需要的通气模式,需根据患者的呼吸力学,原发病的情况以及气体交换的情况对通气机进行设定和调整,S IMV和辅助通气常可以在机械通气初使用,如患者已有自主呼吸,可尝试使用 PSV;对轻中度的呼吸衰竭也可使用 PSV,机械通气的氧流量的调节和设定应遵守最小的氧流量达到氧饱和度高于 90%和氧分压大于 60 mm Hg的原则,对长期用氧的患者氧流量应低于0.6,以免引起氧中毒。
(12)呼吸机的同步问题 在使用机械通气时,许多患者会出现机械通气和自主呼吸不同步的问题,为达到同步,通气机不仅要感受到患者的吸气努力,而且要感知患者的呼气要求,呼吸肌的氧耗增加,患者的舒适度降低。为了尽可能地让呼吸机和患者同步,可采用多种方法,现代呼吸机比以往呼吸机装备了更好的通气活瓣和传感装置,采用流量触发能更好地对患者的自主呼吸产生应答。患者和呼吸机的不同步可能是 auto-PEEP的原因,auto-PEEP可以导致吸气阈值升高,呼吸机的吸气敏感度降低,针对这种情况可以尝试采用外源 PEEP降低吸气阈值,有时仍需要用镇静剂来使机械通气和患者自主呼吸同步。
4.支气管扩张药物的应用
支气管扩张药能够舒张气道平滑肌,对慢性呼吸衰竭患者通畅气道、改善缺氧和二氧化碳潴留是非常有益的。所以,正确使用支气管扩张药对呼吸衰竭患者将是有益的。
(1)抗胆碱能药物 应首选抗胆碱能药物如溴化异丙托品(ipratropiu m brom ide),因 COPD患者气流阻塞的可逆成分是由副交感神经介导的。可通过吸入给药,很少吸收入血循环,不良反应极小。其起效时间稍慢于 β2激动药,30~90m in达作用高峰,疗效维持 4~6 h。新一代的抗胆碱能药物氧化托品(oxiropium)疗效延长,可维持 6~8 h。对 COPD并发呼吸衰竭的患者可以单独使用,也可以与 β2激动药联合使用。非急性期的患者长期使用有改善肺功能的作用。使用抗胆碱能药物的最大优点为其安全性。目前被认为是治疗COPD患者气道阻塞的较为理想的药物。
(2)β2激动药 β2激动药具有迅速和确切的支气管扩张作用。但由于慢性呼吸衰竭患者大多气道阻塞的可逆性极小,因此,使用 β2激动药的疗效较差。但对 COPD合并哮喘或慢性呼吸衰竭急性加重期的患者仍是有效的,可以选用。
β2激动药可以经吸入、口服、皮下和静脉途径用药,但是最好通过吸入方式给药。吸入与口服和静脉给药相比,有用药量小,见效快和不良反应小的优点。吸入用药的剂量是口服剂量的 1/10~1/20。而且见效快,通常用药后几分钟开始见效,15~30m in作用达高峰。口服给药最常见的不良反应有肌肉震颤,但吸入用药引起肌肉震颤则十分罕见。另外,吸入用药导致心血管系统的不良反应也明显少于全身用药。对大多数患者吸入给药和静脉给药同样有效。而且静脉给药对心血管系统的不良反应发生率较高,所以,一般主张吸入给药。对有明显呼吸困难,吸入给药有困难或吸入给药无效的患者可采用口服、静脉或皮下注射给药。
临床常用 0.5%沙丁胺醇(万托林)溶液 1~5mg或特布他林(叔丁喘宁)2.5~10mg加入超声雾化器将药物雾化后吸入。有夜间喘息症状的患者可以使用长效的 β2激动药如沙美特罗,其优点是使用一次作用可持续 12 h。
(2)氨茶碱 近年研究发现,氨茶碱除有扩张支气管的作用外,还有一定的抗气道非特异性炎症的作用,COPD患者长期服用小剂量的氨茶碱可以改善患者肺功能。氨茶碱可分为普通剂型和缓释剂型。口服和静脉使用普通剂型适用于急性加重期患者的治疗。由于氨茶碱的治疗剂量和安全剂量很接近,血中浓度的个体差异较大,故每日剂量不应超过 0.8,静脉使用时输液速度不宜过快。一般开始剂量为 2.5~5 m g/kg(负荷量 );30 m in内给完。维持剂量:0.5 mg/(kg·h),并根据患者症状和血药浓度进行调整。
需要注意的是许多因素可以影响氨茶碱在体内的代谢和血药浓度,吸烟、饮酒、抗惊厥药物,利福平可降低氨茶碱半衰期。喹诺酮类药物、西咪替丁等可增加血药浓度。所以,有条件应随时监测血中氨茶碱浓度,防止茶碱过量的不良反应发生。
5.呼吸兴奋剂的应用
呼吸兴奋剂是为增加通气量及改善动脉血气而应用的直接或间接兴奋呼吸的药物,也称为呼吸刺激药。它主要用于通气严重不足,伴有神志不清或昏迷,或对吸氧后造成缺氧驱动作用减弱,呼吸出现抑制,造成 CO2潴留的患者。它通过兴奋呼吸中枢,从而增加肺泡通气量,有利于体内潴留的二氧化碳排出,并改善缺氧。此外,尚能使患者暂时清醒,有利于咳嗽和排痰。
(1)尼可刹米(可拉明) 是最早应用的呼吸兴奋剂,目前仍为国内常用药物,疗效较为确实。主要兴奋延髓中枢,对颈动脉体及主动脉体的外周化学感受器也有刺激作用,主要为增加呼吸频率。但在通气增加同时,代谢率也上升,通气效率未有相应改善。在机械负荷增加,如气道阻力升高或胸、肺顺应性降低时,这种负性作用更加明显。对大脑皮质、对循环中枢也有兴奋作用。在治疗剂量下有苏醒作用,但持续时间短,停药后又陷入原先的状态。一般在临床上,当有效剂量注射 30 m in后,可出现皮肤发红、瘙痒、呕吐、出汗,显著烦躁不安,面部和四肢肌肉抽搐,甚至延及全身。使用时间超过 12 h后,也易出现烦躁不安等副作用。通常以静脉注射为合适。治疗剂量因人而异,应逐渐摸索,一般以 0.75 g静脉注射,继则以 3.0~4.5 g加入 500 mL液体中,继续静脉滴注 4~6 h,10~40 m g/m in。应观察神志变化、呼吸的频率及形态、潮气量、血气变化,随时调节剂量。肌注效果较差,观察 12 h以上如效果不佳或有严重的反应,应及时改换机械勇气。
(2)洛贝林(山梗菜碱) 主要刺激颈动脉体化学感受器,反射性地兴奋呼吸中枢,副作用小,通常用量为每次 3~9 m g静脉或肌肉注射,可重复应用,也可静脉注射后以 15~30 m g加于500 mL液体内静脉滴注,一般与尼可刹米合用或交替使用。
(3)哌甲酯(利他灵,m ethylphenidate) 可降低呼吸中枢对 CO2的阈值,兴奋呼吸,常用 10~50 m g静脉注射,可重复使用,副作用较少,可有头痛、头晕等。
(4)多少普仑(doxapram) 直接刺激颈动脉体化学感受器,反射性兴奋呼吸中枢,增加通气,而对其他中枢神经的兴奋作用则降至最低程度;中毒剂量与治疗剂量相距较远,安全域广,致痉剂量是呼吸兴奋作用的 70倍。治疗量时主要是对外周化学感受器的刺激,此药对外周化学感受器受到抑制而呼吸中枢完整者的效果较好,但在呼吸衰竭时,由于低氧血症存在,化学感受器已接近最大限度的兴奋,用药后改变不多。对于原发性低通气综合征等主要由于呼吸中枢功能下者,效果较好,但对神经肌肉疾病引起的呼衰,使用不利。肺心病呼衰患者在氧疗时合用多沙普仑,可有效拮抗氧疗所致的 CO2潴留。除兴奋呼吸外,亦有易醒作用,用于静脉全麻后催醒,一般用量每次按每年克体重 0.5~1.5 mg静脉注射或静脉滴注,开始滴速 1.5 m g/m in,以后酌情加快。副作用有恶心、呕吐、烦躁、心动过速、心律失常和高血压。有癫痫、惊厥、严重高血压及甲亢者禁用。长期应用也可发生肝毒性和消化道溃疡。也有呼吸兴奋作用,并可对大脑皮质起镇静、解除肌痉挛作用。
(5)阿米脱林(a lm itrine) 是近来出现的新型呼吸兴奋剂,可改善低氧血症。它可能有两方面作用:刺激外周化学感受器和改善肺部的通气 /血流比率。应用米脱林后 P aO2改善而 PaCO2变化不明显,潮气量增加,吸气时间缩短,表明换气功能的改善和呼吸类型的变化有关。通过影响吸气分布,并使通气不良区的肺血管收缩,血流向通气较好的区域,改善通气 /血流比。本药副作用小,常用剂量是 100~200 mg/d,分 2次服用。此外氨茶碱也有强效的呼吸刺激作用。黄体酮类刺激作用稳定,但非速效。纳洛酮等为吗啡样物质的拮抗剂,无依赖性,比较完全,作用时间短,不适于长期应用。亦可用胆碱能阻滞剂如东莨菪碱。
对呼吸衰竭患者的中枢状态,研究意见不一。有学者发现急性呼衰时患者呈浅快呼吸,呼吸耗功增加,此时应减少吸气肌的负荷(减少阻力及其他负荷),即对呼吸中枢刺激不可能产生高通气,只会进一步使用呼吸肌功衰退,因此应正确掌握其应用的适应征。对药物过量引起的呼吸衰竭和其他非器质性中枢性呼吸衰竭,可使用本类药物,而对神经传导系统和呼吸肌病变,以及以换气障碍为特点的呼吸衰竭和肺炎、肺水肿、ARDS等则有害无益。慢性肺引起者则需从呼吸中枢、支气管—肺病变及呼吸肌疲劳三方面全面考核,在有指征使用呼吸兴奋剂时,还需努力降低气道阻力,消除间质水肿,改善胸肺顺应性,以利于药物作用的发挥。
6.纠正酸碱失衡及电解质紊乱
呼吸衰竭时,由于缺氧,细胞能量代谢的中间过程受到抑制,无氧代谢可引起体内有机酸的中毒。同时,有感染性休克、血容量不足,以及肾功能衰竭等又进一步加重了代谢性酸中毒。酸中毒的存在也引起了相应的电解质改变,再加上治疗措施的影响,如激素、利尿剂等的应用,可以产生代谢性碱中毒和呼吸性碱中毒等改变。为此,应根据不同阶段的主要矛盾,采取相应的积极措施加以纠正。
(1)酸碱失衡的治疗 慢性呼吸衰竭大部分是由于支气管—肺部感染加重而引起气道阻塞加重,使 CO2潴留和严重缺氧,随之出现酸碱失衡和电解质紊乱。因此在治疗上首先要积极治疗支气管—肺部感染,解痉祛痰,通畅气道,解 CO2潴留。强调尽快地通畅气道,解 CO2潴留,随着气道通畅,CO2潴留解除,呼吸性酸中毒及低氧血症随之纠正。因此,原则上不需要补碱性药物。但当 pH<7.20时,为了减轻酸血症对机体的损害,可以适当补 5%碳酸氢钠,一次量为 40~60 mL,以后根据动脉血气分析结果酌情补充。只要将 pH升至 7.20以上即可。当呼吸性酸中毒并代谢性酸中毒时,补碱量可适当加大,在 pH<7.20时,一次补 5%碳酸氢钠量可适当加大,在 pH<7.20时,一次补 5%碳酸氢钠量可控制在 80~100 mL,以后根据动脉血气分析结果再酌情处理。而对于伴有严重低氧血症的呼吸性碱中毒,只要治疗肺部感染、通畅气道,吸氧纠正低氧血症即可,随着上述治疗,呼吸性碱中毒可随之好转。要注意预防碱中毒的发生。慢性呼吸衰竭患者的碱中毒可见于呼吸性酸中毒并代谢性碱中毒、呼吸性碱中毒、呼吸性碱中毒并代谢性碱中毒、CO2排出后碱中毒 (post-hypercapnic akalosis)和呼碱型三重型酸碱失衡。其中并发的代谢性碱中毒大部分是医源性引起的,临床上应注意预防,只要患者尿量 500 mL/d以上,常规补氧化钾 3.0~4.5 g/d,牢记“见水补钾,多尿多补,少尿少补,无尿不补”的原则。应注意CO2不要排出过快,特别是机械通气治疗时,避免 CO2排出后碱中毒的发生。
近年来由于阴离子隙(anion gap,AG)和潜在[H CO3-](potential bicarbonate)及酸碱失衡预计代偿公式的应用,在临床上也发现了复杂的酸碱平衡紊乱。所谓三重型酸碱失衡,就是在一种呼吸性酸碱失衡的同时,合并代谢酸中毒和代谢性碱中毒。其治疗除针对原发疾病外,还要针对主要矛盾采取相应的措施,使三重酸碱转为二重紊乱,二重酸碱紊乱再转变为单纯性酸碱失衡。
(2)电解质紊乱的纠正 慢性呼吸衰竭患者酸碱失衡常同时存在严重水和电解质紊乱。其中,水、钠异常较为常见;[H CO3-]和 [C l-]变化常与 CO2变化有关;电解质紊乱特别是 [K+]、[C-l]和酸碱失衡互为因果。例如低氯、低钾可引起碱中毒,而代谢性碱中毒又可引起低钾和低氯。注意针对不同情况,进行相应的预防与治疗。
患者因长期消耗,特别是总体钾常严重缺失,缺失量可达总钾量的 16% ~37%;一旦低钾,短期不易纠正。故在呼酸阶段,即使血清钾浓度正常,只要尿量在 20 mL/h以上者,即应给予生理维持量 40~60 mm ol(即 3.0~4.5 g)的氯化钾。对血清钾浓度降低为 3 mmo l/L、2 mm ol/L及1 mm ol/L,且尿量正常的低钾患者,一般除每日正常需要的维持量外,应分别补充氯化钾 3 g、6 g、9 g以上。给钾后,[K+]由尿中排出增多,[H+]排出减少,同时给氯后因血中 [C l-]增多,肾脏排出[H CO-3]也增多,致血中[H CO3-]减少,而有利于碱中毒的纠正。
7.利尿剂和强心药的应用
慢性呼吸衰竭患者常常合并心功能不全,需要使用利尿药和强心药。利尿药的使用原则:小量、联合 (排钾和保钾利尿药联合)、间歇使用,注意补钾。每日尿量在 500 mL以上时应常规补钾,多尿多补,少尿少补,无尿不补。
合并心功能不全时可酌情使用强心药,但要慎用。因缺氧患者对洋地黄类药物的疗效较差,且易出现中毒。洋地黄类药物使用原则:①剂量要小,是常用剂量 1/3~1/2;②使用快速洋地黄类药物例如毛花苷 C、地高辛等;③不能以心率减慢作为洋地黄类药物有效的指标。因为呼吸衰竭患者缺氧时,心率较快,常在 110/m in左右。
8.糖皮质激素的应用
激素对 COPD的作用仍有争议。但在慢性呼吸衰竭急性加重期口服和静脉使用糖皮质激素通常是有效的。其目的是减轻气道炎症,通畅气道和提高患者的应激能力要,减轻脑水肿,但应避免使用时间过长,以防止其不良反应发生。可静脉滴注甲泼尼龙 40~80 m g,每 12 h 1次,连用 3 d;或泼尼松 60 m g口服,逐渐减量,持续 10 d。
9.营养支持治疗
慢性呼吸衰竭患者因能量代谢增高,蛋白分解加速,摄入不足,机体处于负代谢。长时间营养不良会降低机体的免疫功能,感染不易控制,呼吸肌疲劳,以致发生呼吸泵功能衰竭,不利于患者的救治和康复。故在慢性呼吸衰竭救治中需要注意对患者的营养支持。抢救时应常规给予鼻饲高蛋白、高脂肪、低糖类,以及适量多种维生素和微量元素的饮食。必要时需要静脉高价营养治疗。营养支持应达到基础能量消耗值。
呼吸衰竭患者,实际能耗要增加 20%;而机械通气患者则要增加 50%。补充时宜先用半量,然后逐渐增加至理想水平。胃肠营养时还要特别注意调整胃肠道功能和预防胃—食管反流。三大能量要素的比例宜为:糖类 45%~50%,蛋白质 15% ~20%,脂肪 30%~35%。
10.消化道出血的防治
慢性呼吸衰竭患者由于缺氧、二氧化碳潴留以及使用糖皮质激素和氨茶碱等因素,常可并发消化出道血。其防治原则为病因治疗和对症治疗:①尽快纠正缺氧和解除二氧化碳潴留;②应慎用或禁用对胃肠道有刺激的药物或食物;③预防性应用制酸药,如氢氧化铝凝胶、H2受体药或质子泵抑制剂,如西咪替丁、雷尼替丁或泮托核唑、埈索美拉唑以控制胃液酸度,减少出血机会;④对有消化道出血先兆者,及早安置胃管,先抽尽胃内容物,胃内注入去甲肾上腺素或用凝血酶;⑤如无 DIC并存,消化道出血可用止血敏,6-氨基己酸等;⑥如合并 DIC,应用抗凝剂肝素及低分子右旋糖酐等;⑦出血明显,发生严重贫血者,应补充血容量,纠正贫血。
