铁皮石斛茎段组培快繁体系的改良研究
2011-01-18张红兵刘金龙张朝举郑小江
张红兵,武 芸,2,刘金龙,蒲 鑫,张朝举,吴 娟,郑小江,*
(1.湖北民族学院 生物科学与技术学院,湖北 恩施 445000;2.湖北省生物资源保护与利用重点实验室(湖北民族学院),湖北 恩施 445000)
铁皮石斛(Dendrobiumcandidum)为兰科石斛属多年附生草本植物,是名贵中药西枫斗的原植物[1].有“除脾下气,补五脏虚劳羸弱,强阴,久服厚肠胃,轻身延年”[2]的效果.近年来,许多学者对铁皮石斛的有效成分及作用进行了研究,其含有多糖、氨基酸及多种无机元素,具有抗衰老、抗肿瘤、降血糖的作用[3].
目前,铁皮石斛的组织培养已是一项日渐成熟的繁殖技术.但组织培养过程中还存在褐化、分化率低等限制增殖的问题.雷文瑾[4]研究发现在组织培养基中加入活性炭能够很好的防止褐化,为解决铁皮石斛组织培养过程中的褐化问题奠定了基础.笔者在试验中改良了组织培养培养基配方,取得了一定的研究进展,现将结果报道如下.
1 材料与方法
1.1 试验材料
研究材料是由湖北仙芝堂生物科技有限公司提供的铁皮石斛幼嫩茎段.
1.2 实验方法
1.2.1 材料处理 选取带有芽原基的配皮石斛嫩茎,去掉茎段表面的假鳞.将铁皮石斛嫩茎切成1~2 cm的茎段,每段带有一个茎节.采用以下消毒方式进行材料表面消毒[5-6]:自来水流水冲洗30 min,在超净工作台上用75%酒精消毒30 s,无菌水清洗1次;再用0.1%升汞消毒杀菌8 min,最后用无菌水清洗5次后接种到培养基中.
1.2.2 铁皮石斛腋芽诱导培养基的改良 以MS培养基为基本培养基,添加蔗糖20 g·L-1,琼脂7.6 g·L-1.以NAA(0.5、1.0、1.5、2.0 mg·L-1)和6-BA(1.0、2.0、3.0、4.0、5.0、6.0 mg·L-1)不同浓度两两组合添加到MS培养基中,优选出适合铁皮石斛腋芽诱导的最佳培养基. 共24个处理,每个处理接种20瓶,每瓶接种1个外植体.在温度(25±2)℃,光照2 000lx、12 h·d-1的培养条件下培养30 d后观察实验结果.
1.2.3 铁皮石斛组织培养过程中防褐化的研究 以新鲜的铁皮石斛茎段为外植体,以MS+蔗糖20 g·L-1+琼脂7.6 g·L-1+NAA 1.0 mg·L-1+6-BA 3.0 mg·L-1为基本培养基,分别添加活性炭(1、2、3、4 g·L-1)或Vc(0.5、1.0、1.5、2.0、2.5、3.0 g·L-1)进行防褐化研究,15 d后观察实验结果.
1.2.4 铁皮石斛生根培养基的改良 切取通过腋芽诱导出的铁皮石斛幼苗,以1/2MS培养基为基本培养基,分别添加浓度为0.5、1.0、1.5、2.0、2.5 mg·L-1的IBA,接种铁皮石斛幼苗,培养40 d后观测生根的铁皮石斛幼苗的数量,探索获得最适合铁皮石斛幼苗生根的培养基.
2 结果与分析
2.1 铁皮石斛腋芽诱导培养基的筛选试验结果
由表1可看出:在相同的NAA浓度下,随着6-BA浓度的升高,腋芽诱导率增加,在达到一个最高值后又逐渐降低;在相同的6-BA浓度下,随着NAA浓度的升高,诱导率有相同的变化趋势.处理9、10、17、18均达到了较高的诱导率,分别为95%、85%、85%、80%,所以最适合铁皮石斛腋芽诱导的培养基为MS+蔗糖20 g·L-1+琼脂7.6 g·L-1+NAA 1.0 mg·L-1+6-BA 3.0 mg·L-1.
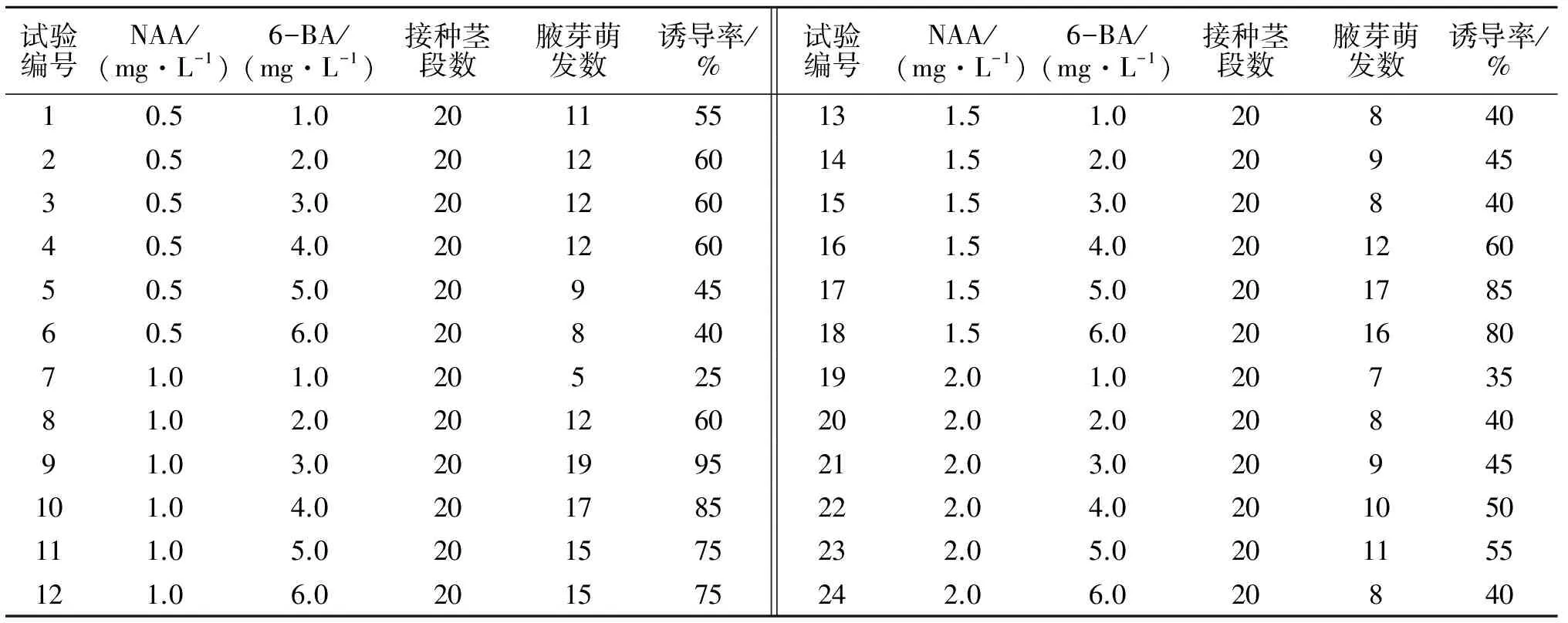
表1 NAA、6-BA组合对腋芽诱导的影响
2.2 铁皮石斛组织培养中防褐化的研究
在培养基中添加活性炭和维生素C均能达到很好的防褐化效果,在培养过程中外植体会分泌出酚类物质,被多酚氧化酶系氧化成醌类物质,而使培养基褐化,影响外植体的生长和分化[8-9],利用活性炭的吸附作用或者维生素C的还原作用可以防止褐化.结果表明(见表2)2、3、9、10号处理效果很好,褐化率都为0,即在培养基中加入2~3 g·L-1的活性炭或2.5 g·L-1的Vc均能达到很好的防褐化的效果.
2.3 铁皮石斛生根培养基的选择结果
在1/2MS为基本培养基的条件下,添加一定浓度的IBA有利于促进铁皮石斛幼苗的生根,研究表明(见表3),随着IBA浓度的升高,铁皮石斛幼苗的生根率增加,当IBA的浓度为2.0 mg·L-1时,铁皮石斛幼苗的生根率达到了90%,IBA浓度继续升高,生根率又逐渐降低,获得诱导铁皮石斛幼苗生根的最佳培养基为:1/2MS+IBA 2.0 mg·L-1.
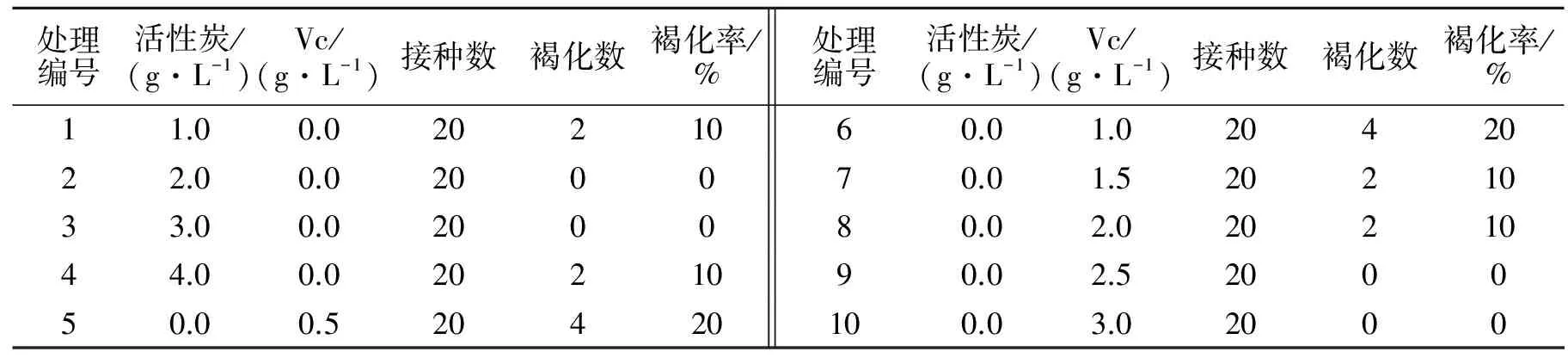
表2 活性炭和维生素C防褐化作用
3 结论
在总结前人的研究成果基础上,根据铁皮石斛的生长特点[7],研究获得改良的组织培养最佳的培养基,在腋芽诱导、防治褐化和生根研究三方面均取得了一定的突破.
研究结果表明,诱导腋芽的最佳培养基为:MS+蔗糖20 g·L-1+琼脂7.6 g·L-1+NAA 1.0 mg·L-1+6-BA 3.0 mg·L-1;诱导生根的最佳培养基为:1/2MS+IBA 2.0 mg·L-1.向培养基中加入活性炭2 g·L-1或Vc 2.5 g·L-1均能有效地防止外植体和培养基的褐化.
[1] 杨一令,来平凡,蒋士鹏.铁皮石斛研究进展[J].山东中医药大学学报,2008,32(1):82-85.
[2] 魏·吴普等述,清·孙星衍等辑.神农本草经[M].北京:人民卫生出版社,1982:21.
[3] 刘灿兰,尚子义,曲卫玲.铁皮石斛保健产品的研究开发价值[J].中国民族民间医药,2010:19(18):29.
[4] 雷文瑾.寒兰组织培养中酚污染控制研究初探[J].南方园艺,2009,20(3):17-18.
[5] 武芸.香樟愈伤组织的诱导和改良[J].湖北民族学院学报:自然科学版,2010,28(2):216-218.
[6] 张泽,武芸.植物生长调节剂对五鹤续断组织培养的影响[J].湖北民族学院学报:自然科学版,2010,28(2):219-221.
[7] 孙志蓉.铁皮石斛试管苗生长发育动态研究[J].北京中医药大学学报,2010,33(2):83-88.
[8] 刘会清,张爱香,常美花,等.春石斛兰的茎段繁殖研究[J].北方园艺,2008(1):181-183.
[9] 张维民.石斛兰生根培养过程污染的控制研究[J].广西农业科学,2005,36(2):113-114.
