淋巴管内皮细胞透明质酸受体-1标记的乳腺癌微淋巴管密度测定及其临床意义
2011-01-18钱文军
钱文军
东南大学附属江阴医院(江苏 江阴 214400)
乳腺癌是我国女性肿瘤常见类型,其淋巴道转移是最主要的转移途径[1],淋巴转移又是决定乳腺癌分期与选择治疗方案的关键因素之一,因此如何准确判断乳腺癌患者是否发生淋巴道转移对于临床选择治疗方式具有重要意义。长期以来由于缺少淋巴管内皮细胞特异性标识物,使得肿瘤的淋巴管生成研究较为迟滞,近年来随着淋巴管内皮细胞分子标记物的发现,对淋巴管进行鉴别提供了良好的载体,淋巴管内皮细胞透明质酸受体-1(LYVE-1)是存在于淋巴管内皮细胞上的膜蛋白,是淋巴管内皮细胞特异性标志物之一[2]。本研究采用免疫组化方法检测LYVE-1在乳腺癌肿瘤组织微淋巴管的表达,并在显微镜下计数微淋巴管密度(MLD),旨在探讨MLD与乳腺癌转移的关系。现报道如下:
1 临床资料与方法
1.1临床资料54例乳腺癌患者为2008年1月~2010年10月我院经手术切除转入肿瘤科的患者,所有患者均经病理HE染色证实为乳腺腺癌,其中年龄32~78岁,平均年龄57.1岁,有淋巴结转移者31例,无淋巴结转移者23例,未浸及浆膜层者19例,浸及浆膜层者35例;肿瘤部位:高位15例,中位21例,低位18例;肿瘤大小:≥4 cm者28例,<4 cm者26例;组织学类型:高分化腺癌8例,中分化腺癌31例,低分化腺癌16例;Dukes分期:A期23例,B期8例,C期11例,D期12例;所有患者病理切片均经我院病理科资深医师依据WHO 2006年肿瘤分类及诊断标准进行诊断。
1.2仪器与试剂兔抗人LYVE-1多克隆抗体及SABC免疫组化染色试剂盒购自上海优宁微生物科技有限公司;DAB酶底物显色试剂盒为福州迈新生物技术公司产品。主要仪器包括:美国产Sakura Rotary Microtome SRM-1切片机,PHY-III型病理组织烘漂处理仪由常州中威电子仪器公司生产,日本产OLYMPUSBH-2生物显微镜及OLYMPUS显微摄像仪。
1.3实验方法兔抗人LYVE-1多克隆抗体,应用免疫组织化学SP染色法,SP染色步骤参照试剂盒说明进行,标本常规石蜡包埋切片,60℃隔水式培养箱内烘片,二甲苯溶液、不同浓度乙醇溶液脱蜡水化,3%过氧化氢溶液室温下浸泡,柠檬酸缓冲液微波抗原修复LYVE-1,PBS洗涤。DAB显色,苏木素复染,脱水、透明、中性树脂封片,分别在200×和400×光镜下观察。用已知阳性切片作为阳性对照,用正常免疫血清代替一抗作阴性对照,PBS代替一抗作空白对照,同一条件下行SABC染色。
1.4微淋巴管密度(MLD)计数每张切片在盲法下由我院病理科2名资深医师分别计数,计数方法参照Williams[3]的MLD计数方法,LYVE-1染色阳性管腔数为MLD,取其两位医师计数结果的平均值,差别在10%以上则重新计数。

2 结果
2.1 LYVE-1在乳腺癌肿瘤边缘组织中的表达LYVE-1阳性表达于肿瘤边缘组织淋巴管内皮细胞,表现为淋巴管扩张明显,在肿瘤中心区实质部组织淋巴管则表达较少,多呈闭锁的条索状或隙状,而在肿瘤细胞及肿瘤血管内皮细胞中则表达呈阴性。见图1,2。
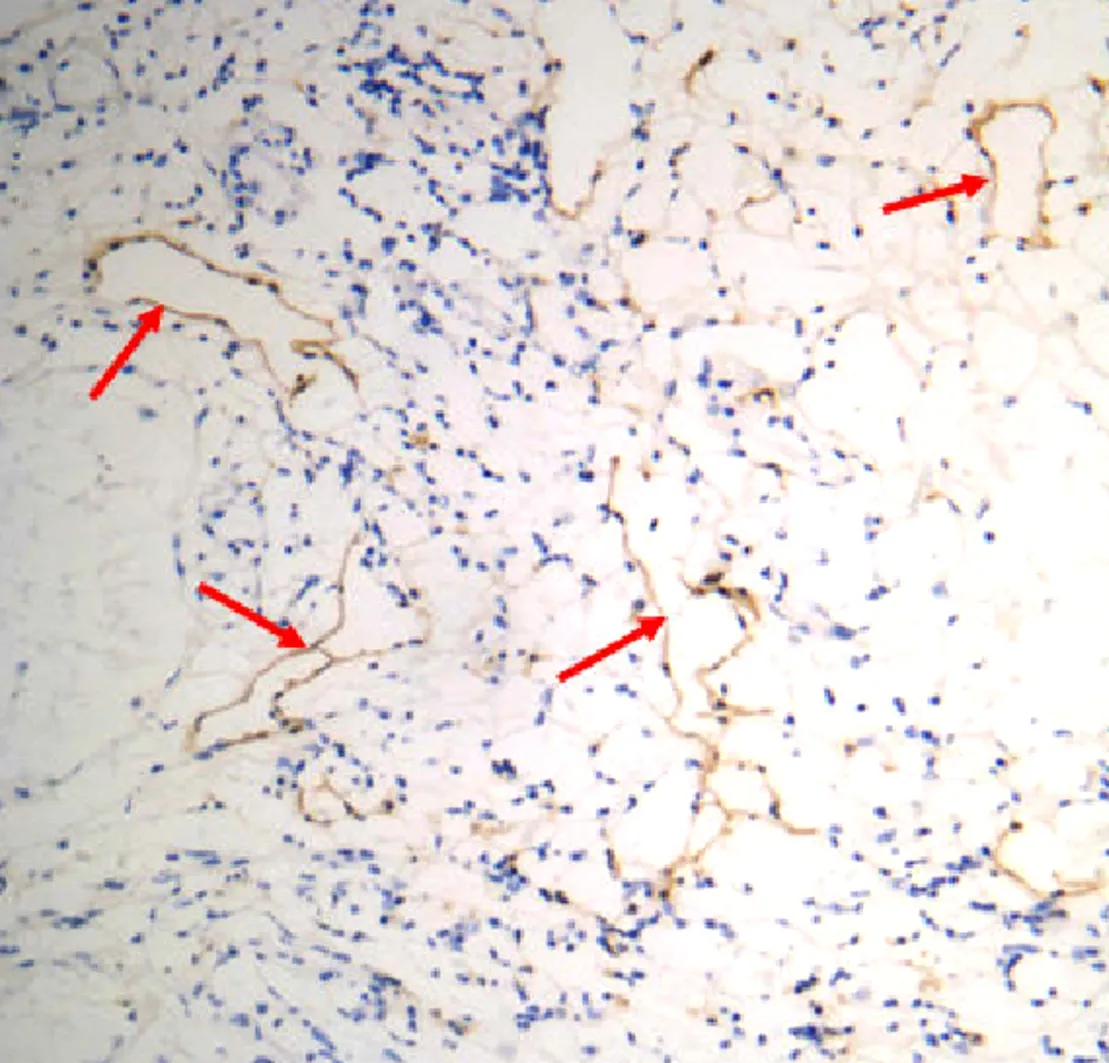
图1 乳腺癌肿瘤边缘组织LYVE-1阳性表达,管腔扩张(箭头所示)(200×)
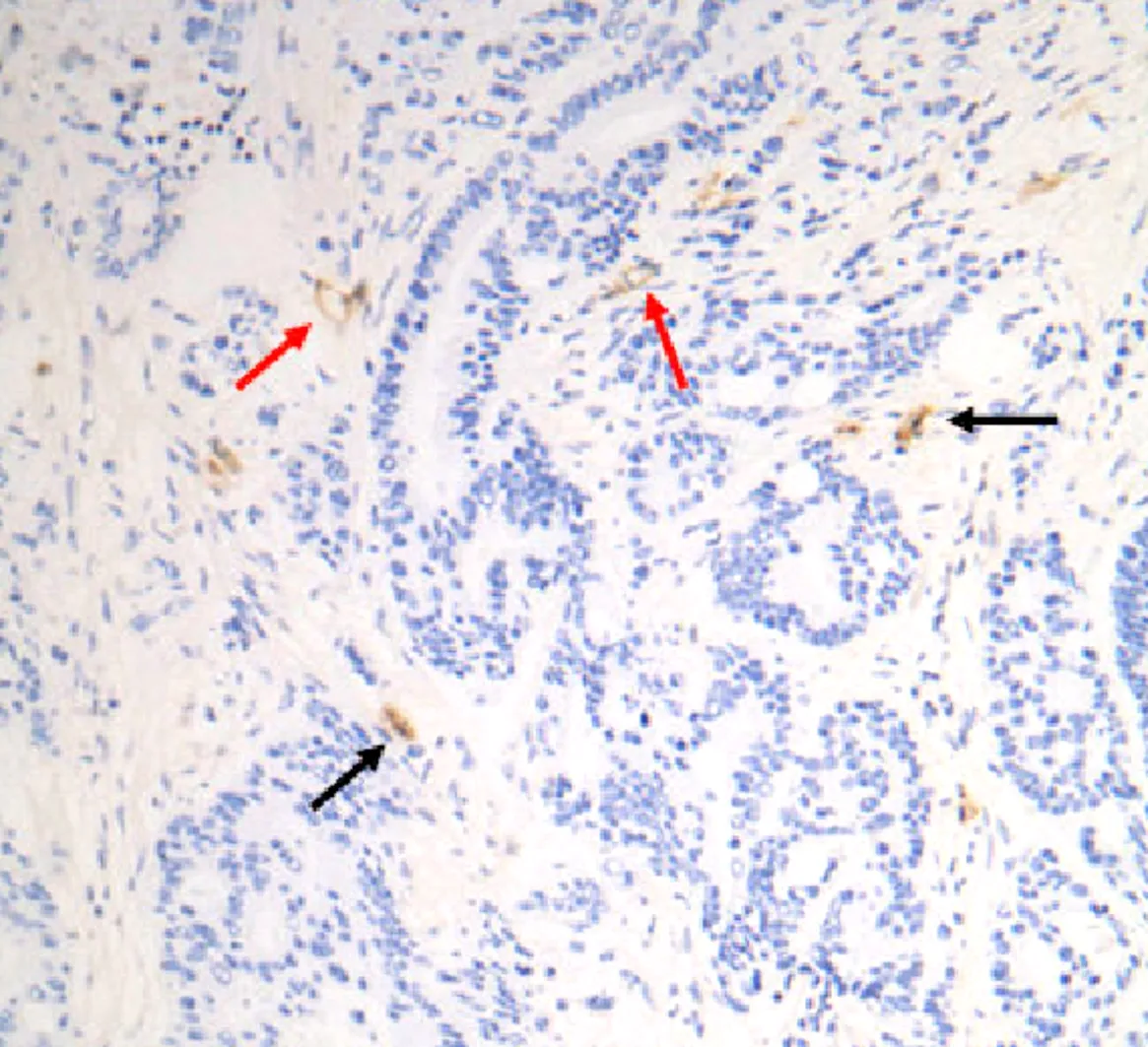
图2 乳腺癌肿瘤中心部组织LYVE-1阳性表达较少,淋巴管呈闭锁的条索状或隙状(200×)
2.2不同部位肿瘤组织与正常乳腺粘膜组织MLD比较54例乳腺癌肿瘤边缘和中心区MLD均值显著高于正常乳腺粘膜组织标本(P<0.05,P<0.01),乳腺癌肿瘤边缘组织MLD均值则明显高于肿瘤中心组织(P<0.05)。见表1。
2.3乳腺边缘部组织LYVE-1表达下MLD与临床参数相关性比较在乳腺肿瘤边缘部组织中,肿瘤直径≥4 cm MLD均值显著高于<4 cm时(P<0.05),发病部位的高位、中位和低位肿瘤组织MLD计数差异不明显(P>0.05)。组织分化程度分类的高分化、中等程度分化以及低分化肿瘤组织MLD计数差异不明显(P>0.05)。有淋巴结转移者MLD均值显著高于无转移者(P<0.01)。Dukes分期A~D期MLD均值逐渐升高,四期差异明显(P<0.05)。见表2。

表1 乳腺正常粘膜与乳腺癌组织MLD密度比较±s)
与正常组织比较#P<0.05,*P<0.01;与肿瘤中心比较▲P<0.05

表2 乳腺肿瘤边缘部组织MLD与临床参数相关性比较±s)
3 讨论
转移是恶性肿瘤重要的生物学特征,淋巴转移又是多数实体瘤转移播散的早期事件,是肿瘤细胞转移的重要途径[4],而是否存在淋巴结转移、转移的多少或远近是衡量恶性肿瘤患者预后的重要指标,因此检测肿瘤新生微淋巴管的浸润情况对了解肿瘤的生长转移、治疗以及预后有重要意义。淋巴管常多与血管相伴生长,且形态结构相似,目前有关肿瘤血管生成的研究报道较多,而受制于淋巴管内皮细胞特异性标识物,使得有关淋巴管生成的研究进展缓慢,近年来,血管内皮生长因子受体-3(VEGFR-3)、LYVE-1、肾小球足突细胞黏蛋白、同源异型盒基因转录因子-1 (Prox-1)及D2-40等淋巴管内皮细胞特异性标志物相继被发现,并可利用其特异性表达计数微淋巴管的密度,LYVE-1是Banerji于1999年发现的I型完整膜糖蛋白,为CD44糖蛋白的同系化合物,均匀分布于淋巴管内皮细胞,其cDNA序列编码322个氨基酸残基,并有21个残基的跨膜区和63个残基的胞浆区尾部[5]。LYVE-1可特异性地与淋巴管壁腔面的透明质酸(HA)受体结合,可能参与HA穿越淋巴管壁的运输。
本组结果显示,乳腺癌边缘部肿瘤组织淋巴管生成旺盛,表现为边缘部组织微淋巴管生成扩张明显,而肿瘤中心区实质部组织淋巴管则表达较少,多呈闭锁的条索状或隙状,其原因可能为在癌细胞生长所产生的高组织间隙压迫中心区淋巴管,导致中心区实质部淋巴管闭锁,而边缘部组织由于压力较小使得淋巴管数量明显增多,管腔多呈扩张状态,大量的连接开放形成较大的内皮细胞通道,癌细胞经过这些通道进入淋巴管,从而发生远处转移。本组结果还显示,乳腺癌肿瘤边缘区MLD均值与肿瘤大小、淋巴结是否转移以及Dukes分期有关,而与发病部位和分化程度无相关性,检测乳腺癌肿瘤组织中的MLD可作为评价肿瘤淋巴管发生及判断淋巴转移的一个指标。
[1] 李光明,段百芸.乳腺癌组织VEGF-D表达及淋巴管生成的临床意义探讨[J].中华肿瘤防治杂志, 2010,17(13):1004-1008.
[2] 郑飞,和钢,等.淋巴管内皮细胞透明质酸受体-1与乳腺癌淋巴管生成的研究进展[J].现代实用医学,2010,22(12):1417-1420.
[3] Arimoto J, Ikura Y, Suekane T, et al. Expression of LYVE-1 in sinusoidal endothelium is reduced in chronically inflamed human livers[J].J Gastroenterol,2009,12(21):1144-1149.
[4] Koch M, Dettori D, Van Nuffelen A,et al. VEGF-D deficiency in mice does not affect embryonic or postnatal lymphangiogenesis but reduces lymphatic metastasis[J].J Pathol, 2009, 219(3):356-364.
[5] Jain RK, Padera TP. Prevention and treatment of lymphatic metastasis by antilymphangiogenic therapy[J].J Natl Cancer Inst,2002,94(11):785-787.
