早期完全性水泡状胎块临床病理分析
2011-01-18潘地铃王行富吴荔香
潘地铃,王行富,马 宏,吴荔香
1.福建省妇幼保健院病理科(福建 福州 350001) 2.福建医科大学附属第一医院病理科(福建 福州 350004)
水泡状胎块的发生率在美国大约1/1000~2000次妊娠,但亚洲可能是北美发病率的7~10倍,经典的完全性水泡状胎块(complete moles,CM)通常发生在妊娠的第二个3月期间(平均为妊娠的14周)[1]。近年来随着妊娠早期超声的常规应用,许多CM在妊娠头3个月已经被发现,这些发生于妊娠12周内的CM被称为早期完全性水泡状胎块(early complete moles,ECM),其与经典的CM在组织病理学特征上有所差异,容易被误诊。本文对43例ECM进行临床病理特征分析,并复习相关文献。
1 资料与方法
1.1临床资料收集福建省妇幼保健院2008年1月至2011年3月诊断的43例ECM,年龄19~ 48岁,平均年龄29.4岁,妊娠6+1周~10+2周,平均妊娠8+1周。28例(65.1%)以阴道出血为首发症状,其余15例于B超检查时偶然发现。B超下表现为宫腔内无胚胎或无明显心脏活动,呈密度不均的回声信号,常可见多量大小不一的小囊泡。21例(48.8%)患者既往有流产史。43例患者中28例清宫前检测血清β-hCG为10 545.1~1 035 700 mIu/ml,平均195 995.2 mIu/ml。3例患者失访,其余40例随访3~24个月, 其中38例β-HCG分别经3~10周稳定下降至正常,另2例分别在β-hCG稳定下降(未降至正常)的第6周及第19周时出现β-hCG再次升高,肺部CT未见异常影像,即予住院行预防性化疗,均于8周后β-hCG稳定下降至正常,均未出现继发性滋养细胞疾病,其中4例分别在随访的第3、4、5和16个月后正常妊娠。
1.2方法所有标本均经过10%福尔马林固定、常规脱水、石蜡包埋、4 μm切片、苏木精-伊红(HE)染色、光镜观察。免疫组化(EnVision两步法)检测细胞周期抑制因子p57、内皮细胞标记物CD34、细胞增殖指数Ki67,试剂工作液购自福州迈新公司。
2 结果
2.1大体检查43例ECM中有26例的绒毛及蜕膜中可见散在性多发性小水泡,直径约0.3~1.0 cm,水泡壁薄透亮,内含清亮液体,水泡间夹杂凝血块。其余17例绒毛和蜕膜外观未见明显异常。43例均未见“葡萄串样”结构和胚胎成分。
2.2组织病理及免疫组化检查光镜下,肉眼可见多发小水泡者呈现绒毛增大水肿,部分伴中央水池形成;其余病例镜下绒毛较小、水肿不明显或轻度,个别水肿绒毛仍有中央水池形成。除水肿绒毛外,另有部分绒毛间质呈嗜碱性粘液样且富于细胞。多量的绒毛末端呈球茎状、指状,伴有环周分布的非典型性滋养细胞(图1A)。部分病例滋养细胞分布呈多灶状,甚至个别绒毛滋养细胞增生不明显。绝大多数病例胎盘种植部位滋养细胞伴非典型性增生(图1B)。绒毛间隙总能找到非典型性增生的滋养细胞。绒毛间质常可见到杂乱分布的核碎片和凋亡小体(图1C)。少量绒毛间质伴Hofbauer细胞局灶明显聚集,绒毛间质血管较同期正常胎盘组织减少,代之以大量迷路状的血管形成性细胞索,部分伴有血管腔形成(图1D)。p57在绒毛间质及细胞滋养细胞层阴性表达(图2), 绒毛外滋养细胞可阳性表达,ki67滋养细胞表达5%-50%。CD34绒毛间质血管内皮细胞表达阳性,呈分支状、迷路状。
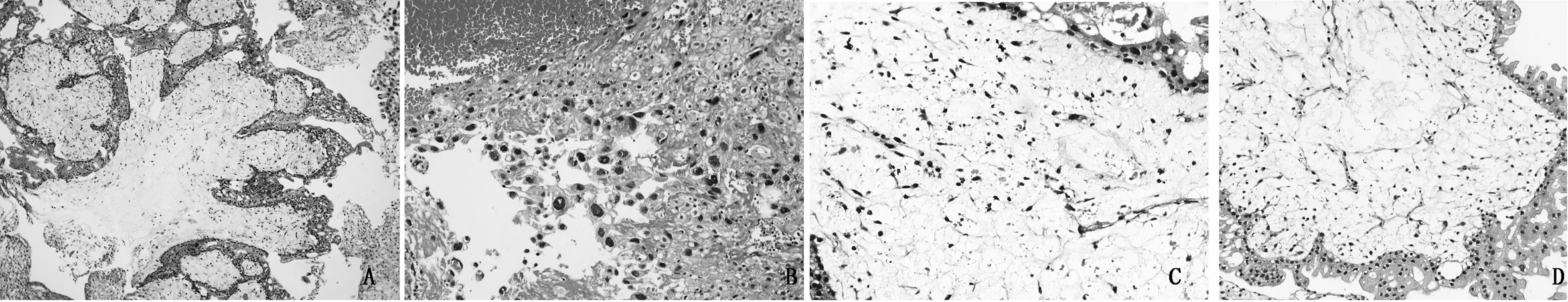
图1 ECM的组织学特征 (A)绒毛轻度水肿,指状的终末绒毛,绒毛间质富于细胞的嗜碱性粘液样改变(HE,100×);(B)绒毛间隙和胎盘种植部位滋养细胞增生伴非典型性(HE,200×);(C)绒毛间质可见杂乱分布的核碎片和凋亡小体(HE,200×);(D)轻微的多灶状滋养细胞增生及绒毛间质迷路状的血管形成性细胞索或未成熟的毛细血管(HE,200×)
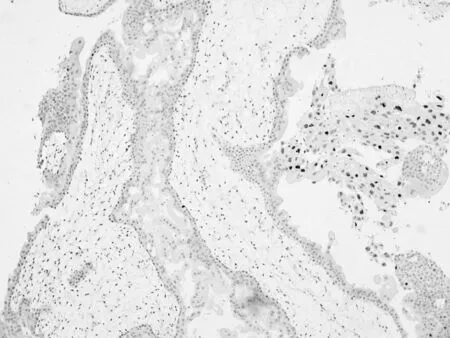
图2 ECM免疫组化p57在绒毛间质及细胞滋养细胞层阴性表达(EnVision法,DAB显色,100×)
3 讨论
3.1临床特征所有患者均发现于妊娠12周内,大部分患者以阴道出血为首发症状,经B超辅助检查并联合血清β-hCG水平测定后清宫诊疗。随着妊娠早期超声的常规应用,发现CM的时间提前,部分患者于B超检查时偶然发现,ECM的典型B超表现为宫腔内密度不均的回声信号,常可见多量大小不一的小囊泡,无胚胎或无可证明的心脏活动[2]。血清β-hCG明显升高[3],通常显著高于正常妊娠相应月份值,常超过100 000 mIu/ml,本文患者平均为195 995.2 mIu/ml。本研究发现约一半患者有既往流产史。
3.2组织病理学及免疫组化特征大体检查ECM标本中没有明显的胚胎成分,可见蜕膜和绒毛,部分可见肉眼容易辨认的小水泡。组织病理学检查发现ECM绒毛水肿不明显,或仅为显微镜下部分可见,散在绒毛可以见到中央水池形成,但这不是诊断ECM的必要特征[4]。指状的终末绒毛伴有绒毛间质细胞增生及环周滋养细胞花边样增生是ECM的较为独特的表现[5]。虽然滋养细胞环周增生伴非典型性是经典CM的特征性改变,但Kim等[6]研究发现半数以上的ECM绒毛缺乏滋养细胞增生或不明显,仅表现为沿着绒毛表面多灶状的合体滋养细胞轻度增生。然而胎盘种植部位的滋养细胞增生程度高于正常胎盘,且细胞学具有非典型性。此外绒毛间隙可见到成片多形性的滋养细胞增生,有时可引起间隙出血。
Kim等[6]研究还发现ECM绒毛间质血管明显减少或几乎未见成熟的血管腔,仅见残存的迷路状血管形成性细胞索。另有学者[7]研究发现ECM中Hofbauer细胞数量比正常同期胎盘中减少,认为可能与ECM的血管成熟障碍有关。嗜碱性粘液样绒毛间质是ECM的重要特征之一,PAS 胶体铁染色呈蓝色。多量的间质核碎片亦是ECM的重要特征之一,Kim等[6]证实ECM的间质细胞凋亡率明显高于早期部分性水泡状胎块(early partial moles,EPM)和正常早期胎盘,随后的学者研究得到相似的结果,发现ECM间质细胞核碎裂和凋亡百分率显著高于正常早期胎盘[7]。
除了以上明显的特征之外,ECM偶可见到间质的巨噬细胞、羊膜、有核红细胞及卵黄囊成分,上述成分在经典的CM中几乎很难遇到,有研究者提出伴有这些成分的ECM与经典的CM预后相同[8]。
父系印迹基因p57Kip2位于染色体11p15.5,编码周期素依赖性蛋白激酶抑制剂CDKN1C,已证实p57在正常胎盘和部分性水泡状胎块中高表达而在CM的细胞滋养层及间质细胞中表达缺失或明显减少,并且其表达缺失情况不受孕龄影响[9]。另有研究发现细胞周期相关蛋白E2F-1和cyclinE在水泡状胎块组织中表达上调[10]。而细胞增殖指数Ki67表达变异较大,无明显诊断鉴别意义[11]。
3.3遗传学特征遗传学分析显示CM呈二倍体46,XX 或46,XY核型。大多数CM的46条染色体系来源于父系,通过单精自我复制并与缺乏母体原核的“空卵”受精形成单精受精卵;约20%的CM系来源于双精子与“空卵”受精;罕见情况下CM来源于双亲或父系单精,但前者发生持续滋养细胞疾病的风险非常高,并认为与家族性CM有关。更为罕见的三倍体或四倍体CM以及四倍体部分性水泡状胎块(partial moles,PM)也有个别报道[12]。
3.4鉴别诊断ECM常没有传统CM的特征性具有中央水池形成的水肿绒毛,有时可与水肿性流产胎盘和早期部分性水泡状胎块混淆。临床病理诊断需与后两者进行鉴别。(1)水肿性流产胎盘(Hydropic abortion,HA):相比ECM球茎状或指状凸起的终末绒毛,HA表现为较一致的圆形或卵圆形绒毛,绒毛及绒毛间质均出现水肿,但没有中央水池的形成;缺乏ECM中较为特异性的间质核碎片;绒毛血管也可缺乏或塌陷,但常可见有核红细胞,滋养细胞具有明显的极性分布,缺乏滋养细胞假包涵体;胚胎或羊膜成分无明显异常,种植部位也无显著病变[13]。(2)早期部分性水泡状胎块:EPM绒毛呈多样性的扇贝状或海湾状内陷,绒毛间质常可见纤维化;绒毛水肿多样性,可能局灶形成中央水池;缺乏间质核碎片;绒毛血管和有核红细胞均存在;滋养细胞增生并常见假包涵体;胚胎或羊膜成分一般存在,种植部位细胞异型不如ECM显著,常表现为轻度异型。目前利用免疫组化检测p57是鉴别CM和PM的有效指标[9]。另外,绝大多数PM系单卵双精受精形成的三倍体,亦可利用DNA流式细胞计量术评估倍体以区别CM和PM[14]。
3.5治疗及预后ECM患者首选的治疗方法是及早完全排空水泡状胎块,监测血清β-hCG水平,并同时避孕6个月至一年或直到β-hCG降至正常范围为止,根据监测结果评估其发生滋养细胞肿瘤的风险。Fower等[15]研究示孕早期超声的广泛应用使发现CM的时间明显提前,且β-hCG下降时间由原来的25周明显缩短至19周,但发生滋养细胞肿瘤的风险并没有明显降低。另有研究认为ECM滋养细胞的非典型性及增生程度与化疗必要性呈正相关,但并不与滋养细胞肿瘤的发生呈正相关,与CM的生物学行为并不一致[16]。Sebire等[11]还认为间质细胞凋亡指数可作为葡萄胎临床进展的相关预后指标之一。
[1] Marisa RN,Esther O.Gynecologic pathology[M].Elsevier Inc.,2009:645.
[2] Kirk E,Papageorghiou AT, Condous G,et el.The accuracy of first trimester ultrasound in the diagnosis of hydatidiform mole[J].Ultrasound Obstet Gynecol,2007,29:70-75.
[3] Kerkmeijer LW,Massuger L,Ten Kate-Booij MJ,et el.Earlier diagnosis and serum human chorionic gonadotropin regression in complete hydatidiform moles[J].Obstet Gynecol,2009,113: 326-331.
[4] Sebire NJ.Updated diagnostic criteria for partial and complete hydatidiform moles in early pregnancy[J].Anticancer Res,2003,23:1723-1728.
[5] Keep D,Zaragoza MV,Hassold T,et el.Very early complete hydatidiform mole[J].Hum Pathol,1996,27:708-713.
[6] Kim MJ, Kim KR, Ro JY, et el. Diagnostic and pathogenetic significance of increased stromal apoptosis and incomplete vasculogenesis in complete hydatidiform moles in very early pregnancy periods[J].Am J Surg Pathol,2006,30:362-369.
[7] Kim KR, Park BH, Hong YO,et el.The villous stromal constituents of complete hydatidiform mole differ histologically in very early pregnancy from the normally developing placenta[J].Am J Surg Pathol,2009,33:176-185.
[8] Paradinas FJ, Fisher RA,Browne P,et el.Diploid hydatidiform moles with fetal red blood cells in molar villi.1-Pathology, incidence, and prognosis[J].J Pathol,1997,181:183-188.
[9] McConnell TG, Murphy KM,Hafez M,et el.Diagnosis and subclassification of hydatidiform moles using p57 immunohistochemistry and molecular genotyping: validation and prospective analysis in routine and consultation practice settings with development of an algorithmic approach[J].Am J Surg Pathol, 2009,33:805-817.
[10] Fukunaga M. Immunohistochemical characterization of cyclin E and p27KIP1 expression in early hydatidiform moles[J]. Int J Gynecol Pathol,2004,23:259-264.
[11] Sebire NJ, Seckl MJ.Immunohistochemical staining for diagnosis and prognostic assessment of hydatidiform moles:current evidence and future directions[J].J Reprod Med,2010,55: 236-246.
[12] Dube V.Androgenetic complete mole with trisomy 13:report of a case with microsatellite genotyping and review of the literature[J].Pathol Res Pract,2010,206:776-781.
[13] Landolsi H.Assessment of the role of histopathology and DNA image analysis in the diagnosis of molar and non-molar abortion: a study of 89 cases in the center of Tunisia[J]. Pathol Res Pract, 2009,205:789-796.
[14] Folkins A.Utility of chromosomal chromogenic in situ hybridization as an alternative to flow cytometry and cytogenetics in the diagnosis of early partial hydatidiform moles: a validation study[J].J Reprod Med,2010,55:275-278.
[15] Fowler DJ, Lindsay I,Seckl MJ,et el.Histomorphometric features of hydatidiform moles in early pregnancy: relationship to detectability by ultrasound examination[J].Ultrasound Obstet Gynecol,2007,29:76-80.
[16] Hancock BW,Tidy JA.Current management of molar pregnancy[J].J Reprod Med,2002,47:347-354.
