肺癌恶性胸水中CD4+CD25+Foxp3+调节性T细胞检测及其临床意义
2011-01-18孟星君
曾 刚,李 威,孟星君
1.南京医科大学附属苏州医院呼吸科(江苏 苏州 215006) 2.苏州市立医院肿瘤诊疗中心肿瘤实验室(江苏 苏州 215006)
CD4+CD25+Foxp3+调节性T细胞(CD4+CD25+Foxp3+Treg, Foxp3+Treg)是近年来确定的一类具有免疫调节功能的T细胞亚群,在维持机体免疫自稳、调控免疫应答方面起重要作用。在病理情况下,Foxp3+Treg的增加可以促进肿瘤的生长,抑制抗肿瘤免疫效应。本研究通过检测26例晚期肺癌外周血及胸水中Foxp3+Treg及相关细胞因子的表达情况,同时探讨其临床意义。
1 材料与方法
1.1 材料
1.1.1 临床标本采集 选取2008年3月~2010年3月苏州市立医院呼吸内科收治的26例晚期肺癌患者外周血及胸水作为研究对象。并抽取10例健康志愿者外周血作为对照。所有肺癌患者均经胸水找脱落细胞、支气管镜或胸膜活检等病理诊断证实,患者入组前均未行放疗或化疗。26例肺癌患者中男性15例,女性11例,年龄(44~75)岁,平均年龄(60±4.6)岁。其中8例确诊时已有远处脏器转移。
1.1.2 主要试剂和仪器 淋巴细胞分离液(Ficoll)购自上海生化试剂二厂;Human Regulatory T cell Staining Kit(PE-CD4、FITC-CD25、APC-CD25)购自eBioscience公司;IL-10酶联免疫反应(ELISA)试剂盒购自美国invitrogen公司,FACS Calibur流式细胞仪为BD公司产品。
1.2 方法
1.2.1 外周血及胸水中淋巴细胞悬液制备 抽取肝素抗凝的胸水50~100 ml,2000 r/min离心10 min,上清-80℃冻存备用,沉淀细胞用PBS调整浓度至1×107/ml,缓缓加入装有底层100%(比重1.077)、中间层75%(比重1.055)的淋巴细胞分离液(ficoll)上,经1800 r/min离心20 min,吸取100%液面上的薄层即为富含T细胞的群体。肝素抗凝的外周静脉血4 ml,加入等量PBS稀释后以上述密度梯度离心法分离制备淋巴细胞悬液。所得细胞经缓冲液洗涤后备用。
1.2.2 流式细胞术检测外周血及胸水中Foxp3+Treg 调整已制备的单个细胞悬液为每管1×106/ml,加缓冲液后1500 r/min洗涤两次,按照试剂盒说明分别加入破膜剂、PE-CD4、FITC-CD25、APC-CD25单抗及同型对照IgG,经孵育及缓冲液充分洗涤后进行流式细胞仪三色检测,WinMDI 2.9软件分析并作图。
1.2.3 ELISA检测外周血及胸水上清中IL-10含量 抽取肿瘤患者组与正常对照组外周静脉血各2 ml,分离血清采用定量ELISA法进行检测,操作步骤严格按其试剂盒内的说明书进行。胸水上清检测方法同上。
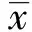
2 结果
2.1肺癌患者外周血和恶性胸水中Foxp3+Treg的比例健康志愿者、肺癌患者外周血和恶性胸水中均可检测到Foxp3+Treg, 其与CD4+T细胞比例分别为(7.4±2.1)%、(9.7±4.0)%和(14.7±5.3)%。三者之间差异有统计学意义(P<0.05)。
2.2肺癌患者外周血和胸水中IL-10的含量结果显示对照组、肺癌患者外周血及胸水上清中IL-10含量分别为(8.0±2.63 )pg/ml、(10.05 ±2.68 )pg/ml和(28.71 ±10.39 )pg/ml,三者之间差异有统计学意义(P<0.05),见图1。
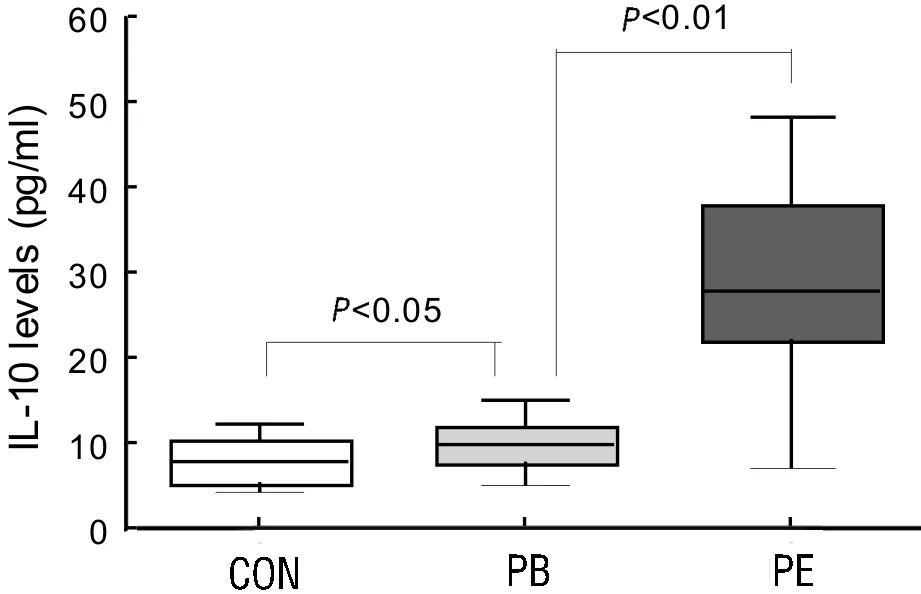
图1 正常对照组、肺癌组血清及胸水上清IL-10含量±s)
2.3肺癌患者外周血和胸水中Foxp3+Treg比例和IL-10含量的相关性肺癌患者恶性胸水中Foxp3+Treg比例和胸水上清中IL-10含量呈正相关,相关系数为0.41(P<0.05)。见图2。
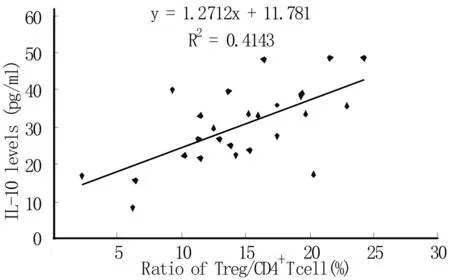
图2 肺癌患者胸水中Foxp3+Treg比例和IL-10含量的相关性
2.4胸水Foxp3+Treg比例、IL-10含量与肺癌临床病理参数的关系有远处转移(Ⅳ期)肺癌患者胸水中Foxp3+Treg比例为(17.67±5.55)%,无远处脏器转移患者(ⅢB)胸水中Foxp3+Treg比例为(13.30±3.31)% ,二者相比差异有统计学意义(P<0.05),提示有远处脏器转移的肺癌患者胸水中Foxp3+Treg比例增加,见图3。
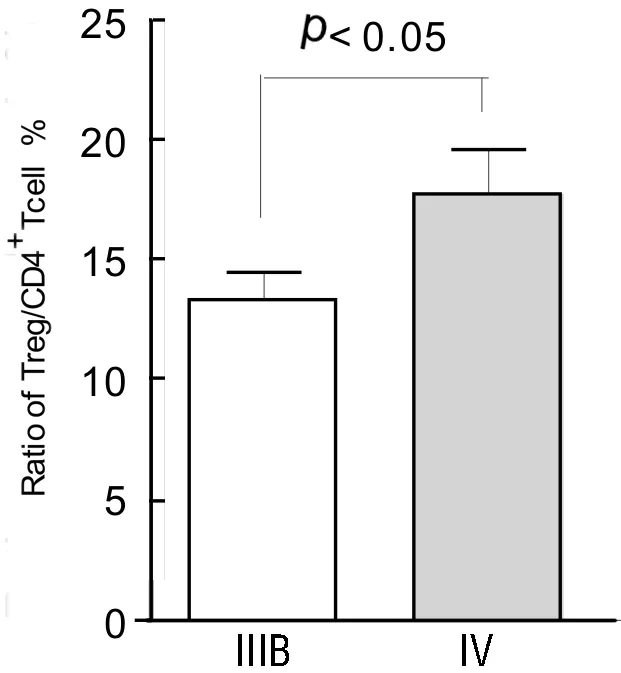
图3 胸水Foxp3+Treg比例与肺癌分期和PS评分之间的关系
3 讨论
机体的免疫力低下是导致肿瘤细胞逃避免疫监视和疾病进展的一个重要因素。其中调节性T细胞由于具有的免疫无能性和免疫抑制性而引起广泛的关注。CD4+CD25+Foxp3+调节性T细胞属于调节性T细胞的一个亚群,以表达叉头状转录因子 (Forkhead box P3,Foxp3)为主要特征[1-2],并以此区别于表达CD25(IL-2R)活化的CD4+T细胞。
有报道指出,肺癌患者体内可出现Foxp3+Treg的数量增加,并且Foxp3+Treg数量的增加可能和肿瘤细胞的负荷有关[3-5]。也有些学者将此解释为肿瘤通过分泌细胞因子诱导了Foxp3+Treg的增殖,或Foxp3+Treg对肿瘤抗原刺激的生理性增殖,Foxp3+Treg数量的增加降低了机体的免疫调节功能、促进局部肿瘤的生长并参与了肿瘤的全身进展[6]。本研究发现,晚期肺癌患者外周血及恶性胸水中Foxp3+Treg数量较健康志愿者均有所增加,胸水中Foxp3+Treg比例增加最为明显,提示晚期肺癌患者体内存在Foxp3+Treg的过度增殖,而恶性胸水可能因存在大量的肿瘤细胞诱导了更多的Foxp3+Treg的生成。
体外实验证实,Foxp3+Treg主要通过细胞间直接接触的方式而抑制效应T细胞的增殖和杀伤功能,其中TGF-β和IL-10在Foxp3+Treg发挥抑制效应过程中起着重要作用[7]。有学者证明,Foxp3+Treg可通过自分泌及诱导Th2细胞产生TGF-β和IL-10而抑制肿瘤患者体内CD8+T细胞和自然杀伤细胞(NK)的数量和功能[8-9]。Matthew等[10]发现IL-10和TGF-β还可以诱导CD4+CD25-T细胞成为具有免疫抑制功能的Foxp3+Treg,从而造成肿瘤免疫抑制的恶性循环。最近还有试验证实TGF-β在促进Foxp3+Treg细胞持续表达转录因子Foxp3、维持外周Foxp3+Treg的数量和功能的过程中有着不可替代的作用[11-12]。
IL-10属于Th2型细胞因子,是反映机体免疫抑制状态的两种重要因子之一。本研究发现,肺癌患者外周血及胸水上清中IL-10含量较对照组明显增加。进一步分析提示,胸水中上述细胞因子含量和Foxp3+Treg比例存在明显的相关性,提示IL-10和Foxp3+Treg之间相互作用,共同参与了肺癌的疾病过程。研究同时发现,肺癌患者外周血中Foxp3+Treg比例和血清中IL-10无相关性,推测晚期肺癌的全身免疫状态除了和Foxp3+Treg有关,还存在着其他的影响因素,而恶性胸水作为相对典型的肿瘤微环境能够更加早期和客观反映Foxp3+Treg和免疫相关的细胞因子之间的关系。
Rich等[13]曾报道血清中转化生长因子及白介素家族表达水平和包括肺癌在内的多种转移瘤患者体力状态评分和生活质量密切相关。Martin等[14]的研究表明外周血IL-6和IFN-γ水平可作为肺癌患者预后的独立因素,提示Foxp3+Treg还可能通过影响其他细胞因子的水平参与了肺癌患者的疾病进程。Christina等[15]发现,在早期非小细胞肺癌患者外周血中即出现Foxp3+Treg的增加,而Edward等[16]从肺癌组织中成功分离到肿瘤浸润的Foxp3+Treg,并在体外证实这种分离得到的Foxp3+Treg可显著抑制自体外周血淋巴细胞的增殖。上述研究证实了Foxp3+Treg与肺癌的发生发展密切相关。至今为止,Foxp3+Treg抑制机体免疫反应的具体机制尚未完全明确,但动物实验已经证实,去除小鼠体内的Foxp3+Treg可以明显提高疫苗治疗种植瘤的效果[17]。因此,进一步研究Foxp3+Treg功能可能会为肺癌患者的免疫治疗提供新的思路。
[1] Khattri R,Cox T,Yasayko S,et al.An essential role for Scurfin in CD4+CD25+T regulatory cells[J].Nat Immunol,2003,4(4):337-342.
[2] Shohei Hori, Takashi Nomura, and Shimon Sakaguchi. Control of Regulatory T Cell Development by the Transcription Factor Foxp3[J].Science,2003,299:1057.
[3] Wolf A, Wolf D, Steurer M, et al. Increase of regulatory T Cells in the peripheral blood of cancer patients[J].Clin Cancer Res,2008,9:606-612.
[4] Yi-Qiang Chen, Huan-Zhong Shi, Xue-Jun Qin, et al. CD4+CD25+Regulatory T lymphocytes in malignant pleural effusion[J].Am J Resp Crit Care Med,2005,172:1434-1439.
[5] Okita R, Saeki T, Takashima S, et al. CD4+CD25+regulatory T cells in the peripheral blood of patients with breast cancer and non-small cell lung cancer[J].Oncol Rep,2005,14:1269-1273.
[6] Yi-Qiang Chen, Huan-Zhong Shi, Xue-Jun Qin, et al. CD4+CD25+Regulatory T lymphocytes in malignant pleural effusion[J].Am J Resp Crit Care Med,2005,172:1434-1439.
[7] Okita R, Saeki T, Takashima S, et al. CD4+CD25+regulatory T cells in the peripheral blood of patients with breast cancer and non-small cell lung cancer[J].Oncol Rep,2005,14:1269-1273.
[8] Liyanage U, Moore T, Jo H, et al.Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma[J].Immunol,2010,169:2756-2761.
[9] Nakamura K,Kitani A,Strober W,et al.Cell contact-dependent immuno- suppression by CD4(+)CD25(+) regulatory T cells is mediated by cell surface- bound transforming growth factor beta[J].Exp Med,2001,194:629-644.
[10] Jarnicki A, Lysaght J,Todryk S,et al.Suppression of antitumor immunity by IL-10 and TGF- beta- producing T cells infiltrating the growing tumor: influence of tumor environment on the induction of CD4+and CD8+regulatory T cells[J].Immunol,2006,177:896-904.
[11] Julien C,John J,Marc G.TGF-1 maintains suppressor function and Foxp3 expression in CD4+CD25+regulatory T cells[J].Exp Med,2005,201:1061-1067.
[12] Christoph S, Samuel H, Martina P,TGF regulates the CD4+CD25+T-cell pool and the expression of Foxp3 in vivo[J].Immunol,2009,16:1241-1249.
[13] Rich T, Innominato P, Mormont M,et al.Performance status, global quality of life, fatigue, and appetite loss are correlated with serum TGFa and IL-6 in patients with metastatic colorectal cancer (MCC)[J].ASCO Meeting Abstracts,2004,22:8024.
[14] F Martin, F Santolaria, N Batista,et al. Cytokine levels (IL-6 and IFN-gamma), acute phase response and nutritional status as prognostic factors in lung cancer[J].Cytokine,1999,11(1):80-86.
[15] Christina S,Theresa J,Katia S,et al. Regulatory CD4+CD25+T Cells in Tumors from Patients with Early-Stage Non-Small Cell Lung Cancer and Late-Stage Ovarian Cancer[J].cancer research,2007,61(15):4766-4772.
[16] E dward Y,Heidi Y,Christina S,et al.Cutting Edge:Regulatory T Cells from Lung Cancer Patients Directly Inhibit Autologous T Cell Proliferation[J].Immunol,2002,168:4272-4276.
[17] Sutmuller R,Duivenvoorde A,Elsas T,et al.Synergism of cytotoxic T lymphocyte-associated antigen 4 blockade and depletion of CD25+regulatory T cells in antitumor therapy reveals alternative pathways for suppression of autoreactive cytotoxic T lymphocyte responses[J].Exp Med,2008,194:823.
