脉冲场凝胶电泳实验中的问题及解决方案
2011-01-15陈秋芳焦浈押辉远
陈秋芳,焦浈,押辉远
(1.郑州大学离子束生物工程重点实验室,河南郑州 450052;2.洛阳师范学院,河南洛阳 471022)
脉冲场凝胶电泳实验中的问题及解决方案
陈秋芳1,焦浈1,押辉远2
(1.郑州大学离子束生物工程重点实验室,河南郑州 450052;2.洛阳师范学院,河南洛阳 471022)
脉冲场凝胶电泳是分离大分子DNA片段的有效方法.就脉冲场凝胶实验中遇到的问题及解决方法进行了探讨,在充分理解实验原理的基础上对脉冲场凝胶电泳的实验条件进行优化,最终达到利用脉冲场凝胶电泳得到大分子DNA片段清晰整齐电泳条带的实验效果,为后续实验奠定了基础.
脉冲电泳;大分子DNA;条件优化
脉冲凝胶电泳(pulsed field gelelectrophoresis,PFGE)是近年来发展起来的一种分离大片段DNA的电泳技术,在现代分子生物学研究中得到了广泛的应用[1-3].普通的琼脂糖凝胶电泳是借助琼脂糖凝胶的分子筛作用,核酸片段因其分子量或分子形状不同,电泳移动速度有差异而分离,然而这项技术只能分离15~20 kb以下的小分子DNA以及质粒DNA分子,更大的DNA分离用普通琼脂糖凝胶电泳无法达到分离的目的,从而限制了染色体DNA的分离、生物物种鉴定、微生物基因分型、人类染色体内切酶物理图谱分析等方面的研究.1984年,Schwartz和Centor发明了脉冲场凝胶电泳技术,并成功实现了酿酒酵母菌细胞16条染色体DNA的分离[4].目前PEGE技术可以分离1~10Mb的DNA片段,为真核生物染色体DNA或大片段DNA的研究提供了新的工具,已经在生物物种的鉴定、核型分析以及生物基因组结构的研究方面的到广泛应用[5-7].本文简述了PEGE的原理,并在实验教学时引导学生优化了利用PFGE分离小麦BAC质粒限制性酶切片段的实验方法,为进行下一步的Southern杂交实验、达到进行更加精细的遗传图谱分析以及同源性检查的实验目的奠定基础.
1 PEGE的原理
琼脂糖凝胶电泳利用DNA分子在泳动时的电荷效应和分子筛效应可以分离20 kb以下的DNA分子片段.大于20 kb的线性DNA双链片段,在电场作用下通过孔径小于分子大小的凝胶时,将会改变无规卷曲的构象,沿电场方向伸直,与电场平行从而才能通过凝胶.此时,大分子通过凝胶的方式相同,迁移率无差别,不能分离.PFGE采用了两个交变电场,即两个电场交替的开启和关闭,当某一电场开启时, DNA分子即顺着此电场的方向拉长和延展,以“爬行”的方式穿过凝胶孔.如果电场方向改变,DNA分子必须先掉转头来,才能沿着新的电场方向泳动.较小的分子位移的时间相对减少,较大的分子则需要较多的时间来改变方向,从而将不同大小的分子分开.人们用稀有位点的限制性内切酶对细菌的染色体DNA进行消化,得到较大的片段,然后进行PFGE电泳,可将不同大小DNA片段分开,稳定性好,分辨率高.
2 PEGE的应用及实验条件优化
2.1 实验材料与方法
2.1.1 实验材料 从小麦品种小偃54构建的DNA BAC文库筛选到的特定基因的BAC克隆,编号为838-5-3,907-5-16,907-7-15,1257-1-11,1258-1-16.
2.1.2 实验仪器 美国伯乐公司(BIO-RAD)的CHEF-DRⅢ脉冲电泳仪(Richmond,California).Marker为λHindⅢ.质粒提取采用溶液Ⅰ、Ⅱ、Ⅲ和Qiagene的质粒提取试剂盒两种方法提取.
2.1.3 实验方法 取适量的BACDNA及限制性内切酶(1μg BACDNA,3单位限制性内切酶),在适宜温度培养3~4 h.限制性内切酶BamHⅠ和NotⅠ购自大连宝生物.取适量酶切后的BAC质粒DNA在脉冲电泳仪中电泳,将DNA酶切产物电泳琼脂糖凝胶置于EB中染色20min,蒸馏水清洗10~15min.在凝胶成像系统下扫描,存图.
2.2 实验条件优化
2.2.1 质粒提取 从节约成本的角度出发,首先用溶液Ⅰ、Ⅱ、Ⅲ提取的质粒,经过酶切后(30μL体系),全部点样,脉冲电泳后没有条带,可能用这种方法提取的质粒纯度较低,酶切量少.然后用Qiagene的质粒提取试剂盒提取质粒,纯度高较高(见图1),适宜用于下一步的酶切及电泳分离.
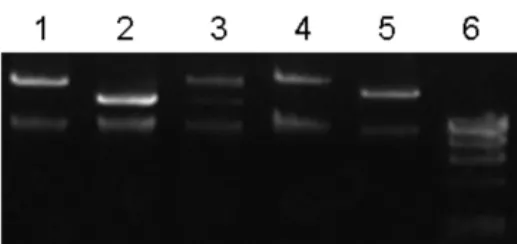
图1 试剂盒提取的BAC质粒电泳照片
2.2.2 脉冲电泳实验条件优化 选用BamHⅠ对于提取的5个BAC克隆质粒进行酶切,根据詹勇华等的电泳条件[8],实验开始采用的脉冲电泳条件是:16 h,1%琼脂糖凝胶,0.5×TBE,温度14℃,电场夹角120°,起始脉冲时间5 s,终止脉冲时间15 s,电压6 V/cm.图2 A显示了这些BAC克隆酶切后脉冲电泳的效果.从图2A可以看出,脉冲电泳的酶切条带有些弯曲,条带分离得不好,而且不够清晰.为此,实验调整了脉冲电泳的电场强度,从6 V/cm降为5 V/cm,时间从16 h缩短到12 h,其他条件不变,再次对酶切产物进行脉冲场凝胶电泳分离(图2 B),从图2可以看出,用5 V/cm的脉冲场电场可以获得清晰的电泳分离条带,为下一步的Southern杂交实验奠定了基础.

图2 小麦5个BAC克隆质粒的BamHⅠ酶切脉冲电泳照片
为了进一步验证实验方法的可靠性,选用NotⅠ酶切筛选到的5个BAC质粒,用优化后的方法进行脉冲电泳分离,同样可以得到清晰的电泳条带(见图3).因此,经过优化后的脉冲实验条件是:12 h,1%琼脂糖凝胶,0.5×TBE,温度14℃,电场夹角120°,起始脉冲时间5 s,终止脉冲时间15 s,电压5 V/cm.这样的脉冲实验条件可以很好地分离小麦BAC质粒的酶切片段.
3 讨论
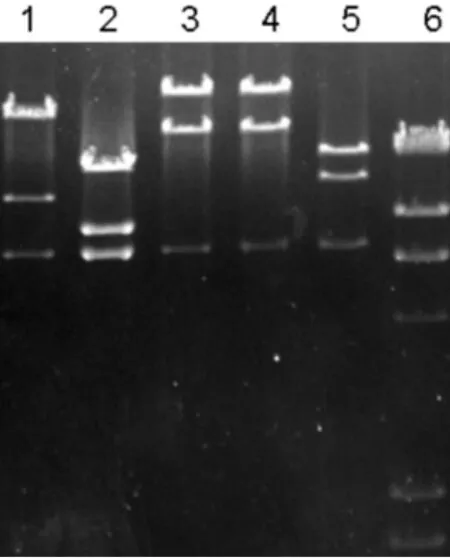
图3 小麦5个BAC克隆质粒的NotⅠ酶切脉冲电泳照片
PFGE作为一种有效的分离大片段DNA的电泳方法在现代分子生物学研究中得到了广泛的应用.因此如何掌握这门实验技能,以及根据脉冲电泳的实验原理解决实验过程中遇到的问题至关重要.笔者认为在脉冲电泳实验中应该注意一下几个方面的问题:
(1)配制琼脂糖胶时,可以根据需要分离的DNA片段的大小来调节琼脂糖胶的浓度;在倒完琼脂糖胶后用75%的酒精喷胶面,可以防止胶面有气泡.
(2)定时更换新的缓冲溶液,更换缓冲溶液要时尽可能小心不要碰坏琼脂凝胶.
(3)确保电泳槽是水平的.如果不水平,调整槽底部的旋钮,注意不要触碰电极.
(4)电泳开始前,打开主机和泵的开关,确保电泳缓冲溶液在冷却泵的作用下在管道中正常循环流动,等电泳缓冲溶液温度降到设定的14℃再把点样后的琼脂糖凝胶放进电泳槽中电泳.
(5)较低的脉冲电场电压能够产生较整齐的条带,可以根据需要分离的DNA分子大小来适当调节电场强度,大的DNA分子需要较低的电场强度.
(6)脉冲电泳时间根据所需分离的DNA分子大小确定.
总之,分离较大的DNA分子需要较小的琼脂糖胶浓度、较长的转换时间、较低的电场强度、较低的电场角度、较长的电泳运行时间,较低的缓冲溶液温度可以得到较为清晰的电泳条带,学生只有彻底理解脉冲电泳的实验原理,才能在实验过程中就遇到的问题提出切实可行的解决策略和实验方案.
[1]Kato H,Kato N,Watanabe K,et al.Application of typing by pulsed-field gelelectrophoresis to the study ofClostridium difficilein aneonatal intensive careunit[J].JClin Microbiol,1994,32:2067-2070.
[2]Davis A,Hancock D D,Besser TE,et al.Evaluation of pulsed field gel electrophoresis as a tool for determining the degree of genetic relatednessbetween stainsofEscherichia coliO157:H7[J].JClin Microbol,2003,41(5):1843-1849.
[3]Yin LF,Luo CX,KusabaM,et al.Analysisof theabnormalsegregation ofpathogenicity inMagnaporthe grise aby usinga genetic crossofOryzaandEleusineisolates[J].AgriculturalSciences in China,2010,9(3):383-391.
[4]Schwartz D C,Cantor C R.Separation of yeast chromosome-sized DNAs by pulsed field gradient gel electrophoresis[J].Cell, 1984,37(1):67-75.
[5]Talbot N J,Oliver R P,Coddington A.Pulsed field gel electrophoresis reveals chromosome length differences between strains ofCladosporium fulvum(syn.Fulvia fulva)[J].MolGen Genet,1991,229:267-272.
[6]Orbach M J,Chum ley F G,Valent B.Electrophoretic karyotypes ofMagnaporthe griseapathogens of diverse grasses[J].Mol Plant-Microbe Interact,1996,9:261-271.
[7]付晓燕,胡克兴,范黎.脉冲场凝胶电泳技术及其在真菌学研究中的应用[J].微生物学通报,2006,33(1):144-147.
[8]詹勇华,陈创夫,高剑锋,等.脉冲场凝胶电泳在BAC文库插入片段分析中的应用[J].内蒙古农业科技,2006(2):32-33.
Discussion on the problem s and countermeasures in the pulsed field gel electrophoresis experiment
Chen Qiufang1,Jiao Zhen1,Ya Huiyuan2
(1.Henan ProvincialKey Laboratory of Ion Beam Bio-engineering,Zhengzhou University, Zhengzhou 450052,China;2.College of Life Sciences Luoyang,NormalUniversity,Luoyang 471022,China)
Pulsed field gel electrophoresis(PFGE)is an effective technique of gel electrophoresis which can be used to separate large DNA.This paper discusses the solutions to the problems encountered in the process of pulsed field gel electrophoresis experimental teaching.The pulsed field gel electrophoresis experiment parameters are optimized on the basis of fully understanding the principle of PFGE.Eventually,we can use the pulse field gel electrophoresis to get the better electrophoresis bands ofmacromolecular DNA fragments.Thiswill lay the foundations for a further research.
pulsed field gel electrophoresis,large DNA,optimization of experimental parameters
Q503
A
1008-7516(2011)05-0055-03
10.3969/j.issn.1008-7516.2011.05.014
2011-07-23
国家自然科学基金(30800204)
陈秋芳(1972-),女,河南伊川人,博士,工程师.主要从事离子束生物工程研究.
卢奇)
