超高压加工对食品酶催化特性的影响*
2011-01-13张瑜缪铭江波张涛
张瑜,缪铭,江波,张涛
近年来,随着社会的发展与科技的进步,消费者对现代食品的质量与品质要求越来越高。基于食品的安全、营养、健康等关键问题,现代食品制造技术逐渐从"热"加工向"非热"加工方向转变。作为非热加工技术领域的高技术之一,超高压加工 (high pressure processing,HPP)技术是将食品密封在容器内,以水或油作为传压介质,在常温或稍高于常温 (25~60℃)下进行 100~1 000 MPa的加压处理,维持一定时间后不仅可以有效杀灭腐败菌和致病菌等微生物,还可使食品酶、蛋白质和淀粉等生物大分子改变活性、变性或糊化,从而最大限度保持或改善产品功能品质,是一种已被美国农业部 -食品安全检查服务部 (USDA-FSIS)认证和消费者接受的新型食品加工技术[1]。由于 HPP技术应用于食品工业具有工艺简单、操作安全、节约能源、绿色安全等特点,目前在日本、美国、欧洲等发达国家发展迅速,已经有商业化的产品面市,例如日本越後制菓、美国 Avomex公司、Kraft食品公司、西班牙 Esp公司、法国 Pernod Ricard公司等已生产出最小加工、品质新鲜、即食的HPP产品,主要有方便米饭、水果制品、奶制品、肉制品、海鲜产品等[2-3]。据不完全统计,全球已有 56个国家采用超高压技术加工食品,HPP食品超过了 13万t。
目前,HPP技术主要作为新兴技术应用于酸性食品保藏,主要机理是能够使微生物细胞膜和细胞壁损伤,改变细胞形态,影响细胞内酶活力及细胞内营养物质和废弃物的运输,从而杀死食品中的腐败菌和致病菌。但是,HPP技术也能够有效或部分钝化食品中的内源酶,同时可以激活常压下惰性的食品酶,提高其活性和稳定性,这对食品加工过程的催化转化反应是有益的,比如 HPP技术可以加快某些在常压下反应缓慢甚至不进行的酶促反应,生成高附加值产物,提高生产效率与食品品质[4]。本文就 HPP技术对食品酶的影响机制及结构变化作简单介绍,综述近几年国内外该高新技术改变食品酶催化能力方面的最新研究进展。
1 HPP影响食品酶活力的机理
1.1 压力诱导稳定性机制
在酶分子体系中,压力和温度对酶分子排列和空间构象存在拮抗关系,使得二者关系图呈椭圆形曲线,如图1所示。

图1 理论上压力 -温度对酶蛋白构象的影响
未变性酶蛋白区域在椭圆形曲线内 (深色阴影),变性酶蛋白区域在椭圆形外,线的轮廓是可逆变性区(浅色阴影),即天然酶和变性酶的平衡浓度相等。不同加工条件下,加压或升温对酶的影响不同。在图1中,A处 (低温低压)适度地增加温度和压力都能对酶起稳定作用;D处 (高温高压)温度和压力任一增加都会破坏酶的稳定;B处 (低温高压)增加压力使酶变性,增加温度能够稳定酶活,C处 (高温低压)与 B处压力和温度作用相反。Eisenmenger[4]等已经报道压力 -温度处理呈椭圆形变性曲线的食品酶主要包括胰凝乳蛋白酶、多酚氧化酶、果胶甲酯酶 、芥子酶 、柚苷酶 、β-葡聚糖酶 、α-淀粉酶 、β-淀粉酶、葡糖淀粉酶等。
Knorr等[5]对大麦芽中的 α-淀粉酶 、β-淀粉酶和β-葡聚糖酶和黑曲霉中的两种葡糖淀粉酶同工酶GA1和 GA2在温度和压力下的变性曲线做了深入的研究 (图2),得出这几种酶都存在椭圆形的变性曲线,证实了压力与温度结合处理存在明显的拮抗关系 。大约在 200 MPa(α-和 β-淀粉酶 )、400 MPa(β-葡聚糖酶和 GA2)和 600 MPa(GA1),酶明显表现出对热稳定性。另外,从图可以看出,淀粉酶的热稳定性与压力稳定性没有直接联系。例如,β-葡聚糖酶活性在室压下温度高于 50℃会快速失活,但是能在高于 800MPa下稳定。相反,β-淀粉酶在 600MPa不稳定,但是室压下能够承受高于 55℃的温度,而没有活性丧失。甚至是来源相同的同工酶 (GA1和 GA2)也表现出不同的物理稳定性。

图2 不同淀粉酶变性的压力-温度关系图
1.2 压力诱导活性机制
不同压力作用于食品酶体系,可影响酶催化反应速率,主要是因为其:①对酶结构的直接改变;②对反应机制的改变,例如,对限速反应阶段的改变;③对底物和溶剂物理性质 (pH、密度、黏度、相)的改变能影响到酶的结构或限速阶段。压力对酶的反应速率的影响符合勒夏特列原理:提高压力平衡将向体系总体积减小的方向移动。压力对反应速率和平衡的影响可以由艾林 (Eyring)方程式评价[4]:
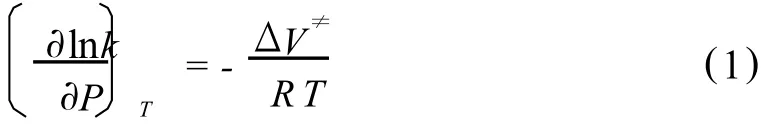
式中:P-压力;T-绝对温度;R-理想气体常数,△V≠-活化体积,k-速率常数。△V≠是活化态V≠和基态VA的差,由公式 (1)可知,当系统的活化态体积小于基态体积 (△V≠为负值),反应速率随压力的升高而增加,反之速率则降低。由于压力影响酶的很多因素:例如酶的构象、酶的溶剂化 (与周围介质、其他蛋白质、水、离子等的相互作用)、化学平衡和固定化载体与酶结合的改变,所以酶与化学催化剂不同,其反应的活化体积不是常数。一般酶反应或其构象变化下,活化体积范围在 -70~+60 cm3/mol之间,大多数在 30 cm3/mol以下。Eisenmenger等[7]报道来源于南极假丝酵母的脂肪酶在 80℃、0.1~200 MPa下△V≠为负值,相应的Vmax逐渐增加;300~500 MPa下为正值,相应的Vmax逐渐降低。
2 HPP对食品酶空间结构的影响
天然酶蛋白在物理或化学因素作用下,其特定的空间结构被破坏,从而导致理化性质改变和生物学活性的丧失,但是其变性机理不同。温度和化学变性剂主要引起整个酶蛋白共价键断裂和分子的聚合而导致酶蛋白不可逆变性。而高压变性机制则不同,它能使部分酶蛋白分子不变,在水溶液中共价键不受其影响。Knorr等[5]认为压力主要引起酶蛋白的二、三、四级结构变化。在较低压力下二级结构的α-螺旋和β-折叠不被压缩,甚至还会更加稳定,但是在较高压力 (高于 300~700 MPa)下,二级结构会发生不可逆变性 (见图3)。蛋白质三级结构是形成酶活性中心的基础,超高压作用使三级结构崩溃时,酶活性中心氨基酸组成发生改变或丧失,从而改变酶催化活性。四级结构是由非共价作用保持稳定的,在高压下会发生聚合。
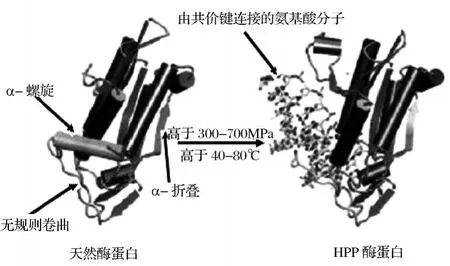
图3 超高压导致酶蛋白结构变化示意图
压力在 100~300 MPa之间 HPP处理也可以提高酶活,因为在完整组织中酶和底物经常被膜隔离,使用较低的高压可以破坏这种膜,使酶和底物相互接触,从而引起酶促反应发生。HPP提高酶活的原因主要有以下 3方面:①超高压处理使酶分子构象发生限制性改变,利于酶与底物接触;②超高压使酶的部分活性部位裸露,使活性上升;③超高压处理使酶分子转变为具有催化活性的酶。
高压处理也会影响同工酶的数量和活性。Fang等[6]研究发现,HPP处理猕猴桃果汁后,过氧化物酶在较低压力下活性上升,并出现新的同工酶,在较高压力下时,新酶带消失,活性有所抑制。采用圆二色谱观察得到的两种同工酶,发现其二级结构构象单元含量不尽相同,在经过 HPP处理后发生不同的变化,说明两者的高压稳定性不同,这为两者结合表现出的过氧化物酶活力在高压下的不规律变化提供了新的依据。另外,有报道认为具有压力稳定性的同工酶的存在是决定残留酶活性的重要因素。
3 HPP对食品酶催化能力的影响
各种酶类经超高压处理后,能在较低的压力下使其活力增强,而在更高的压力下,活性受到抑制而减弱。根据压力对酶活的调节作用,可以选择性的对食品酶催化特性进行改变,使其适应食品加工的需要。对食品有利的酶,可以通过调节压力使其稳定性和活性增强,用于催化合成功能配料、风味或色素等,能更有效的应用于食品加工;对食品品质有负作用的酶,可以通过控制压力使其钝化而保护食品质构及感官特性。
近几年超高压对食品酶活力的影响见表1。

表1 超高压对酶活的影响变化
3.1 激酶效应
HPP加工可以实现在适度的压力下提高酶活,提高所需产物的反应速率,为食品加工创造了很好的条件。
在功能性配料制备中,HPP对功能性多肽、柚皮素等的生成都有促进作用。抗 ACE活性肽研究最多,其对治疗高血压有效。Quiros等[26]先确定卵清蛋白水解物中的活性肽序列,再研究使用超高压提高生物活性肽释放的可能性。在 400MPa下,分别使用胰凝乳蛋白酶、胰蛋白酶和胃蛋白酶处理卵清蛋白,水解程度得到提高并改变了蛋白质水解方式。在200~400 MPa下加速了抗 ACE活性肽的释放,并论证了体外的降压效果。由于柚皮素具有抗氧化、抗炎、抗癌、降压降脂等功效,Helder等[15]研究了高压对固定化柚皮苷酶催化水解柚苷生成柚皮素反应的作用。海藻酸钙微球包裹的柚苷酶在 160 MPa、35~40℃有较高的活性,固定化柚苷酶符合米氏动力学,160 MPa下,最大初始速率Vmax比常压下高 65%,Km低 70%,高压作用加快了酶转化反应,促进柚皮素的生成。
在淀粉糖生产中,HPP可以促进β-淀粉酶水解淀粉的α-1,4-糖苷键生成麦芽糖。Heinz等[9]提出大麦芽中的β-淀粉酶受高压和温度影响较大,在 100 MPa、62℃下,处理 15 min能达到淀粉的最高解聚速度,比常压下最佳条件 (55℃)的产量多 15%。超高压也可以促使β-葡糖苷酶催化糖苷键的水解释放β-D-葡萄糖和相关的糖苷配基,例如β-葡糖苷酶的催化特性在压力和温度分别为 55~65℃、0.1~100 MPa条件下有协同效应。
在冷饮和焙烤工业中,HPP可以促进脂肪酶催化酯交换反应,以改变脂肪的晶型和溶解特性,提高产品的物理、感官和保健特性。Osorio等[25]研究了在无溶剂介质中,高压对绵毛嗜热丝孢菌的固定化脂肪酶催化脂肪混合物的酯交换动力学的作用。反应物质为棕榈硬脂酸、棕榈果油和富含ω-3多不饱和脂肪酸的甘油三酯,脂肪酶催化酯交换在 150MPa下活性较高,应用 HPP可以使脂肪酶的选择性向着有利的方向改变。
在合成香精香料方面,HPP可以促使脂肪酶催化产生酯类物质。Eisenmenger等[7]研究了高压下正己烷体系中固定化脂肪酶催化合成乙酸异戊酯的动力学。与低压下反应相比,高压 400MPa、80℃、4h能提高酶活 152%。当温度从 40℃升到 80℃,低压下酶活增加 110%,而在 350 MPa下增加了 239%。超高压使得反应向产物方向移动,且反应速率增快。因此,在生产乙酸异戊酯时选择合适的压力和温度,会使生产效率大幅增加。
乳制品行业中,HPP促使β-半乳糖苷酶水解乳糖成半乳糖和葡萄糖。Degraeve等[11]研究了超高压能够提高米曲霉和大肠杆菌的β-半乳糖苷酶的活性,并采用傅里叶变换红外光谱 (FT-I R)观察压力和温度对两种酶结构的影响变化。两种β-半乳糖苷酶在 27℃、1h、低于 300 MPa的条件下酶活没有明显的损失。米曲霉的β-半乳糖苷酶比大肠杆菌的要稳定一些,1h内 50%的初酶活损失,前者需要 450 MPa,而后者则需要 400 MPa。
3.2 钝酶效应
HPP在食品冷加工处理上作用很大,可用于食品的杀菌灭酶,但不会破坏食品的色、香、味等风味物质,处理后食品能保留原有生鲜风味和营养成分。
果蔬加工中,HPP可以抑制多酚氧化酶 (PPO)引起的褐变和过氧化物酶 (POD)及脂肪氧合酶 (LOX)形成的不良风味。Phunchaisri[27]研究发现高压对荔枝品质影响较小,200 MPa时 POD酶活增加,在 600 MPa、60℃条件下,处理 20 min能使新鲜荔枝的 POD降低 50%,而 PPO降低 90%。但超高压处理荔枝浓浆酶活变化就不明显,这是归因于浆液的气压保护效应。Terefe等[19]通过研究热和高压对两种草莓酱中的 PPO和 POD的灭活动力学,发现这两种果酱的PPO极耐热,在 100℃处理 30 min没有明显的钝化作用,在 690 MPa,90℃条件下,PPO灭活量为 23%;POD则表现出高热敏性,在 70℃下不到 5 min就完全失活。Rodrigo[23]研究了番茄汁的 LOX在温度为 25~90℃、压力在 100~650 MPa之间的稳定性,得出低于 400 MPa LOX的活力比常压下的高,说明压力使LOX更利于与膜结合,利于酶解。在 650 MPa、60℃的条件下,处理 12 min番茄汁的 LOX的残余酶活为20%。因此在果蔬加工中应该有效控制压力与温度,抑制不利酶反应形成褐色物质或异味。
啤酒与果汁生产中,蛋白酶可作为啤酒澄清剂,HPP可以在澄清后将其灭活却不影响食品品质。Katsaros等[17]分别采取热处理 (50~80℃,常压)和高压 /热处理 (50~80℃,500~900 MPa)研究了木瓜蛋白酶和无花果蛋白酶的钝化动力学。当固定加工温度,增加压力将增加灭活速率,在 900 MPa、80℃条件下,处理 22 min木瓜蛋白酶可达到 95%的灭活率。猕猴桃蛋白酶作为一种新型巯基蛋白酶,Katsaros[18]报道在 650 MPa下,处理大约 25 min猕猴桃蛋白酶的灭活率为 90%。
4 展望
HPP凭借着其在食品加工中不破坏食品营养与功能、节能环保、处理时间短等优点,在热敏性食品的杀菌、钝酶、保持食品新鲜度等方面有着巨大的发展潜力。但是,HPP在国内研究应用还相对滞后,需要在非热杀菌动力学与机理、食品品质影响与动力学分析、安全性评价、工程装备及产业化应用等方面不断拓宽和深入,尤其是 HPP对食品酶稳定、激活或钝化动力学及机理模型。随着 HPP在我国得到深入理论研究及广泛产业应用,会进一步推动我国超高压食品加工业发展,并满足消费者对高品质健康食品的需求。
[1] Moazhaev V V,Heremans K,Frank J,et al.Exploiting the effects of high hydrostatic pressure in biotechnological applications[J].TI B Techniques,1994,12:493-501.
[2] RastogiN K,Raghavarao K S,Balasubramaniam V M,et al.Opportunities and challenges in high pressure processing of foods[J].CriticalReviews in Food Science andNutrition,2007,47:69-112.
[3] Torres J A,Velazquez G.Commercial opportunities and research challenges in the high pressure processing of foods[J].Journal of Engineering,2005,67:95-112.
[4] EisenmengerM J,Reyes-De-Corcuera J I.High pressure enhancement of enzymes:A review[J].Enzyme and Microbial Technology,2009,8:1-17.
[5] KnorrD,HeinzV,Buckow R.Review:High pressure application for food biopolymers[J].Biochimica etBiophysica Acta,2006,1764:619-631.
[6] FangL,JiangB,Zhang T.Effect of combined high pressure and ther mal treat ment on kiwifruit peroxidase[J].Food Chemistry,2008,109:802-807.
[7] EisenmengerM J,Reyes-De-Corcuera J I.High hydrostatic pressure increased stability and activity of i mmobilized lipase in hexane[J].Enzyme and Microbial Technology,2009,45:118-125.
[8] Buckow R,WeissU,HeinzV,et al.Stability and catalytic activity of alpha-amylase from barley malt at different pressure-temperature conditions[J].Biotechnology and Bioengineering,2007,97:1-11.
[9] HeinzV,Buckow R,KnorrD.Catalytic activity ofβ-amylase from barley in differentpressure/temperature domains[J].Biotechnology Progress,2005,21:1 632-1 638.
[10] Buckow R,HeinzV,KnorrD.Effect of high hydrostatic pressure-temperature combinations on the activity of betaglucanase from barleymalt[J].Journal of the institute of brewing,2005,111:282-289.
[11] Degraeve P,Rubens P,Lemay P,et al.In situ observation of pressure-induced increased ther mostability of two β-galactosidaseswith FT-IR spectroscopy in the diamond anvil cell[J].Enzyme and Microbial Technology,2002,31:673-684.
[12] BruinsM E,Janssen A E.Boom R M.Equilibrium shifts in enzyme reactions at high pressure[J].Journal ofMolecular CatalysisB:Enzymatic,2006,39:124-127.
[13] Marie-OliveM N,AthesV,CombesD.Combined effects of pressure and temperature on enzyme stability[J].High Press Res,2000,19:707-712.
[14] Hsu K C.Evaluation of processing qualities of tomato juice induced by thermal and pressure processing[J].Food Science and Technology,2008,41:450-459.
[15] HelderA L Pedro,Alfaia A J,Marques J,et al.Design of an immobilized enzyme system for naringin hydrolysis at high-pressure[J]. Enzyme and Microbial Technology,2007,40:442-446.
[16] Buckow R,TruongB Q,VersteegC.Bovine cathepsinD activity under high pressure[J].Food Chemistry,2009:1-8.
[17] Katsaros G I,Katapodis P,Taoukis P S.High hydrostatic pressure inactivation kinetics of the plant proteases ficin and papain[J].Journal of Food Engineering,2009,91:42-48.
[18] Katsaros G I,Katapodis P,Taoukis P S.Modeling the effect of temperature and high hydrostatic pressure on the proteolytic activity of ki wi fruit juice[J].Journal of Food Engineering,2009,94:40-45.
[19] Terefe N S,Ya H Y,Kai K,et al.High pressure and thermal inactivation kinetics of polyphenol oxidase and peroxidase in strawberry puree[J].Innovative Food Science and Emerging Technologies,2010,11:52-60.
[20] Rapeanu G,Loey A V,Smout C,et al.Thermal and high-pressure inactivation kinetics of polyphenol oxidase in victoria grape must[J].Journal of Agricultural and Food Chemistry,2005,53:2 988-2 994.
[21] Bayindirli A,Alpas H,Bozoglu F,et al.Efficiency of high pressure treatment on inactivation of pathogenic microorganis ms and enzymes in apple,orange,apricot and sour cherry juices[J].Food Control,2006,17:52-58.
[22] Wang R,Zhou X,Chen Z X.High pressure inactivation of lipoxygenase in soy milk and crude soybean extract[J].Food Chemistry,2008,106:603-611.
[23] Rodrigo D,Jolie R,Loey A V,et al.Thermal and high pressure stability of tomato lipoxygenanse and hydroperoxide lyase[J].Journal of Food Engineering,2007,79:423-429.
[24] Garcia-Palazon A,Suthanthangjai W,Kajda P,et al.The effects of high hydrostatic pressure onβ-glucosidase,peroxidase and polyphenoloxidase in red raspberry(Rubus idaeus)and strawberry(Fragariaananassa)[J].Food Chemistry,2004,88:7-10.
[25] Osorio N M,Ribeiro M H,Fonseca M M,et al.Interesterfication of fat blends rich inω-3 polyunsaturated fatty acids catalysed by i mmobilizedTher m om yces lanuginosalipase under high pressure[J].Journal ofMolecular CatalysisB:Enzymatic,2008,52-53:58-66.
[26] QuirosA,Chichon R,Recio I,et al.The use of high hydrostatic pressure to promote rhe proteolysis and release of bioactive peptides from ovalbumin[J].Food Chemistry:2007,104:1 734-1 739.
[27] PhunchaisriC,ApichartsrangkoonA.Effectsof ultra-high pressure on biochemical and physical modification of lychee(Litchi chinensisSonn.) [J]. Food Chemistry,2005,93(1):57-64.
