超声波辅助提取月柿原花青素及其纯化
2011-12-18李仁杰陈锦屏张娜严静王恒超
李仁杰,陈锦屏,张娜,严静,王恒超
(陕西师范大学食品工程与营养科学学院,陕西西安,710062)
超声波辅助提取月柿原花青素及其纯化
李仁杰,陈锦屏,张娜,严静,王恒超
(陕西师范大学食品工程与营养科学学院,陕西西安,710062)
研究了超声波辅助提取月柿生理落果原花青素工艺。适宜工艺条件为:超声波功率 150 W、提取溶液乙醇体积分数 70%、料液比 (g∶mL)1∶12、提取时间 15 min、提取温度 45℃。通过对 9种大孔吸附树脂的研究,确定LS300树脂为优选纯化树脂。研究了原花青素在LS300树脂上的吸附行为,静态吸附研究表明,其吸附等温曲线符合 Freundlich等温吸附方程,吸附平衡的时间约为 5h。乙醇浓度梯度洗脱试验表明,原花青素主要易被体积分数 20%、40%乙醇溶液洗脱,两部分原花青素质量分数分别为 86.5%、92.3%。
原花青素,月柿生理落果,超声波辅助提取,大孔吸附树脂,纯化
月柿属于柿树科柿属,乔木落叶性果树。主产于中国广西壮族自治区恭城瑶族自治县,已有 400多年的栽培、加工历史[1]。恭城月柿现种植面积 0.669万hm2,年产柿饼 1万 t。在月柿生长过程中每年 7、8月都会产生大量的生理落果,造成资源浪费与环境污染。由于月柿中含有大量的原花青素[2],所以可利用这些生理落果提取原花青素。原花青素是一种由黄烷醇单体缩合而成的聚多酚类物质,原花青素具有极强的抗氧化等活性,已广泛应用于食品、药品、化妆品等领域[3-4]。本文利用月柿生理落果为原料,对超声波辅助[5]提取月柿生理落果原花青素的工艺及用大孔吸附树脂纯化原花青素的工艺进行了研究。
1 材料与方法
1.1 试验材料与仪器
月柿生理落果,2009年 7月采于恭城红岩村柿园,采收后立即运回实验室冷冻贮藏;原花青素标品,天津尖峰天然产物公司生产;LS46、LS100、D101、LS300、LS300B、LS306、LS600、LS610、LS800大孔吸附树脂,陕西蓝深树脂有限公司;乙醇、盐酸、甲醇、香草醛均为国产分析纯。
舒美 KQ3200DE型实验室用超声波清洗器 (功率 150 W,频率 40 KHz,温度、功率均可调),昆山超声仪器公司;Sartorius BS224型电子天平,北京赛多利斯 (Sartorius)仪器系统有限公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;722型可见分光光度计,上海光谱仪器有限公司;MB99-2自动分离层析仪,上海沪西分析仪器有限公司;SHZ-82型恒温水浴摇床,金坛市富华仪器有限公司;RZ-52旋转蒸发器,上海安亭实验仪器有限公司。
1.2 试验方法
1.2.1 月柿生理落果原花青素提取工艺
月柿生理落果→组织捣碎机捣碎→准确称取5.00 g→加入提取溶剂→超声波辅助提取→提取液真空抽滤→真空浓缩提取液→冷冻干燥
1.2.2 原花青素提取率的计算
Y:原花青素的提取率,%;V0:提取溶液的体积,mL;c0:提取溶液原花青素的浓度,mg/mL;m0:月柿落果质量,g;Z:原花青素提取效果,mg/g。
1.2.3 树脂静态吸附试验流程
将一定质量预处理好的树脂加入锥形瓶中,加入原花青素提取液,密封,置于水浴摇床中,进行吸附试验,试验结束后测定溶液中原花青素的浓度。
吸附试验完成后将树脂与原花青素分离 (树脂继续留在锥形瓶中),在锥形瓶中加入洗脱溶液,密封,置于水浴摇床中进行解吸试验,试验结束后测定溶液中原花青素的浓度。
1.2.4 树脂动态吸附试验流程
将预处理好的树脂湿法装柱,加入原花青素提取溶液。待原花青素充分吸附后,用蒸馏水将没有吸附的原花青素冲出,然后用不同乙醇浓度的洗脱液进行梯度洗脱,收集洗脱液,将洗脱液真空浓缩、冷冻干燥,并测定原花青素浓度。
2 试验结果与讨论
2.1 标准曲线绘制
取浓度分别为 0.04、0.08、0.12、0.16、0.20 mg/mL的原花青素甲醇溶液 1 mL于具塞试管中,各加入质量分数 1%的香草醛甲醇溶液 2.5 mL与 8%的盐酸甲醇溶液 2.5 mL,用橡皮塞塞紧试管,置于 30℃水浴锅中避光保温 30 min,保温结束后冷却至室温,在500 nm下测量吸光值[6],并绘制标准曲线。得到回归方程为:y=0.001 6x-0.006,R2=0.997 4。
图 1 原花青素标准曲线
2.2 超声波功率单因素试验
选择超声功率为 90、105、120、135、150 W 5个单因素进行试验,其他实验条件为:温度 55℃、提取时间 10 min、提取液乙醇体积分数 50%、料液比 1∶12。
图 2 超声功率单因素试验
从图 2中可以看出,当超声波功率为 90~150 W时,提取率逐渐升高,这可能是由于超声波功率增大加快了植物细胞的破碎,更有利于原花青素的提取[5]。
2.3 提取溶液乙醇浓度单因素试验
原花青素的分子中含有大量羟基,易溶于甲醇、乙醇、丙酮等有机溶剂,但有机溶剂渗透性较差,通常选择有机溶剂的水溶液作为提取溶剂[7],本试验选择毒性较低的乙醇水溶液作为提取溶剂。
选择提取溶液乙醇体积分数为 40%、50%、60%、70%、80%、90%、100%5个单因素进行试验,其他的实验条件为:提取温度 55℃、提取时间 15 min、超声波功率 150 W、料液比 1∶12。
从图 3中可以看出,随着乙醇浓度的增大原花青素提取率逐渐增大,但乙醇体积分数超过 70%后,提取率随乙醇浓度的升高逐渐降低。
2.4 提取时间单因素试验
选择提取时间 5 min、10 min、15 min、20 min、25 min 5个单因素进行试验,其他实验条件为:超声波功率 150 W、提取温度 55℃、提取溶液乙醇浓度70%、料液比 1∶12。
图 3 提取溶剂乙醇浓度单因素试验
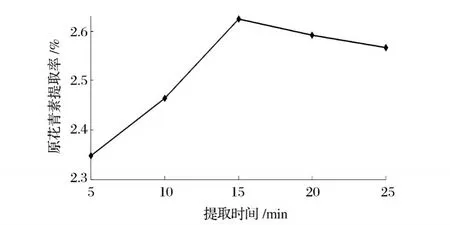
图 4 提取时间单因素试验
从图 4中可以看出,当提取时间为 15 min时提取率最高,15 min以后随着提取时间的增加提取率随着时间的增加反而降低。这可能是由于较短的提取时间不能使原花青素得到充分浸提,较长的提取时间又会造成原花青素氧化分解的缘故。
2.5 料液比单因素试验
选择液料比 1∶4、1∶6、1∶8、1∶10、1∶12、1∶14、1∶16进行单因素试验,其他试验条件为:超声波功率150W、提取温度 55℃、提取溶液乙醇体积分数 70%、提取时间 15 min。
从图 5中可以看出,随着液料比的增大,提取率逐渐增大,液料比为 12∶1时提取效果达到最大,液料比继续增大提取率则开始下降。这可能是由于较小的液料比无法充分浸提出原花青素,较大的料液比造成了液体过多地吸收了超声波使,使作用于原料的超声波减小的缘故。
2.6 提取温度单因素试验
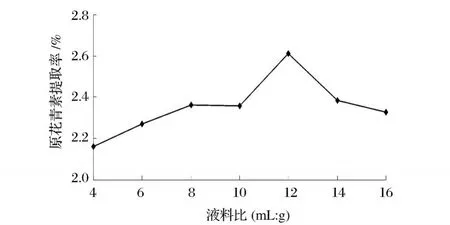
图 5 料液比单因素试验
选择 25、35、45、55、65℃5个温度为单因素进行试验,其他实验条件为超声波功率 150 W、提取时间15 min、提取溶液乙醇体积分数 70%、料液比 1∶12。
从图 6可知,随着温度的升高,提取率不断增大,到 55℃时提取率达到最大,继续升高温度,则提取率开始下降。可能是由于温度升高加速细胞破裂并有利于原花青素充分溶解于提取溶液,但原花青素是热敏性物质,高温又会使其分解加快的缘故。
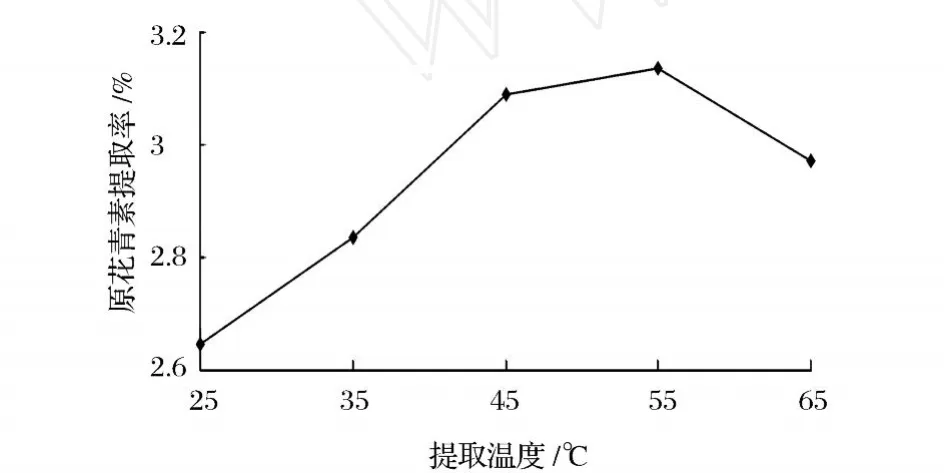
图 6 提取温度单因素试验
2.7 超声波辅助提取正交试验
在单因素试验的基础上选择提取温度 (A)、提取时间 (B)、料液比 (C)三因素在三个水平上进行正交试验,试验中其他试验条件为超声功率 150 W、提取溶剂乙醇体积分数 70%。
从表 2中可以看出,原花青素最佳提取条件为A1B2C2,由此得出最佳提取条件为:提取温度 45℃、提取时间 15 min、料液比为 1∶12、超声波功率 150W、提取溶剂乙醇浓度 70%。从极差分析可以看出 3个因素对原花青素提取效果影响的主次顺序为 B(提取时间)>C(料液比)>A(提取温度)。
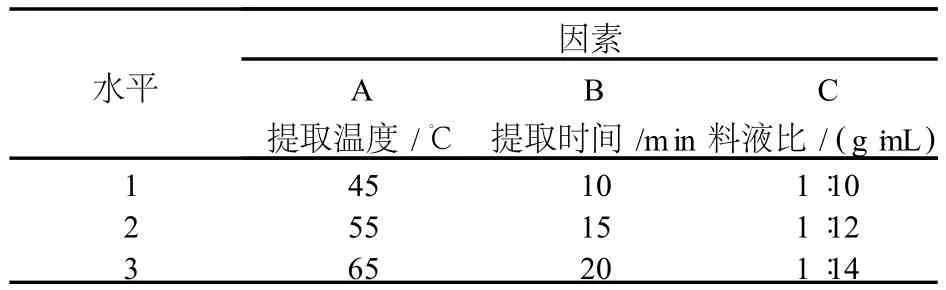
表1 L9(33)正交因素水平表
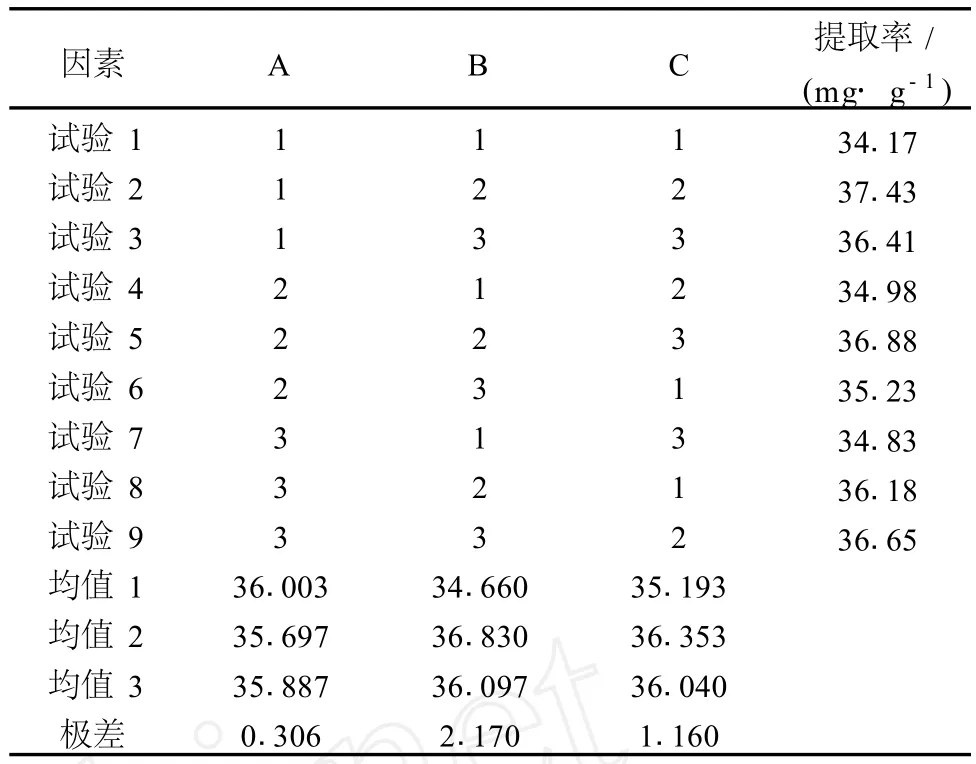
表2 正交试验结果分析
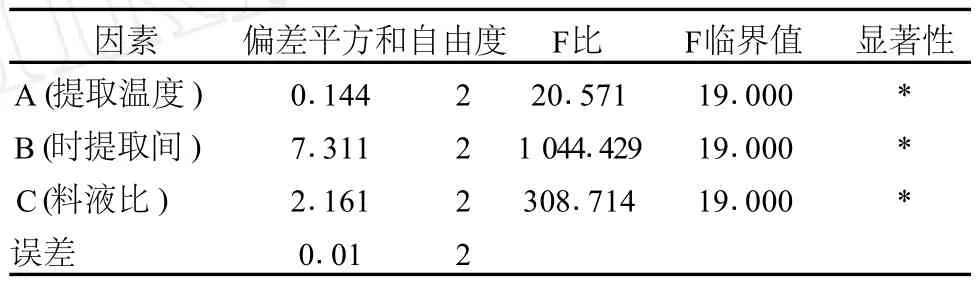
表3 正交试验方差分析
从表 3中可以看出,A(提取温度)、B(提取时间)、C(料液比)3个因素对提取效果的影响均显著。
2.8 大孔吸附树脂选择试验
试验选择 LS46、LS100、D101、LS300、LS300B、LS306、LS600、LS610、LS800九种大孔吸附树脂进行树脂选择试验,从中选择一种吸附能力与解吸能力俱佳的树脂。
各加入上述 9种树脂 10 g于锥形瓶中,分别加入 20 mL浓度为 0.226 3 mg/mL原花青素溶液,将锥形瓶置于水浴摇床中进行吸附试验,实验条件为:温度 40℃、转速 120 r/min、时间 24 h。然后测定溶液中原花青素浓度 c1。将树脂与原花青素溶液分离 (树脂继续保留在锥形瓶中),加入乙醇体积分数为 50%洗脱液 20 mL,在水浴摇床中进行解吸试验,试验条件为:温度 40℃、转速 120 r/min、时间 24 h,然后测定洗脱液中原花青素浓度 c2。计算各树脂吸附能力与解吸率。
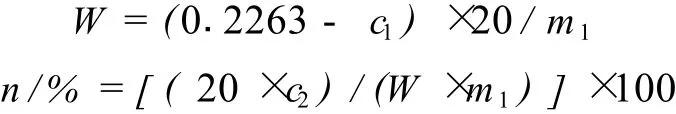
W:树脂吸附能力,mg/g;m1:树脂质量,g;n:树脂解吸率,%。

表4 树脂型号与树脂编号
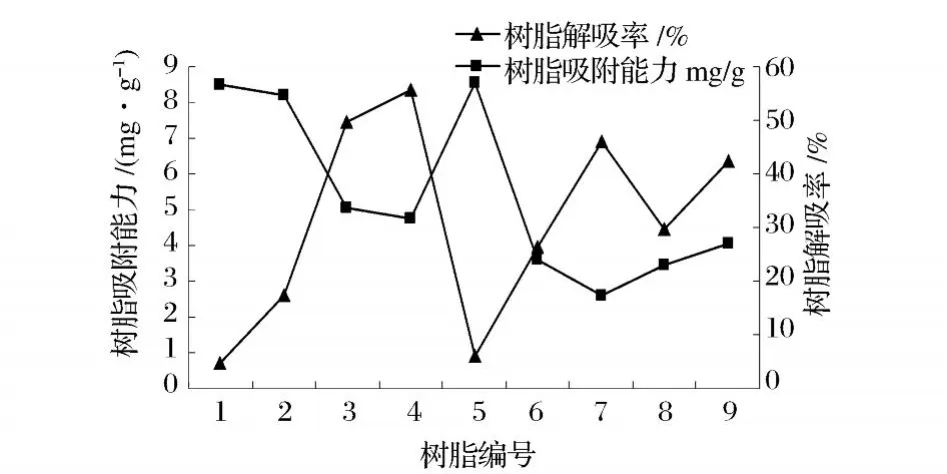
图 7 树脂选择试验
从图 7中可以看出,吸附能力最强的是 5号树脂即 LS300B树脂,但 LS300B树脂解吸率太低,会造成吸附上去的原花青素无法被洗脱下来,所以综合吸附能力与解吸率,选择 4号树脂即 LS300树脂继续进行原花青素纯化的实验。
2.9 吸附速率试验
在锥形瓶中加入 5 g处理好的 LS300树脂,然后分别加入初始浓度分别为 1.87、3.52、6.82 mg/mL原花青素提取液,置于 40℃的水浴摇床中震荡 (120 R/min),每隔 1h测定锥形瓶内的原花青素浓度,计算原花青素在树脂上的吸附量。
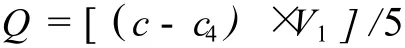
Q:原花青素在树脂上的吸附量 mg/g,c:溶液原花青素的初始浓度 mg/mL,c4:t时刻原花青素溶液浓度 mg/mL,V1:溶液的体积 mL。
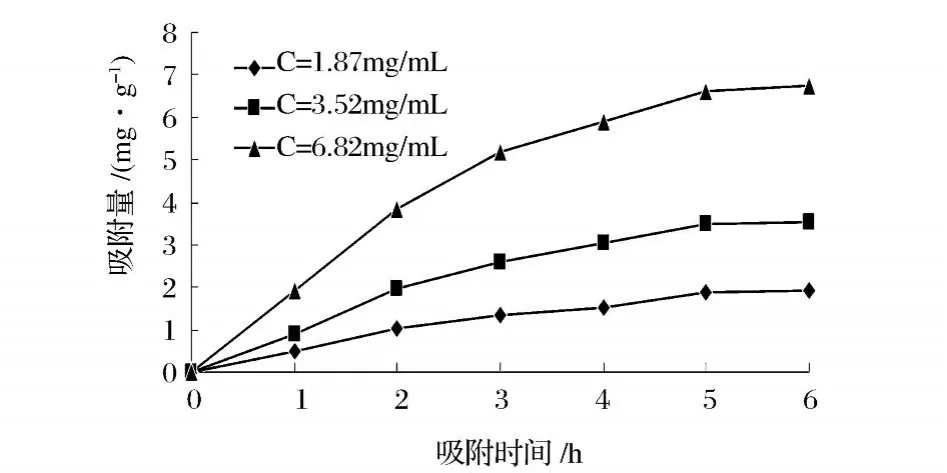
图8 吸附速率试验
从图 8中可以看出,在吸附初始阶段吸附量增加明显,吸附较快,随后吸附量增加逐渐减慢,吸附 5 h后吸附量趋于稳定,故吸附平衡所需时间为 5 h。
2.10 吸附平衡试验
称取 5 g树脂加入到锥形瓶中,分别加入不同浓度的原花青素提取液 100 mL,置于恒温摇床中震荡实验条件为:温度 40℃、转速 120 r/min、时间 6 h。6 h后取出测定溶液中原花青素的浓度。测定 30、40、50、60℃时的吸附等温曲线。用 Freundlich方程:Q=kc1/n拟合所得数据[8]。
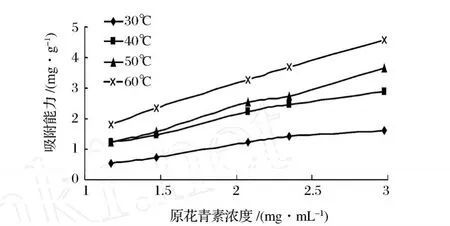
图 8 吸附平衡试验
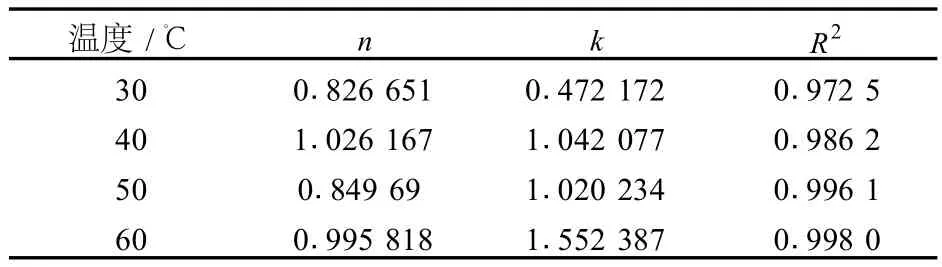
表5 Freundlich等温吸附方程拟合结果
2.11 动态吸附试验
取预处理好的 LS300树脂 120 g湿法装柱 (2.5 cm×60 cm),缓慢加入浓度为 6.57 mg/mL原花青素水溶液,流速 1BV/h(1BV相当于 1倍层析柱的体积,单位:mL)、温度 30℃,收集流出液,每管 10 mL,测定其中原花青素的浓度。以流出液体积为 x轴,以流出液原花青素浓度为 y轴,绘制泄露曲线。
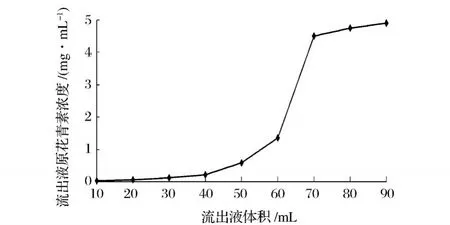
图 9 泄露曲线
从图 9中可以看出,当流出体积为 70 mL的时候,流出液的原花青素浓度显著增大,此时原花青素开始泄露,树脂吸附达到饱和。由泄露曲线计算LS300饱和吸附量为 3.833 mg/g,与 Freundlich等温吸附方程计算的结果的饱和吸附量 4.585 mg/g相比较低,说明柱中的树脂还没有达到饱和吸附,使得动态吸附量偏低。
2.12 动态解吸
取预处理好的 LS300树脂 250 g湿法装柱 (2.5 cm×60 cm),缓慢加入 100 mL原花青素浓度为 7.24 mg/mL水溶液,流速 0.5 BV/h,然后加入 3BV的去离子水将未吸附的原花青素及蛋白质、多糖等杂质顶替出去,流速 1BV/h。然后按顺序分别加入 2BV乙醇体积分数分别为 20%、40%、60%、80%、100%溶液进行梯度洗脱[9-12],流速为 0.5 BV/h。收集各部分洗脱液,减压浓缩并冷冻干燥后测定各部分洗脱液中原花青素质量分数 (简称质量分数),并计算每部分洗脱液中原花青素的量占总洗脱原花青素量的比例 (简称比例)。
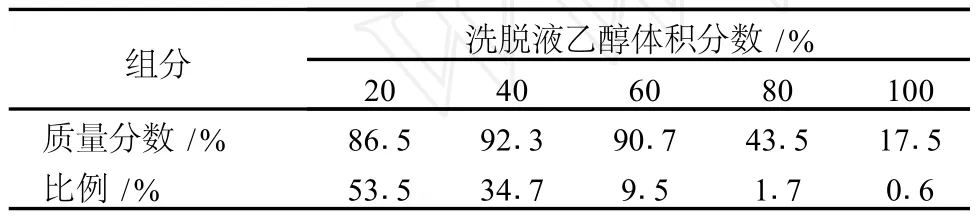
表6 不同浓度乙醇浓度溶液梯度洗脱的各组分含量、比率
由表 6可以看出,洗脱出的原花青素主要集中在20%、40%2个组分中,2组分原花青素质量分数分别为 86.5%、92.3%,原花青素纯度还不够高,洗脱条件有待优化。
3 结论
超声波辅助提取月柿落果原花青素的适宜工艺条件为:超声波功率 150 W、提取溶剂乙醇体积分数70%、料液比 1∶12、提取时间 15 min、提取温度 45℃。用此工艺条件提取的月柿原花青素在 LS300大孔吸附树脂上的吸附行为符合 Freundlich等温吸附方程。吸附量随溶液的浓度增大和吸附时温度的升高而增加,达到吸附平衡的时间约为 5 h。用乙醇水溶液进行梯度洗脱,洗脱下来的原花青素主要集中在 20%、40%2个组分中,其中 20%洗脱组分原花青素含量为86.5%,40%洗脱组分原花青素含量为 92.3%,原花青素纯度还不够高,洗脱条件有待优化。
[1] 谢炳耀.农副产品加工实用技术精粹[M].北京:学术期刊出版社,1989:150-151.
[2] 张宝善,陈锦屏,伍晓红.柿子单宁研究进展 [J].陕西师范大学学报:自然科学版,2008,36(1):99-104.
[3] 孙传范.原花青素的研究进展[J].食品与机械,2010,26(4):146-152.
[4] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000:171-174.
[5] 王俊儒.天然产物提取分离与鉴定技术[M].北京:化学工业出版社,2006:14-15.
[6] 李春阳.葡萄籽中原花青素的提取纯化及其结构和功能研究[D].无锡:江南大学,2006.
[7] 李超,王卫东.原花青素提取方法的研究进展 [J].食品工程技术,2009(9):145-148.
[8] 刘家祺.分离过程 [M].北京:化学工业出版社,2002:305-307.
[9] 李钊.葡萄籽中原花青素提取研究 [D].杭州:浙江大学,2004.
[10] 罗冠中.原花青素的提取、分离及抗氧化性、稳定性研究[D].天津:天津科技大学,2006.
[11] 范明霞.大孔树脂吸附纯化葡萄籽原花青素的研究[J].应用化工,2009,36(6):865-867.
[12] 段玉清.大孔吸附树脂对莲房原花青素吸附纯化性能的研究[J].离子交换与吸附,2009,25(2):114-120.
Ultrason ic Extraction and Purification of Proanthocyan idins from Persimmon
Li Ren-jie,Chen Jin-ping,Zhang Na,Yan Jing,Wang Heng-chao
(College of Food Engineering and Nutritional Science of ShaanxiNormalUniversity,Xi’an 710062,China)
The opti mum ultrasonic extraction process of proanthocyanidinswas studied.Opti mal extracting condition was confirmed as follows:the rate of powerof ultrasonic was 100%,alcohol contentwas 70%,the ratio of liquid to materialwas1∶12,the extraction timewas15mins and the extraction temperature was45℃.ChooseLS300 resin as the material for the purification.The absorbability ofLS300 resin was studied.The results of static adsorption showed that the adsorption isother m could be correlated with Freundlich.The adsorption equilibrium time was about 5h.The experiment of concentration gradient elution by ethanol solution showed that the most proanthocyanidinswere concentrated on two parts:the 20%and 40%.The mass fractions of two partswere 86.5%and 92.3%.
proanthocyanidins,persimmon,ultrasonic extraction,macroporous resin,purification
硕士研究生 (陈锦屏教授为通讯作者)。
2010-11-19,改回日期:2011-01-08
