板栗壳棕色素抗氧化性研究与红外光谱分析*
2011-01-13李莉顾欣崔洁孟阿会侯亚坤王建中
李莉,顾欣,崔洁,孟阿会,侯亚坤,王建中
随着现代食品工业的发展,人们逐渐认识到天然色素具有诸多优点,开发并研究新的天然色素成为研究热点。板栗壳棕色素是从废弃的板栗壳中提取出来的一种天然棕色素,此棕色素含量高,稳定性较强,耐热,经高温处理后,颜色无明显变化且抑菌效果不发生明显的改变,可用于高温操作中;耐光,在日光,灯光及紫外光等照射下无明显颜色变化;耐酸碱,在pH=4~14内色调稳定[1],不仅可以用于食品着色,还可用于纺织品着色等工业领域[2]。多数研究表明,板栗壳棕色素的主要活性成分为黄酮类化合物,而黄酮类化合物一般都具有抗氧化活性,因此板栗壳棕色素相关性质的研究具有十分重要的意义。本文用磷钼试剂、清除 DPPH自由基、清除羟基自由基和清除超氧阴离子 4种评价方式,分析比较了质量分数1%的 NaOH溶液和体积分数 40%的乙醇溶液提取的板栗壳棕色素的抗氧化性能,并比较碱提栗壳棕色素和醇提栗壳棕色素的红外光谱图,以期对板栗壳棕色素的进一步利用提供依据。
1 材料与方法
1.1 试验材料与试剂
成熟的迁西板栗,250℃烘烤 10 min后剥壳,板栗壳磨粉备用。
1,1-二 苯 基 -2-苦 肼 基 (1,1-dipheny1-2-picrylhydrazyl,DPPH),Sigma公司 ;VC,2,6-二叔丁基 -4-甲基苯酚(BHT)、邻苯三酚、钼酸铵、三羟甲基氨基甲烷 (Tris)、磷酸钠、溴化钾、硫酸亚铁、双氧水、水杨酸、氢氧化钠,天津市津科精细化工研究所;分析纯试剂 98%浓硫酸、无水乙醇、盐酸,北京化工厂;分析纯试剂试验用水为蒸馏水。
1.2 试验仪器
752 SPECTROPHOTOMETER紫外分光光度计,上海美谱达仪器有限公司;冷冻离心机,美国 Ther mo Fisher Scientific公司;冷冻干燥机 (LL1500),美国Thermo Fisher Scientific公司;Nesus670红外光谱仪,美国 Nicolet公司。
1.3 试验方法
1.3.1 碱提板粟壳色素
用 1%的 NaOH溶液浸泡粉碎的板栗壳,在 50℃的水浴中提取 5h,然后抽滤取清液,用 0.1 mol/L HCl调成中性,分别用石油醚和乙酸乙酯各洗涤 3次,以除去脂溶性成分,旋转蒸发至 1/10体积后冷冻干燥,得碱提板栗壳棕色素Ⅰ,称重,计算碱提栗壳棕色素提取得率,色素备用[1]。
1.3.2 醇提板粟壳色素
用 40%的乙醇溶液浸泡粉碎的板栗壳,在 50℃水浴中提取 5 h,然后抽滤取清液,旋转蒸发至 1/10体积后冷冻干燥,得醇提板栗壳棕色素Ⅱ,称重,计算醇提栗壳棕色素提取得率,色素备用。

式中:m色素,冷冻干燥后得到色素的质量;m栗壳,用于提取色素的栗壳的质量。
用蒸馏水分别溶解碱提栗壳棕色素、醇提栗壳棕色素和VC并配制成以下所需的各个浓度,备用;用无水乙醇溶解 BHT并配制成以下所需的各个浓度,备用。
1.3.3 磷钼络合物法测定板栗壳棕色素总抗氧化活性
磷钼络合物法测定总抗氧化活性的原理是Mo(V I)被抗氧化物质还原能够生成绿色的Mo(V)络合物,在波长 695 nm处有最大吸收波长,而且抗氧化物质活性越强,测定的吸光度值越大[3-4]。
磷钼试剂的配制:0.6 mmol/L硫酸,28 mmol/L磷酸钠和 4 mmol/L钼酸铵。
在 15 mL具塞试管中分别加入 4 mL磷钼试剂,再加入 0.4 mL浓度分别为 0.1,0.5,1.0,1.5,2.0 mg/mL的碱提栗壳棕色素、醇提栗壳棕色素、BHT和VC,95℃反应 90 min,自然晾凉至室温,695 nm测吸光度值A,对应物质的抗氧化性越强,则测定的吸光度值A越大,用ΔA来反映物质的总抗氧化活性。
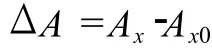
式中:Ax,加样品后的吸光度值;Ax0,空白吸光度值
1.3.4 清除DPPH自由基的方法测定板栗壳棕色素抗氧化活性
1,1-二苯基苦基苯肼 (DPPH)是一种稳定的有机自由基,溶于乙醇呈紫色,在可见光区的 517 nm处存在最大吸收峰,且其浓度与吸光度呈线性关系,通过被测物质对DPPH自由基的清除能力可以表示其抗氧化性的强弱。
称取 0.003 8 g DPPH用无水乙醇溶解,定容至50 mL,摇匀得到浓度为 2×10-4mol/L的 DPPH溶液,放在冰箱中备用。在 15 mL具塞试管中分别加入2 mL浓度分别为 0.02、0.06、0.10、0.14、0.18、0.20 mg/mL的醇提栗壳棕色素、碱提栗壳棕色素、BHT和VC。再分别加入 2mL DPPH溶液,避光反应 30 min后在 517 nm处测定吸光度。以 2 mL样品溶液加入2 mL无水乙醇作为对照,以 2 mL DPPH溶液加入 2 mL蒸馏水作为空白,计算对 DPPH自由基的清除率[5-9]。

Ai:2 mLDPPH溶液 +2 mL样品溶液;Ai0:2 mL样品溶液 +2 mL无水乙醇;A0:2 mLDPPH+2 mL蒸馏水。以无水乙醇溶液作为参比。
1.3.5 清除羟基自由基 (·OH)的方法测定板栗壳棕色素抗氧化活性
Fenton反应是以 H2O2为氧化剂,以 Fe2+为催化体系的氧化反应,在反应中生成羟基自由基 (·OH),分析·OH对水杨酸-乙醇体系的氧化情况,确定待测样品的存在是否对·OH有清除作用。与此同时,Fe2+被氧化成 Fe3+可能产生混凝沉淀。
称取 0.083 4 g FeSO4·7H2O溶于少量蒸馏水中,然后转移到 50 mL容量瓶中准确定容,得到 6 mmol/L FeSO4溶液;称取 0.041 4 g水杨酸溶于少量无水乙醇中,然后转移到 50 mL容量瓶中用无水乙醇准确定容,得到 6 mmol/L的水杨酸-乙醇体系;用微量移液器量取 166.7μL 30%的双氧水用蒸馏水定容至 50 mL容量瓶中,得到 0.1%的 HO[10-11]。22
在 15 mL的具塞试管中分别加入 1 mL 6 mmol/LFeSO4溶液,1 mL 6 mmol/L的水杨酸-乙醇溶液,再分别加入 1 mL浓度分别为 0.5、1.0、1.5、2.0、2.5 mg/mL样品溶液,最后加入 1 mLH2O2启动反应,37℃水浴反应 30 min后,以 8 000 r/min速度离心 5 min,取上清液在 510nm处测定吸光度,以蒸馏水代替 H2O2作为对照组,以蒸馏水代替样品作为空白。

Ai:为样品组;Ai0:以蒸馏水代替 H2O2的对照组;A0:以蒸馏水代替样品的空白。
采用邻苯三酚自氧化的方法,称取三羟甲基氨基甲烷 (Tris)12.11g,用蒸馏水溶解定容至 1 000 mL,得到 0.1 mol/L Tris溶液;取 50 mL 0.1 mol/L Tris溶液与 22.9 mL 0.1 mol/L盐酸混匀并稀释至 100 mL,调整 pH值为 8.2,得到 50 mmol/LTris-HCl缓冲溶液;称取 0.037 8 g邻苯三酚用 10 mmol/L HCl解定容至 100 mL,得到 3 mmol/L邻苯三酚,棕色瓶,避光保存。
取 50 mmol/L Tris-Hcl缓冲溶液 (pH=8.2)2.25 mL,加入 2 mL浓度分别为 0.2、0.4、0.6、0.8、1.0mg/mL的待测样品 (对照加蒸馏水),混匀后 25℃水浴保温 20 min,然后加入 3 mmol/L的邻苯三酚 0.3 mL,反应 2 min后,在 325 nm处测吸光度,每 30 s测定一次,共测定 5 min(10个数据)。以反应时间为横坐标,对应吸光度A值为纵坐标,计算斜率,以斜率反映邻苯三酚的自氧化速率,以蒸馏水作为对照,计算样品对·的清除率[12-13]。
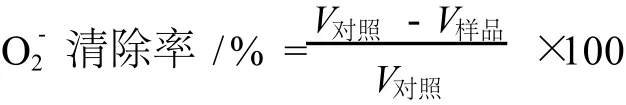
V样品:加入样品后邻苯三酚自氧化速率;V对照:加入蒸馏水后邻苯三酚自氧化速率。
1.3.8 板栗壳棕色素的红外光谱分析
称取碱提板栗壳棕色素和醇提板栗壳棕色素各2 g,称取 2 000 g的溴化钾粉末 2份,将板栗壳棕色素分别与溴化钾粉末在玛瑙研钵中研成细粉并混匀,灌注于模具中进行压片,置于红外光谱仪中进行测定。扫描范围为 4 000~400 cm-1;分辨率 8 cm-1,扫描次数 32次。
2 结果与分析
2.1 碱提醇提板栗壳色素的得率
采用 1%的 NaOH溶液提取板栗壳棕色素的得率为 25.3%,用 40%的乙醇溶液提取板栗壳棕色素的得率为 27.1%,提取得率很接近。
2.2 板栗壳棕色素抗氧化效果检验
2.2.1 总抗氧化性测定结果
从图1中可以看出,碱提栗壳棕色素、醇提栗壳棕色素、BHT和VC的抗氧化能力都随样品浓度的增加而增强,VC的总抗氧化能力最强,其次是醇提栗壳棕色素,浓度在 0~1.60 mg/mL时,BHT的总抗氧化能力略强于碱提栗壳棕色素,浓度高于 1.60 mg/mL以后,碱提栗壳棕色素的总抗氧化能力强于BHT。

图1 不同样品的总抗氧化能力比较
2.2.2 对 DPPH自由基的清除效果
从图2中可以看出,碱提栗壳棕色素、醇提栗壳棕色素、BHT和 VC对 DPPH自由基都具有清除作用,VC的清除作用最强,然后依次是醇提栗壳棕色素、碱提栗壳棕色素和 BHT,随着样品浓度的升高,对DPPH的清除作用都逐渐增强。VC在较低浓度0.02 mg/mL时,对 DPPH的清除率就可以达到87.9%;醇提栗壳棕色素在浓度为 0.20 mg/mL时,清除率可以达到 85%左右,此时与 VC的效果比较接近。醇提栗壳棕色素的 IC50值约为 0.02 mg/mL,碱提栗壳棕色素的 I C50值约为 0.09 mg/mL。

图2 不同浓度样品清除DPPH自由基能力比较
2.2.3 对羟基自由基 (·OH)的清除效果
从图3中可以看到,碱提栗壳棕色素、醇提栗壳棕色素、BHT和 VC都对·OH具有清除作用,且都随着样品浓度增大清除作用增强,在低浓度 0.50~1.00 mg/mL时,BHT>醇提栗壳棕色素 >碱提栗壳棕色素 >VC,在 1.20~2.00 mg/mL内,碱提栗壳棕色素 >VC>醇提栗壳棕色素 >BHT;较大浓度 2.10~2.50 mg/mL内,VC>碱提栗壳棕色素 >醇提栗壳棕色素 >BHT。VC的 IC50值约为 1.57 mg/mL,碱提栗壳棕色素的 IC50值约为 1.62 mg/mL,对·OH的清除效果相当于 VC的 96.91%,醇提栗壳棕色素的I C50值约为 1.90 mg/mL,对·OH的清除效果相当于VC的 82.63%,均比 BHT清除效果强。

图3 不同浓度样品清除羟基自由基的能力
从图4中可以看出,碱提栗壳棕色素、醇提栗壳棕色素、BHT和 VC对都具有清除作用,但 VC和BHT对清除效果明显强于 2种栗壳棕色素,碱提栗壳棕色素和醇提栗壳棕色素随着浓度增大对清除效果逐渐增强,浓度高于 0.95 mg/mL时,碱提栗壳棕色素清除的效果强于等浓度的BHT。碱提栗壳棕色素的 IC50值约为 0.71 mg/mL,醇提栗壳棕色素的 IC50值约为 0.83 mg/mL,浓度低于 0.42 mg/mL时,醇提栗壳棕色素清除的效果强于碱提栗壳棕色素;浓度高于 0.42 mg/mL时,碱提栗壳棕色素清除效果强于醇提色素。

图4 不同浓度样品清除超氧阴离子的能力
2.3 碱提栗壳棕色素和醇提栗壳棕色素的红外光谱分析[14-15]
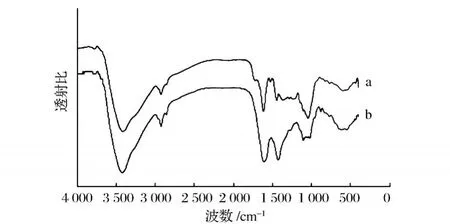
图5 醇提栗壳棕色素 (a)和碱提栗壳棕色素 (b)的红外光谱图
碱提栗壳棕色素的红外光谱和醇提栗壳棕色素的红外光谱均在 3 300~3 500 cm-1内出现较强的吸收峰,此为 O—H键的伸缩振动峰;在 2 924 cm-1出现吸收峰,此处是甲基与亚甲基的 C—H伸缩振动峰,在 1 600 cm-1附近出现吸收峰,碱提栗壳棕色素在 1 607.24 cm-1处,醇提栗壳棕色素在 1 613.48 cm-1处为芳香环的伸缩振动。
在 1 500~500 cm-1内 2种栗壳棕色素的吸收峰有所差异,谱图显示 (图5)醇提栗壳棕色素的吸收峰略多于碱提栗壳棕色素。
碱提栗壳棕色素在 1 427.50、1 102.13、621.70 cm-1有强弱不等的吸收峰。醇提栗壳棕色素在1 525.50、1 445.98、1 355.07、1 045.80、596.65 cm-1处有强弱不等的吸收峰。
3 结论
研究表明,1%的 NaOH溶液和 40%的乙醇溶液提取的板栗壳棕色素都具有一定的抗氧化性,但是评价方法不同相应反映出的抗氧化能力也不同。碱提栗壳棕色素,醇提栗壳棕色素和 BHT的总抗氧化能力比较接近,但弱于 VC;磷钼试剂法反映出总抗氧化能力都随着样品浓度的增大而增强;清除 DPPH自由基时,VC清除效果最强,然后依次是醇提栗壳棕色素,碱提栗壳棕色素和 BHT,VC在较低浓度 0.02 mg/mL时,对 DPPH的清除率就可以达到 87.9%,醇提栗壳棕色素在浓度为 0.20 mg/mL时,清除率可以达到 85%左右,醇提栗壳棕色素的 IC50值约为 0.02 mg/mL,碱提栗壳棕色素的 IC50值约为 0.09 mg/mL;清除羟基自由基 (·OH)时,随着色素浓度增大对·OH的清除作用增强,碱提栗壳棕色素,醇提栗壳棕色素,BHT和 VC的抗氧化效果接近,VC的 IC50值约为 1.57 mg/mL,碱提栗壳棕色素的 IC50值约为 1.62 mg/mL,对·OH的清除效果相当于 VC的 96.91%,醇提栗壳棕色素的 IC50值约为 1.90 mg/mL,对·OH的清除效果相当于 VC的 82.63%,均比 BHT清除效果强很多;清除超氧阴离子 (·)时,碱提栗壳棕色素的 IC50值约为 0.71 mg/mL,醇提棕色素的 IC50值约为 0.83 mg/mL,2种溶液提取的栗壳棕色素清除效果比较接近,但弱于 BHT和 VC。醇提栗壳棕色素和碱提栗壳棕色素的红外光谱图在吸收峰上存在一定的差异性。
[1] 李永祥,詹少华,蔡永萍,等 .板栗壳色素的提取、纯化及稳定性[J].农业工程学报,2008,24(9):298-301.
[2] Wang Lijuan,Li Jian,Feng Hao.Dyeing of flax fabric with natural dye from chestnut shells[J].Pigment&Resin Technology,2009,38(6):347-352.
[3] 冯雪,姜子涛 ,李荣 .调味香料草果挥发油的抗氧化性能及清除自由基能力[J].中国调味品,2010,35(3):48-54.
[4] 黄海兰,赵祖亮,王斌贵 .磷钼络合物法与β-胡萝卜素-亚油酸法测定海藻脂类成分抗氧化活性的比较[J].中国油脂,2005,30(3):32-35.
[5] 肖凯军,熊璞,王静 .金樱子棕色素的提取及其抗氧化活性研究[J].中国食品添加剂,2010(1):87-92.
[6] 张海德,黄玉林,范燕忠 .槟榔提取物对 DPPH自由基的清除作用研究[J].食品科学,2008,29(8):74-77.
[7] 段静雨,李岩,王健慧,等 .DPPH法测定金丝梅体外抗氧化活性 [J].徐州医学院学报,2009,29(9):618-620.
[8] Vijay Kothari,Sriram Seshadri.Antioxidant activity of seed extracts ofAnnona squam osaandCarica papaya[J].Nutrition&Food Science,2010,40(4):403-408.
[9] Umezuruike Linus Opara,Majeed R,Al-Ani.Antioxidant properties of selected non-leafy vegetables[J].Nutrition&Food Science.2009,39(2):176-180.
[10] 吴艳兵,吴大付,颜振敏,等 .柳树乙醇提取物体外抗氧化活性[J].资源与市场开发,2010,26(2):100-101.
[11] 曾凡梅,殷红军 .莴苣叶多酚类物质的提取及清除超氧阴离子与羟基自由基能力评价[J].农产食品科技,2007,1(4):25-29.
[12] 郭雪峰,岳永德,汤锋等 .用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1 823-1 826.
[13] 周达,罗城,鲁晓翔 .玫瑰花总黄酮微波辅助提取及其抗氧化研究[J].食品工业科技,2010,31(4):269-272.
[14] 李永祥,詹少华,樊洪泓,等 .板栗壳色素化学性质及结构的初步研究[J].食品科学,2008,29(12):51-54.
[15] Vázquez G,Fontenla E,Santos J,FreireM S,et al.Antioxidant activity and phenolic content of chestnut(Castanea sativa)shell and eucalyptus(Eucalyptus globulus)bark extracts[J].Industrial crops and products,2008,28:279-285.
