酶法水解麦冬多糖及其产物的分离鉴定*
2011-01-13吕宁金凤燮鱼红闪
吕宁,金凤燮,鱼红闪
麦冬为百合科沿阶草属植物麦冬(Ophiopogon japonicusKer-Gawl)的干燥块根[1],具有滋阴生津、润肺止咳等功效。麦冬多糖为其主要活性成分之一,具有多种药效功能,主要集中在抗心肌缺血[2]、抗血栓形成[3]、耐缺氧[4]、降血糖[5]等方面。多糖的活性与其相对分子质量大小、单糖组成及分子结构有着密切的关系,且免疫应答主要由相对分子质量大小而决定[6]。研究发现,相对分子质量 1万以下的麦冬多糖有较为显著的抗心肌缺血作用[7]。
目前有关麦冬多糖的化学、药理与临床研究已经十分令人瞩目,但是有关酶法水解麦冬多糖的深入具体研究报道尚不多见。由于酶具有特异性,可选择性地酶解切断特定糖苷键,从而对麦冬多糖进行专一降解,制得特定聚合度的产物。本研究采用生物酶法水解麦冬多糖,对其产物的相对分子质量及单糖组成进行研究,以期为麦冬多糖的进一步开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
麦冬,市售,浙江慈溪产;菌种Absidiasp.O8s,由大连工业大学生物与食品工程学院菌种保藏所提供;单糖标准品,Sigma公司;Sephadex G-100、Sephadex G-50,Phar macia公司;薄层层析版,德国 Merck公司;蓝色葡聚糖及标准系列葡聚糖,Pharmacia公司;乙腈(色谱纯),大连科密欧试剂公司;其余试剂均为分析纯。
1.2 仪器与设备
722型紫外可见分光光度计,上海精密科学仪器有限公司;BSZ-100自动部分收集器,上海沪西生化仪器厂;GL-21M高速冷冻离心机,长沙湘仪离心机仪器有限公司;YQX-LS-SⅡ全自动电热压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;JASCO LC-2000系列高效液相色谱,日本分光公司;Alltech 2000ES型蒸发光散射检测器,美国 Alltech公司。
1.3 方法
1.3.1 麦冬多糖的制备
多糖提取:100 g麦冬经粉碎后,加去离子水煎煮3次,每次加 10倍量水,每次煮沸 30 min。纱布过滤,合并滤液并减压浓缩至 1 mg/mL,乙醇沉淀至醇体积分数为 80%,静止过夜,滤去上清液,沉淀冷冻干燥即得到麦冬粗多糖。
分离纯化:取 2 g麦冬粗多糖,用 Sevage法除去蛋白,然后经 Sephadex G-100进行凝胶柱层析 (16 mm×800 mm),用去离子水洗脱,控制流速 0.5 mL/min,10 min一管分部收集,苯酚-硫酸法检测,合并峰位,冷冻干燥,得纯麦冬多糖。
1.3.2 纯度鉴定
凝胶柱层析:用 Sephadex G-100柱层析,去离子水洗脱,苯酚-硫酸法检测;光谱扫描:采用紫外光谱在 180~340 nm波长间扫描;薄层层析:展开剂为V(正丁醇):V(乙醇):V(水)=4∶1∶1,苯酚硫酸显色。
1.3.3 麦冬多糖的酶法水解
1.3.3.1 菌种的发酵及粗酶液制备[8]
液体培养基:取 10 g麦冬,粉碎后加去离子水100 mL,煮沸 1h,纱布过滤,反复提取 3次,减压蒸馏并定容至 100 mL。取 80 mL,5°麦芽汁和 20 mL麦冬粉末浸出液混匀制备培养基。
菌种发酵:取活化好的菌种斜面,用接种针在液体培养液中接菌 2~3环,置 30℃恒温培养箱中摇床振荡培养 6 d。
粗酶液制备:培养好的发酵液,用高速冷冻离心机在 4℃、8 000 r/min下离心 15 min,收集上清液。上清液在磁力搅拌条件下加入硫酸铵粉末调饱和度至 75%,放入 4℃冰箱静置 12 h。然后在 4℃、13 000 r/min下离心 20 min,取沉淀。将沉淀用 10 mL 0.02 mol/L、pH5.0的 HAc-NaAc缓冲液溶解,放入透析袋中,用同一缓冲液透析,每 4 h更换 1次缓冲液,透析 24 h。透析结束后,取出液体在 4℃、13 000 r/min下离心 10 min,取上清液,此即粗酶液。
1.3.3.2 麦冬多糖与生物酶反应
取 0.5 g纯麦冬多糖,用少量 0.02 mol/L、pH值5.0的 HAc-NaAc缓冲液充分溶解,定容到 50 mL,配制成质量浓度为 10 g/L的纯麦冬多糖溶液。与等体积的上述 1.3.3.1中制备的粗酶液混匀,在 40℃下反应 10 h。反应结束后,用 Sephadex G-100柱对酶解后产物进行分离。
1.3.4 相对分子质量的测定[9]
采用 Sephadex G-100和 Sephadex G-50柱层析法。用 DextranT-70、T-40、T-10和相对分子质量为7100的葡聚糖标准品,分别相继上 Sephadex G-100柱,分布收集,苯酚-硫酸法检测,做出洗脱曲线,求得洗脱体积Ve,然后将蓝色葡聚糖上同一根柱,求得柱的空体积Vo,最后做出Ve/Vo与相对分子质量对数的标准曲线,其回归方程为Y=-0.305 1X+5.546 3,R2=0.996 2(Y代表 lgMr,X代表Ve/Vo)。用相对分子质量分别为 7 100,4 600,2 500和 1 085的葡聚糖标准品,分别相继上 Sephadex G-50柱,方法同 Sephadex G-100柱,得到标准曲线,其回归方程为Y=-0.337 1X+5.269 5,R2=0.992 9。纯麦冬多糖及其酶解产物按同样条件上柱,即可测算出样品中每一组分多糖的相对分子质量。
1.3.5 单糖组成的分析[10]
取纯麦冬多糖及其酶解产物各 20 mg,分别加入2 mL 2 mol/L H2SO4溶液,100℃密封水解 12 h。反应结束后用 BaCO3中和,离心,取上清液,微孔滤膜过滤,取 20μL用于色谱分析。与标准单糖的 HPLC图谱比较,确定单糖组分。
色谱条件:色谱柱:Kromasil NH2(4.6×250 mm,5 μm);流动相 :乙腈 -水 (体积比 80∶20);流速 :1 mL/min;柱温:35℃;进样量:20μL;ELSD的漂移管温度90℃;氮气作载气;流速:1.5 mL/min;载气压力:0.1 MPa。
2 结果与分析
2.1 麦冬多糖的分离纯化及相对分子质量测定
纯麦冬多糖经 Sephadex G-100柱洗脱后,其洗脱曲线呈单一对称峰,结果见图1;紫外吸收光谱扫描结果无 260~280 nm范围内的吸收峰,表明该多糖中不含有蛋白质和核酸;与纯化前麦冬粗多糖进行 TLC比对,纯化后的多糖可以看到清晰的单一点,且没有拖尾现象,见图2。
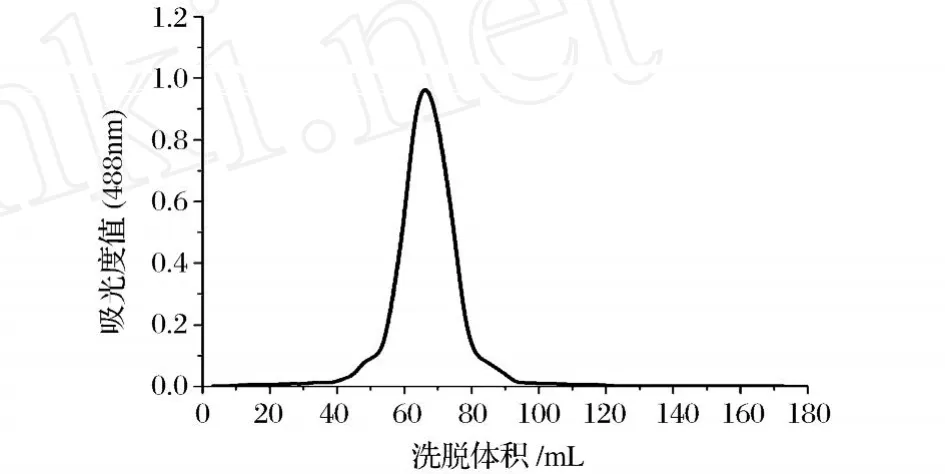
图1 Sephadex G-100分离纯麦冬多糖柱层析图谱
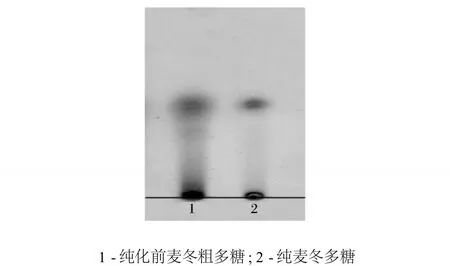
图2 麦冬多糖经 Sephadex G-100纯化前后 TLC图
由以上结果可以证明纯麦冬多糖是组分较为均一的多糖。由图1可知,纯麦冬多糖的洗脱体积Ve为 65.2 mL。通过方法 1.3.4中的回归方程求得纯麦冬多糖的相对分子质量为 48 347。
2.2 纯麦冬多糖酶解产物的分离
纯麦冬多糖经方法 1.3.3.2反应后,酶解产物用Sephadex G-100柱进行分离,苯酚-硫酸法检测,洗脱曲线见图3。
由图3可以看出,洗脱曲线出现了 3个洗脱峰,且都为单一对称峰,说明组分均一的纯麦冬多糖经Absidiasp.O8s菌株产生的酶水解后,得到 OP-1、OP-2、OP-3三种新组分,同时也表明,该酶能部分水解麦冬多糖。
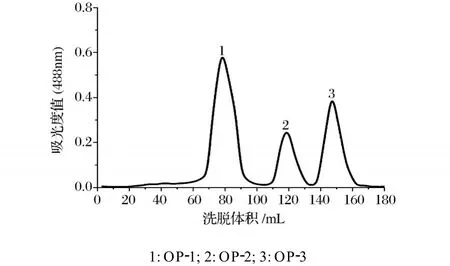
图3 Sephadex G-100分离麦冬纯多糖酶解产物柱层析图谱
2.3 OP-1、OP-2、OP-3相对分子质量的测定
OP-1、OP-2、OP-3经 Sephadex G-100柱洗脱后的洗脱体积Ve分别为 77.8 mL、119.4 mL和 147.2 mL。根据标准曲线所得回归方程,可得OP-1和OP-2的相对分子质量分别为 32 452和 9 231。
由于 Sephadex G-100凝胶柱的总体积Vt为146.9 mL,可知OP-3的相对分子质量不在分离范围之内。使用 Sephadex G-50柱测定 OP-3的相对分子质量,OP-3经 Sephadex G-50柱洗脱后的洗脱体积Ve为154.1mL。由标准曲线可计算得OP-3的相对分子质量为 1 354。
2.4 纯麦冬多糖及其酶解产物的单糖组成分析
5种标准单糖混合的 HPLC图谱见图4,与单一标准单糖的保留时间对照,可知图4中各峰所代表的单糖组分,结果见表1。
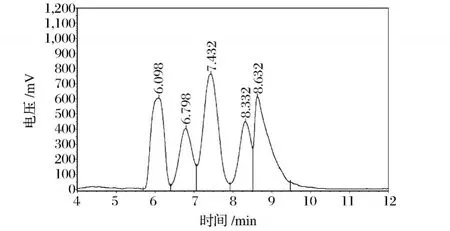
图4 混合标准单糖 HPLC图

表1 混合标准单糖 HPLC图解析
纯麦冬多糖及其酶解产物 OP-1、OP-2、OP-3经方法 1.3.5完全水解后,通过 HPLC分析,结果见图5。
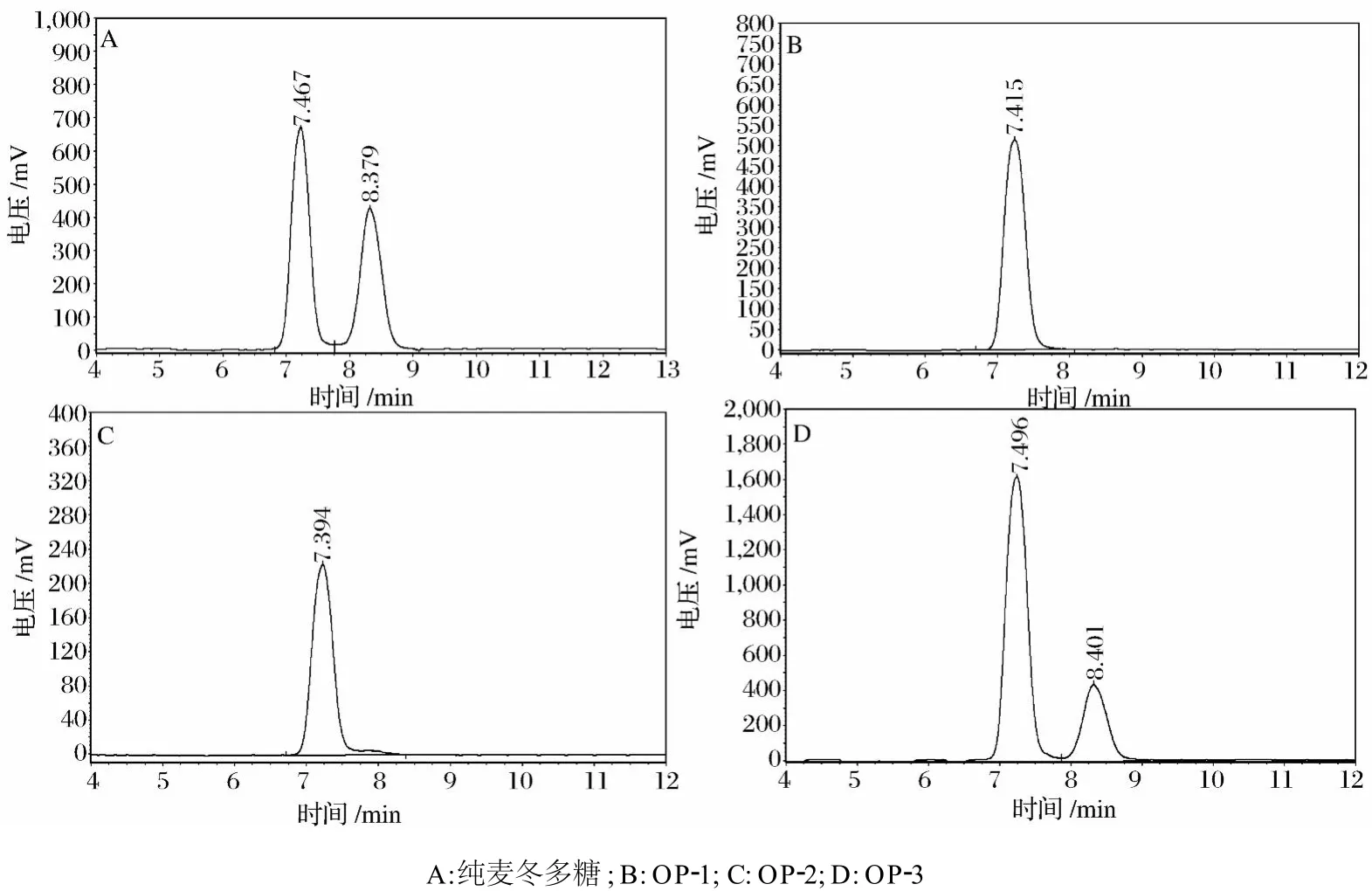
图5 多糖酸解产物的 HPLC图
纯麦冬多糖经完全酸解后,HPLC图谱显示出现 2个峰,保留时间分别是 7.496 min和 8.401 min,与标准品:果糖 (7.432 min)、葡萄糖 (8.332 min)的保留时间相近,说明纯麦冬多糖的单糖构成是果糖和葡萄糖。
OP-1和 OP-2酸解后,HPLC图谱均出现 1个峰,保留时间分别为 7.415 min和 7.394 min,与标准品果糖 (7.432 min)相近,说明 OP-1和 OP-2的单糖组成是果糖。
OP-3酸解后的 HPLC图谱显示出现 2个峰,保留时间分别是 7.467 min和 8.379 min,与标准品:果糖 (7.432 min)、葡萄糖 (8.332 min)的保留时间相似,说明OP-3的单糖组成也是果糖和葡萄糖。
3 结论
综合上述分析结果可知,相对分子质量为 48347的纯麦冬多糖经Absidiasp.O8s菌株产生的酶水解后,产物由 OP-1、OP-2、OP-3 3部分组成,相对分子质量分别为 32 452、9 231、1 354。HPLC分析结果表明 ,纯麦冬多糖的单糖组成为葡萄糖和果糖,其水解产物 OP-1、OP-2、OP-3三种组分的单糖组成分别为果糖、果糖、葡糖糖和果糖。结果说明,Absidiasp.O8s菌株产生的酶可以水解麦冬多糖,使相对分子质量较大的纯麦冬多糖降解,得到了相对分子质量小于 1万的多糖组分。从酶解产物的单糖组成初步可知,该酶能够水解麦冬多糖中的部分果糖糖苷键,有关具体糖苷键的键位断裂情况,还有待进一步研究。
[1] 余伯阳,徐国钧 .麦冬类中药的药源调查和商品鉴定[J].中国药科大学学报,1991,22(3):150-153.
[2] 程金波,卫洪昌,章忱,等 .麦冬提取物抗犬心肌缺血的药效学实验研究[J].中国病理生理杂志,2001,17(8):810-813.
[3] Kou J,Yu B,Xu Q.Inhibitory effects of ethanol extract from RadixOphiopogonjaponicuson venous thrombosis linked with its endothelium-protective and anti-adhesive activities[J].Vascul Pharmacol,2005,43(3):157-163.
[4] Junping Kou,Youqing Tian,Yunkit Tang,et al.Antithrombotic activities of aqueous extract from radixOphiopogon japonicusand its two constituents[J].Biol Pharm Bull,2006,29(6):1 267-1 270.
[5] KakoM,Miura T,UsamiM,et al.Hypoglycemic effect of the rhizomes of phiopogonis tuber in normal and diabetic mice[J].Biol Pharm Bull,1995,18(5):785-787.
[6] 王本祥 .现代中药药理与临床[M].天津:天津科技翻译出版公司,2004:744-752.
[7] 徐德生,冯怡,周跃华,等 .麦冬多糖中抗急性心肌缺血活性部位研究[J].中成药,2004,26(10):832-837.
[8] 薛冬令,韩祥,金凤燮,等 .麦冬多糖糖苷酶的分离纯化及其酶性质[J].大连工业大学学报,2009,28(04):235-238.
[9] 吴东儒 .糖类的生物化学 [M].北京:高等教育出版社,1987:124-135.
[10] Lin Xiao,XuDe-Sheng,Feng Yi,et al.Determination ofOphiopogon japonicuspolysaccharide in plas ma by HPLC with modified postcolumn fluorescence derivatization[J].AnalyticalBiochemistry,2005,342(2):179-185.
