壳聚糖山梨酸酯的合成、表征及抑菌活性研究*
2011-01-13冯永巍夏文水张威
冯永巍,夏文水,张威
壳聚糖是由氨基葡萄糖和 N-乙酰氨基葡萄糖通过β-1,4糖苷键连接而成的生物大分子聚合物,具有促进伤口愈合、降低胆固醇、抑制微生物生长等多种生理活性[1-3]。由于其低毒、生物可降解、能抑制多种微生物生长的特点,被视为开发高效、无毒新型食品防腐剂的理想基质。与目前广泛使用的食品防腐剂相比,壳聚糖的抑菌效果比较弱,达不到食品工业中防腐保鲜的要求,是限制其作为防腐剂在食品中应用的主要原因。通过化学改性的方法将强抑菌基团引入壳聚糖分子中提高其抑菌活性,拓宽其抑菌谱是解决这一问题的有效途径。国内外研究报道显示,壳聚糖季铵盐类衍生物、硫脲基衍生物,哌嗪类衍生物以及一些含氯衍生物都具有比壳聚糖更加优良的抑菌活性[4-7]。然而其引入的抑菌基团对人体具有潜在的危害和毒性,不适合在食品体系中应用。
赵希荣、冯永巍等人将对羟基苯甲酸、苯甲酸和富马酸等常用的食品防腐剂引入到壳聚糖分子中,合成了壳聚糖尼泊金酯、壳聚糖苯甲酸酯、壳聚糖富马酸酯等一系列的壳聚糖衍生物[8-9]。研究证明,这些衍生物的抑菌活性都远高于其母体壳聚糖。山梨酸同上述防腐剂相比防腐抗菌能力更强,并且作为一种不饱和脂肪酸进入人体后,参与人体的新陈代谢过程,代谢产物为二氧化碳和水,是一种国际公认安全(GRAS)的防腐剂。本研究拟通过化学改性的方法将山梨酸引入到壳聚糖分子中,制备一种更加安全高效的壳聚糖基食品防腐剂,为壳聚糖类防腐剂的分子设计和应用进行有益的探索。
1 材料与方法
1.1 材料与仪器
壳聚糖,脱乙酰度 (DD)=85%,相对分子质量 3×105,南通双林生物有限公司;营养肉汤、马铃薯培养基、琼脂,生化试剂;N,N-二甲基甲酰胺 (DMF)、山梨酸、甲烷磺酸、丙酮、氨水、乙醇等,均为分析纯 ,国药集团化学试剂有限公司;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcocus aureus)、黑曲霉(Aspergillus niger),均由江南大学食品学院微生物实验室提供。
SPX型智能生化培养箱,南京实验仪器厂;RW20 DZ M.n机械搅拌器,上海试验仪器有限公司;SHB-Ⅲ循环水多用真空泵,郑州长城科工贸有限公司;5DDXB FT-IR红外光谱仪,美国 Nicolet公司;Brucker ARX400核磁共振仪,德国 Brucker公司。
1.2 实验方法
1.2.1 山梨酰氯的制备
称取干燥的山梨酸 10 g,置于 100 mL三口烧瓶中,加入 SOCl230 mL和 2~3滴二甲基甲酰胺(DMF)。加热到 60~90℃回流 3 h。反应的尾气经过 CaCl2干燥管后用 20%NaOH吸收。无尾气生成表明反应已经结束。将反应液冷却至室温,进行减压蒸馏。真空度保持在 0.08 MPa,除尽未反应的SOCl2,继续蒸馏至 160℃得到黄色的油状液体为山梨酰氯。
1.2.2 壳聚糖山梨酸酯的合成
称取干燥的壳聚糖 1.7 g,加入 25 mL甲烷磺酸0~5℃不断搅拌 30 min。当壳聚糖完全溶解后,逐滴滴加与氨基葡萄糖单位摩尔比为 1∶1,1∶3,1∶5的山梨酰氯,剧烈搅拌反应 3 h,于 -18℃冷冻过夜。向反应液中加入大量丙酮以沉淀产物。用去离子水溶解沉淀,并用 1 mol/L氨水溶液调 pH值至 7.0,有沉淀析出。采用乙醇索氏抽提沉淀 24h,真空干燥,得到的淡黄色粉末为壳聚糖山梨酸酯。
1.2.3 衍生物的结构表征
1.2.3.1 FTI R光谱
KBr压片法,在 4 000~400 cm-1范围记录样品的 FITR图谱。
1.2.3.21H NMR光谱
1.2.3.3 DS的计算
衍生物的游离氨基含量和取代度,依据1H NMR图谱的数据,按照公式 (1),(2)计算
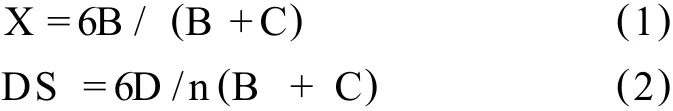
公式 (1),(2)中,DS:取代度;X:游离氨基比例;B:氨基葡萄糖单位 H-1的积分面积;C:乙酰氨基葡萄糖单位上 H-2和氨基葡萄糖单位上 H-3,4,5,6)积分面积;D:取代基上各个 H积分面积;N:取代基上氢的个数。
1.2.4 抑菌活性的研究
1.2.4.1 抑菌剂溶液的制备
将壳聚糖及其衍生物分别溶解在 1%的乙酸溶液中制成浓度为 25 g/L的抗菌剂溶液备用。1.2.4.2 初始菌液的制备
将活化好的大肠杆菌、金黄色葡萄球菌的菌液用生理盐水稀释至浓度 107CFU/mL,作为初始菌液。1.2.4.3 霉菌孢子悬液的制备
将活化好的黑曲霉菌种接入三角瓶中,瓶中预先放入少量玻璃珠和经过灭菌的生理盐水。用力振荡后,过滤菌液,再用生理盐水稀释至浓度 106CFU/mL,即为霉菌孢子悬浮液
1.2.4.4 细菌抑菌率的测定
将 1 mL的初始菌液与 98 mL灭菌后的营养肉汤培养混合,再向其中加入 1 mL抑菌剂溶液,以 1 mL 1%乙酸溶液代替抑菌剂溶液作为空白,37℃振荡培养。每隔 1 h取出 1 mL培养液,倍比稀释后涂布平板法计算菌落数,重复 3次。按照公式 (3)计算抑菌率 (η)。

公式中(3)中,N1:空白的中的菌落数;N2:含药培养液中菌落数。
1.2.4.5 霉菌的抑菌率的测定
将 1 mL黑曲霉孢子悬浮液液加入到 100 mL灭菌后马铃薯培养基中,再分别加入 1 mL抑菌剂溶液,以 1 mL 1%乙酸溶液代替抑菌剂溶液作为空白在30℃培养振荡培养,每隔 6h取出 1 mL培养液,用布氏漏斗抽滤。收集菌丝体,洗净,置烘箱中烘千后称重,重复 3次。按照公式 (4)计算抑菌率 (η)。
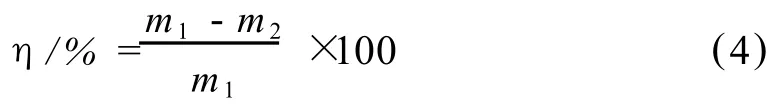
公式 (4)中,m1:空白培养液中菌丝重量;m2:含药培养液中菌丝质量。
1.2.4.3 最小抑菌浓度 (M IC)的测定
采用二倍稀释法[10],将抑菌剂入培养基中制成浓度 1.0,0.5,0.25,0.12 5,0.062 5 g/L的含药琼脂平板。将 0.1 mL初始菌液或孢子悬浮液涂布在平板表面,细菌 37℃培养 72h无菌落生长;霉菌 30℃培养3d,无菌丝体生长时的最低的浓度为最小抑菌浓度。
2 结果与讨论
2.1 产物的表征
2.1.1 FTIR表征

图1 壳聚糖和壳聚糖山梨酸酯的 FTIR光谱
图1 为壳聚糖和壳聚糖山梨酸酯的 FTIR图谱。在壳聚糖的 FTIR图谱中,3 430 cm-1处的宽峰可归属为壳聚糖分子中大量存在的—OH和—NH2所形成氢键的振动吸收,1 665 cm-1处和 1 597 cm-1处的吸收峰分别为酰胺 I和 NH2的特征吸收。与壳聚糖相比,壳聚糖山梨酸酯的 FTIR图谱在 1710 cm-1处出现了一个新吸收峰可归属为不饱和羰基伸缩振动,1 642 cm-1处的新峰为山梨酸分子中位 C=C键的特征吸收,1 595 cm-1处 NH2的特征吸峰仍然存在。综合以上结果可以认为,山梨酰氯与壳聚糖的羟基发生了酯化反应形成一个新的酯键,反应活性更强的氨基在反应中得到了较好的保护。
2.1.21H NMR表征
图2是壳聚糖山梨酸酯的 1HNMR图谱。各吸收峰的化学位移和归属如下:δ=1.82 ppm(s,CH3,H-8);δ=2.24 ppm(s,NHAc,H-7);δ =3.42 ppm(br s,H-2 of GlcN residue H-2);δ=3.63-4.39 ppm(brm,H-3,4,5,6 of GlcN unit);δ=5.02 ppm(br s,H-1 of GlcN residue);δ=5.8 ppm(br,CH,H-9);δ=6.38-6.82 ppm(br,CH=CH,H-10、H-11);δ=7.8ppm(br,CH,H-12)。
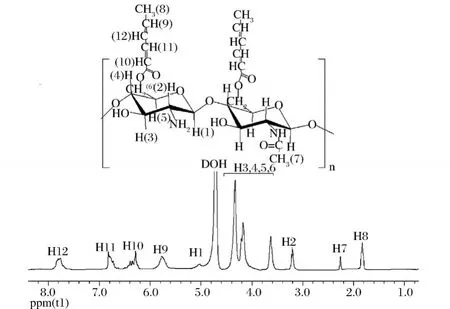
图2 壳聚糖山梨酸酯的1H NMR图谱
壳聚糖山梨酸酯衍生物的取代度和游离氨基含量见表1。从表1中看出,衍生物的取代度随山梨酰氯比例的增加而增加。当反应物摩尔比为 1∶5时,取代度接近 2,意味着壳聚糖 C-3位和 C-6位的-OH均发生了酯化。此外,各取代度的衍生物游离氨基含量基本上与母体壳聚糖相同,说明反应主要发生在壳聚糖的羟基,氨基仍以游离形式存在,与红外表征的结果一致。壳聚糖是大分子聚合物,由于分子中羟基和氨基之间的氢键作用,形成致密牢固的结晶结构,不易发生化学反应。壳聚糖在甲烷磺酸中溶解,分子链呈舒展状态,易于酰化反应的进行,并获得高取代度的产物。反应中甲烷磺酸既作为溶剂和催化剂,又与壳聚糖的游离氨基形成弱盐,阻止了山梨酰氯对氨基的进攻,使得酰化反应主要发生在壳聚糖的羟基。[10]赵希荣等采用邻苯二甲酸酐与壳聚糖的氨基反应生成一个中间产物,酯化反应结束后,再用水合肼除出邻苯二甲酸酐,得到壳聚糖选择性羟基酯化的产物[8]。与之相比壳聚糖在甲烷磺酸体系中直接选择性羟基酯化,步骤简单,效率更高。

表1 山梨酸壳聚糖酯的取代度和游离氨基含量
2.2 壳聚糖山梨酸酯的抑菌活性研究
2.2.1 壳聚糖山梨酸酯的抑制细菌活性
壳聚糖与壳聚糖山梨酸酯对大肠杆菌和金黄色葡萄球菌的抑菌率分别见图3和图4。
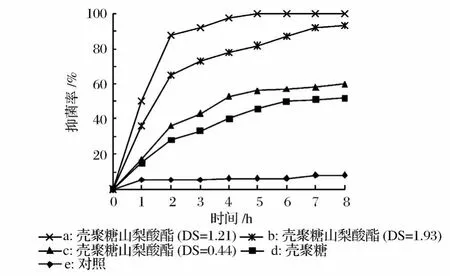
图3 壳聚糖与壳聚糖山梨酸酯对大肠杆菌的抑制率
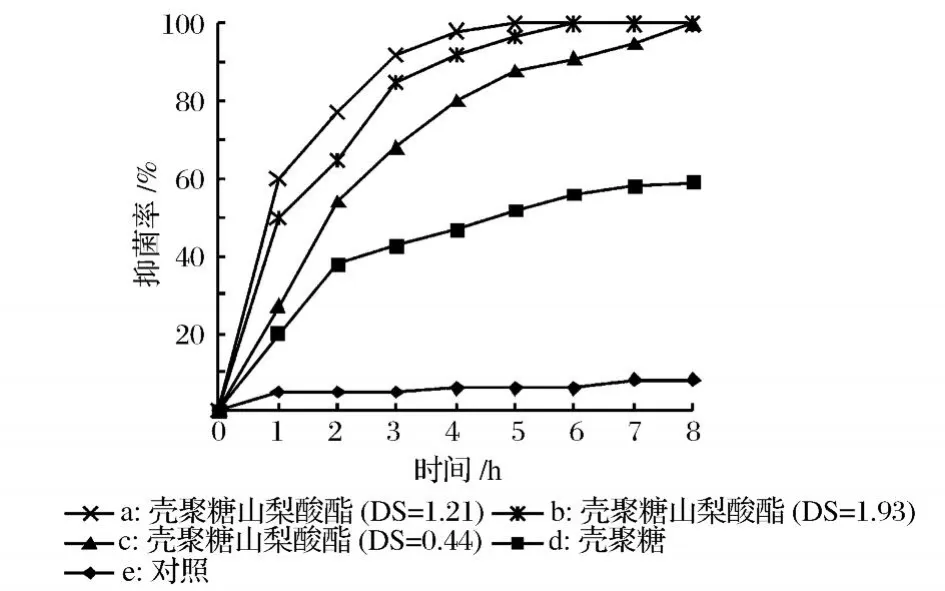
图4 壳聚糖与壳聚糖山梨酸酯对金黄色葡萄球菌的抑制率
从图3中可以看出,壳聚糖对大肠杆菌的生长有一定抑制作用,培养 8h后抑制率可达到 50%。不同取代度壳聚糖山梨酸酯对大肠杆菌的抑制作用均强于壳聚糖,其抑菌活性的强弱的顺序为 a>b>c。取代度为 1.21的壳聚糖山梨酸酯的抑菌活性最高,培养 2 h抑菌率就可以达到 88%,培养 5h即可完全抑制大肠杆菌的生长。壳聚糖氨基携带的正电荷可与微生物细胞表面携带的负电荷发生相互作用,引起细胞内容物泄露,是壳聚糖抑制微生物生长的作用机理。山梨酸与壳聚糖的羟基发生酯化反应,在保留了壳聚糖的活性氨基的同时形成了一个了α,β-不饱和的羰基结构,这是一种具有高效抑菌活性的化学结构,因而提高了壳聚糖的抑菌性。随着取代度的增加,衍生物的抑菌活性也随之增强。值得注意的是:当取代度为 1.93时,抑菌活性反而有所下降,这可能是因为山梨酸是疏水性物质,当取代度接近 2时,糖环上的亲水性的羟基都被取山梨酸所酯化,致使衍生物的疏水性过大,不利于衍生物与水相中微生物的之间的接触;另一方面高取代度也可能导致衍生物抑菌基团周围空间位阻的增加,影响其发挥抑菌作用。图4中可以看出,衍生物对金黄色葡萄球菌抑菌活性随取代度变化的规律与大肠杆菌相类似。此外,衍生物对金黄色葡萄球菌的抑制活性要略强于大肠杆菌,各取代度的衍生物在 8h内都可以完全抑制金黄色葡萄球菌的生长。
2.2.2 壳聚糖山梨酸酯的抑制霉菌活性
壳聚糖及壳聚糖山梨酸酯对黑曲霉的抑菌率见图5。
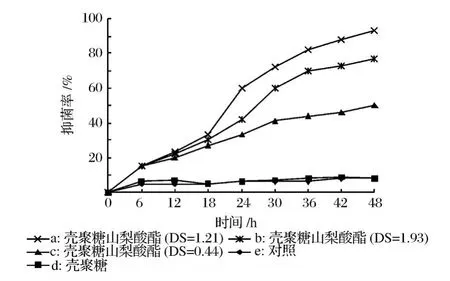
图5 壳聚糖与壳聚糖山梨酸酯对黑曲霉菌的抑制率
从图5中可以看出,壳聚糖对黑曲霉的基本没有抑制作用。而各取代度的衍生物都对黑曲霉有比较强的抑制作用。抑菌活性的强弱的顺序为 a>b>c。许多真菌的细胞壁成分中都含有壳聚糖的前提甲壳素,对壳聚糖的抑制作用表现出一定的抗性。在试验中也得到了相同的结果。相反,山梨酸是一种很强的防霉剂,通过酯化反应引入到壳聚糖分子中大大提高了壳聚糖对黑曲霉的抑制活性。取代度 1.21的衍生物在培养 24 h后对黑曲霉的抑菌率可达到 60%。48 h后可完全抑制黑曲霉的生长。
2.2.2 壳聚糖山梨酸酯对 3种微生物的M I C
壳聚糖及壳聚糖山梨酸酯 (DS=1.21)对 3种微生物的M IC值见表2。从表2中可以看出,壳聚糖山梨酸酯(DS=1.21)的对大肠杆菌和金黄色葡萄球菌都是 0.125 g/L。仅为壳聚糖的M IC值的 1/4。在试验浓度下,未检出壳聚糖对黑曲霉的最小抑菌浓度,而壳聚糖山梨酸酯 (DS=1.21)对黑曲霉的最小抑菌浓度为 0.5 g/L。Kanatt等通过美拉德反应制备了壳聚糖葡萄糖衍生物,其对食品中的致病细菌的M I C为 0.05%,该衍生物可以延长冷冻肉类的贮藏期 3周[11]。于沛沛合成的壳寡糖苯甲酸酯,对大肠杆菌的M I C为 0.02%~0.04%金黄色葡萄球菌的M I C为0.02%~0.29%。对黑曲霉菌的 M IC为 0.2%[12]。赵希荣合成的壳聚糖尼泊金酯对大肠杆菌和金黄色葡萄菌的M I C分别为 0.025%和 0.01%在牛奶和果汁制品中添加都可以显著提高其保质期。相比以上几种衍生物壳聚糖山梨酸酯的最小抑菌浓度更低,也就是说其对微生物的抑制活性也更强,更加具备作为食品防腐剂的应用潜力。
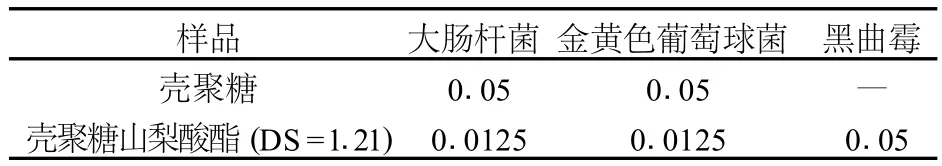
表2 壳聚糖与壳聚糖山梨酸酯对 3种微生物的M IC
3 结论
本研究采用甲烷磺酸为催化剂和氨基保护剂,酯化合成羟基取代的壳聚糖山梨酸酯。抑菌实验结果表明衍生物的对大肠杆菌、金黄色葡萄球菌和黑曲霉的抑制作用由强到弱依次为:壳聚糖山梨酸 (DS=1.21)>(DS=1.93) >(DS=0.44)。取代度为1.21的衍生物对 3种微生物的最小抑菌浓度分别为0.125、0.125和 0.5 g/L。该衍生物不仅提高的壳聚糖的抑菌活性,同时也扩大了壳聚糖的抑菌谱。
[1] KumarM N V R,Muzzarelli R A A,Muzzarelli,et al.Chitosan Chemistry and Pharmaceutical Perspectives[J].Chemical Reviews,104(12),6 017-6 084.
[2] Pamela J V,Howard W TM,Stephen,et al.Evaluation of the biocompatibility of a chitosan scaffold in mice.(Vol.59,pp.585-590).
[3] Chien P J,Sheu F,Yang F H.Effects of edible chitosan coating on quality and shelf life of sliced mango fruit[J].Journal of Food Engineering,2007,78(1):225-229.
[4] Runarsson O V,Holappa J,Malainer C,et al.Antibacterial activity of N-quaternary chitosan derivatives:Synthesis,characterization and structure activity relationship(SAR) investigations[J]. European Polymer Journal,2010,46(6):1 251-1 267.
[5] MassonM,Holappa J,HjalmarsdottirM,et al.Antimicrobial activity of piperazine derivatives of chitosan[J].Carbohydrate Polymers,2008,74(3):566-571.
[6] Zhong ZM,Xing R E,Liu S,et al.Synthesis of acyl thiourea derivatives of chitosan and their antimicrobial activitiesin vitro[J].Carbohydrate Research,2008,343(3):566-570.
[7] LiR.Synthesis,characterization,and antifungal activityof N,O-(acyl)-N-(trimethyl)chitosan ammonium chloride.Carbohydrate Research[J].In Press,Accepted Manuscript.
[8] 赵希荣.壳聚糖防腐剂的研究 [D].无锡:江南大学食品学院,2006.
[9] Feng Y,XiaW.Preparation,characterization and antibacterial activity of water-soluble O-fumaryl-chitosan[J].Carbohydrate Polymers,2011,83(3):1169-1173.
[10] 蒋挺大.甲壳素 [M].北京:化学工业出版社,2003:36-38.
[11] Kanatt S R,Chander R,Shar ma A.Chitosan glucose complex-A novel food preservative[J].Food Chemistry,2008,106(2):521-528.
[12] 于沛沛.苯甲酸壳聚糖酯的合成及其抑菌性能研究[D].无锡:江南大学食品学院,2009.
