创伤弧菌溶细胞素融合蛋白诱导人Jurkat-T淋巴细胞凋亡的研究
2011-01-13姚蔚谢旦立郭雅君楼永良
姚蔚,谢旦立,郭雅君,楼永良
(温州医学院 检验医学院,浙江 温州 325035)
创伤弧菌溶细胞素融合蛋白诱导人Jurkat-T淋巴细胞凋亡的研究
姚蔚,谢旦立,郭雅君,楼永良
(温州医学院 检验医学院,浙江 温州 325035)
目的:探讨创伤弧菌溶细胞素融合蛋白(rVvhA)对人Jurkat T淋巴细胞凋亡的作用及凋亡过程中Caspase-3酶活性的变化。方法:利用基因工程方法体外表达、制备和纯化rVvhA;MTT法检测rVvhA对Jurkat T淋巴细胞的细胞毒活性影响;Annexin-V/PI双染流式细胞仪检测rVvhA诱导Jurkat T淋巴细胞凋亡情况;Hochest33258荧光染色激光共聚焦显微镜观察rVvhA诱导Jurkat T细胞核形态的改变;分光光度法检测凋亡过程中Caspase-3酶活性的变化。结果:纯化复性后rVvhA的纯度达到92%以上;MTT结果显示rVvhA活性蛋白能显著抑制Jurkat T淋巴细胞的生长,有效浓度为1.5 HU/mL;流式细胞仪和激光共聚焦检测发现rVvhA作用后Jurkat T淋巴细胞核固缩,产生亮蓝荧光,1.5 HU/mL rVvhA,作用4 h后即可有效诱导其凋亡,凋亡率为(39.13±3.33)%,对照组为(3.43±0.34)%,且能被Caspase全酶抑制剂一定程度抑制。1.5 HU/mL rVvhA作用Jurkat T淋巴细胞3 h,Caspase-3酶活性达到高峰。结论:rVvhA能损伤人Jurkat T淋巴细胞,诱导其发生细胞凋亡,Caspase-3可能在rVvhA诱导的Jurkat T细胞凋亡过程中起重要作用。
创伤弧菌溶细胞素;人Jurkat T淋巴细胞;细胞凋亡
创伤弧菌是一种革兰染色阴性的嗜盐性条件致病菌,对人类危害较大,感染后致死率达75%[1]。肝病患者等免疫功能低下的人群是其感染致病的主要高危人群。创伤弧菌感染后,短时间内就会引起伤口炎症,严重时会导致败血症的发生。在该菌诸多的毒力因子中,创伤弧菌溶细胞素作为唯一分泌至胞外具有该菌种属特异性的外毒素,是创伤弧菌感染的重要毒力因子之一。我们前期工作已证实了创伤弧菌溶细胞素融合蛋白rVvhA能诱导人ECV-304细胞凋亡和SMMC7721人肝癌细胞TNF-α、HSP90等炎症因子基因的表达[1]。T淋巴细胞作为机体免疫系统的重要组成部分,对机体免疫系统的平衡、监控及抵御外界感染具有重要作用。综合国内外研究,本实验以人Jurkat T淋巴细胞为模型,通过研究创伤弧菌溶细胞素融合蛋白rVvhA对T细胞损伤的影响,对于了解创伤弧菌溶细胞素与T淋巴细胞间的作用、创伤弧菌感染时对T淋巴系统的影响以及创伤弧菌感染败血症的致病机制都具有积极意义。
1 材料和方法
1.1 材料
1.1.1 质粒、菌株与红细胞:大肠杆菌(E.coli)表达菌BL21(DE3)、重组表达载体pET28a(+)-vvhA由课题组保存及构建,人急性淋巴性白血病Jurkat T淋巴细胞株由浙江省医学遗传学重点实验室提供。1.1.2 主要试剂与试剂盒:Ni2+-NTA亲和层析柱购自上海申能生物科技有限公司;异丙基硫代β-D-半乳糖苷(IPTG)购自宝生物工程(大连)有限公司;还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSH)、盐酸胍均购自BBI公司;RPMI1640液体培养基购于美国Hyclone公司;细胞凋亡检测试剂盒、Caspase全酶抑制剂(Z-VAD-FMK)、MTT细胞毒性与增殖检测试剂盒均购于碧云天生物技术研究所;羊抗鼠多克隆抗体购于北京天根生物技术有限公司。膜联蛋白(Annexin)V-488/PI凋亡检测试剂盒、Caspase-3分光光度法检测试剂盒均购于南京凯基生物技术有限公司。优级胎牛血清购于杭州四季青生物工程材料有限公司。
1.2 方法
1.2.1 创伤弧菌溶细胞素融合蛋白的表达、纯化、复性及鉴定:参照文献[7]进行,终浓度为0.5 mmol/L的IPTG诱导E.coliBL21(DE3)表达rVvhA,超声破碎菌体分离粗提包涵体,经三步洗涤,Ni2+-NTA亲和层析柱梯度洗脱纯化。纯化后用复性液[55 mmol/L Tris-HCl(pH 6.0)、10.56 mmol/L NaCl、550 mmol/L精氨酸、0.44 mmol/L KCl、550 mmol/L盐酸胍、1.1 mmol/L EDTA(pH 8.0)、440 mmol/L蔗糖、GSH:GSSH=10:1]结合分步透析法对rVvhA进行复性。
1.2.2 人Jurkat T淋巴细胞的培养传代:Jurkat T淋巴细胞培养于含10%胎牛血清、1%青/链霉素的RPMI1640培养液中,置于37 ℃、5% CO2饱和湿度的细胞培养箱中培养,每2~3 d换液传代。
1.2.3 MTT法测定Jurkat T细胞的增殖抑制率:选择对数生长期Jurkat T淋巴细胞,接种于96孔培养板,调整细胞浓度为5×104/mL,每孔100μL,分别加入终浓度为0.5、1.0、1.5、2.0、2.5 HU/mL的rVvhA活性蛋白,以未加rVvhA处理的细胞为对照组,置37 ℃、5% CO2条件培养4 h。加入10 mL MTT(5 mg/mL),37 ℃继续培养4 h后,将96孔板11000 r/min离心5 min,小心吸弃培养液上清,每孔加入100 mL DMSO溶解formazon。检测各孔570 nm吸光度值(每一组设3个重复孔),以表示细胞的存活情况。
1.2.4 Annexin-V/PI双染检测细胞凋亡:无血无抗RPMI1640预处理Jurkat T淋巴细胞24 h。进行实验分组,分别为培养液对照组、0.5 HU/mL rVvhA处理组、1.0 HU/mL rVvhA处理组、1.5 HU/mLrVvhA处理组、1.5 HU/mL+20μL Z-VAD-FMK处理组(ZVAD-FMK预处理Jurkat T淋巴细胞1 h),作用4 h后,收集不同处理组细胞。用预冷的PBS洗涤细胞2次,将细胞重悬于Binding Buffer中,依次加入5 mL 膜联蛋白(Annexin)V-488及5 mL PI,混匀,室温避光反应15 min,1 h内用流式细胞仪检测各组细胞凋亡率。
1.2.5 Hochest33258荧光染色观察细胞核形态:Jurkat T淋巴细胞先用无血无抗RPMI1640预处理培养24 h。将细胞分为对照组、1.5 HU/mL rVvhA组、Caspase全酶抑制剂预处理组。作用4 h后,收集不同处理组细胞,PBS洗涤,按Hochest33258细胞凋亡检测试剂盒操作说明进行细胞荧光染色。染色结束后,用PBS洗涤细胞,小心涂片,并用抗荧光猝灭封片液封片,使用激光共聚焦显微镜(×200)观察细胞凋亡的细胞核形态。
1.2.6 分光光度法检测Caspase-3活性变化:收集时间点为0、1、2、3、4 h对照组与浓度为1.5 HU/mL rVvhA处理组的Jurkat T淋巴细胞,PBS洗涤细胞2次,将细胞密度调整为5×106个/组。在收集的沉淀细胞中加入50 mL冰冷Lysis Buffer(使用前每50 mL Lysis Buffer加入0.5 mL DTT),吹打均匀。按照Caspase-3检测试剂盒说明书进行操作。处理后的样品加样于96孔板,酶标仪检测λ=405 nm时的吸光值(OD)。通过计算ODrVvhA处理组/OD阴性对照来确定凋亡诱导剂组Caspase-3活化程度。以上实验重复3次。
1.3 统计学处理方法 采用SPSS16.0软件进行统计学分析。多组间比较采用单因素方差分析,组内两两比较采用LSD方法。
2 结果
2.1 rVvhA包涵体的复性 纯化后的rVvhA包涵体经复性液复性结合透析复性后,复性率可达18%,复性后蛋白的分子量约为54 kDa。BandScan V5.0软件分析后,复性后经丙酮浓缩,蛋白的纯度达92%以上(见图1)。
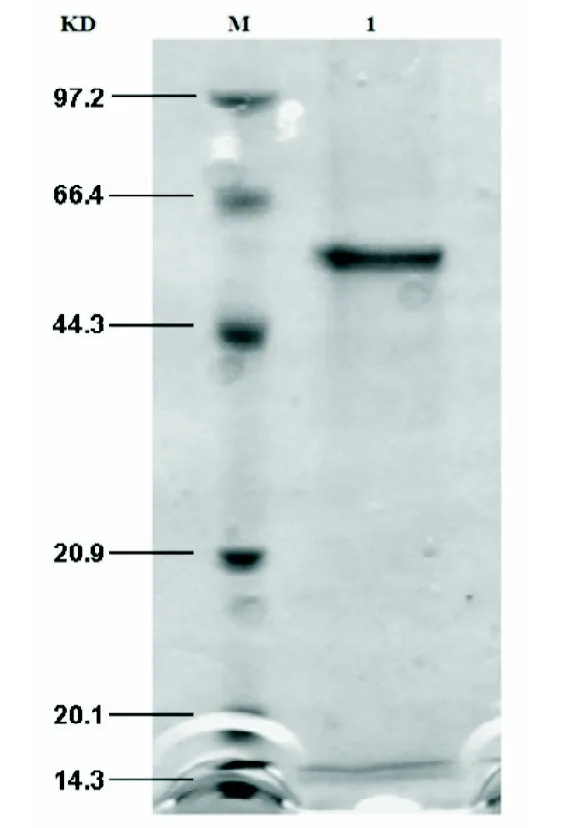
图1 复性后rVvhA SDS-PAGE分析图
2.2 Jurkat T细胞存活率结果 人Jurkat T淋巴细胞经不同浓度rVvhA活性蛋白作用4 h后,利用MTT法检测吸光度值(见图2),细胞的存活率以蛋白作用组细胞和对照组细胞吸光度平均值的比值来表示。从图2可知,不同浓度的rVvhA活性蛋白作用Jurkat T细胞后,与对照组相比,0.5 HU/mL rVvhA作用组差异无统计学意义(P>0.05),1、1.5、2、2.5 HU/mL组间差异均有统计学意义(P<0.05)。Jurkat T细胞被2.0 HU/mL rVvhA作用后,细胞的存活率小于50%。
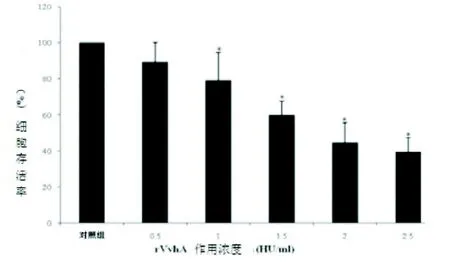
图2 rVvhA活性蛋白对Jurkat T淋巴细胞存活率的影响
2.3 流式细胞仪检测细胞凋亡率 Annexin-V和PI双染后,通过流式细胞仪检测不同浓度rVvhA作用4 h后细胞凋亡的情况(见图3-4)。从图3-4可知,0.5 HU/mL rVvhA作用组与对照组比,差异无统计学意义。1、1.5 HU/mL rVvhA处理后,凋亡率分别为(21.60±2.17)%、(39.13±3.33)%,且呈剂量依赖性。20μmol/L Z-VAD-FMK预处理细胞后,细胞凋亡率与1.5 HU/mL rVvhA处理组相比,明显下降,差异有统计学意义(P<0.05)。
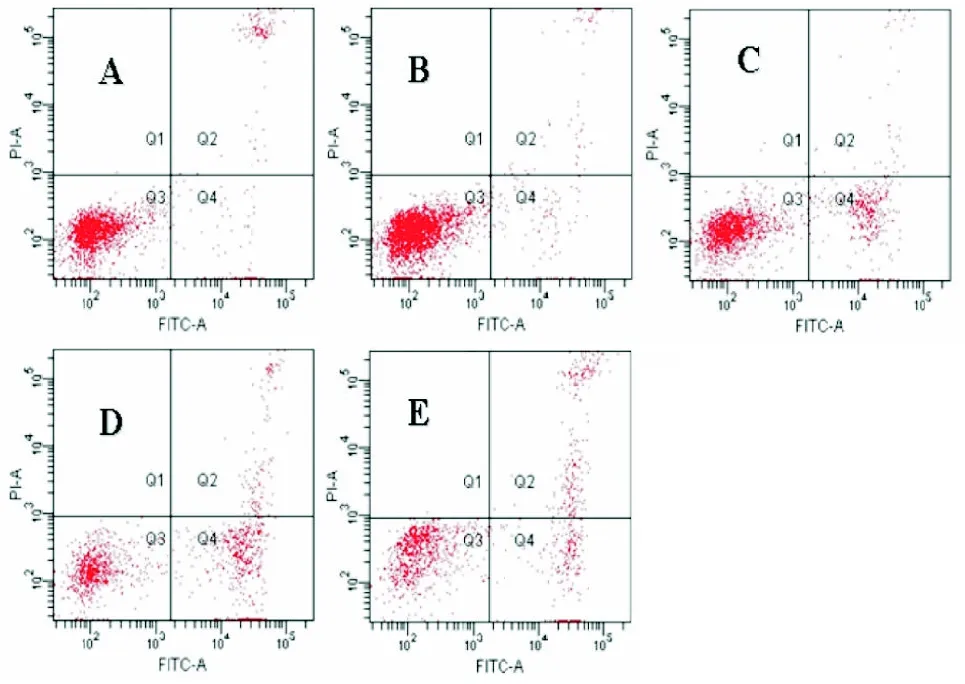
图3 不同浓度rVvhA作用Jurkat T淋巴细胞经膜联蛋白V-488和PI双染后流式凋亡检测结果
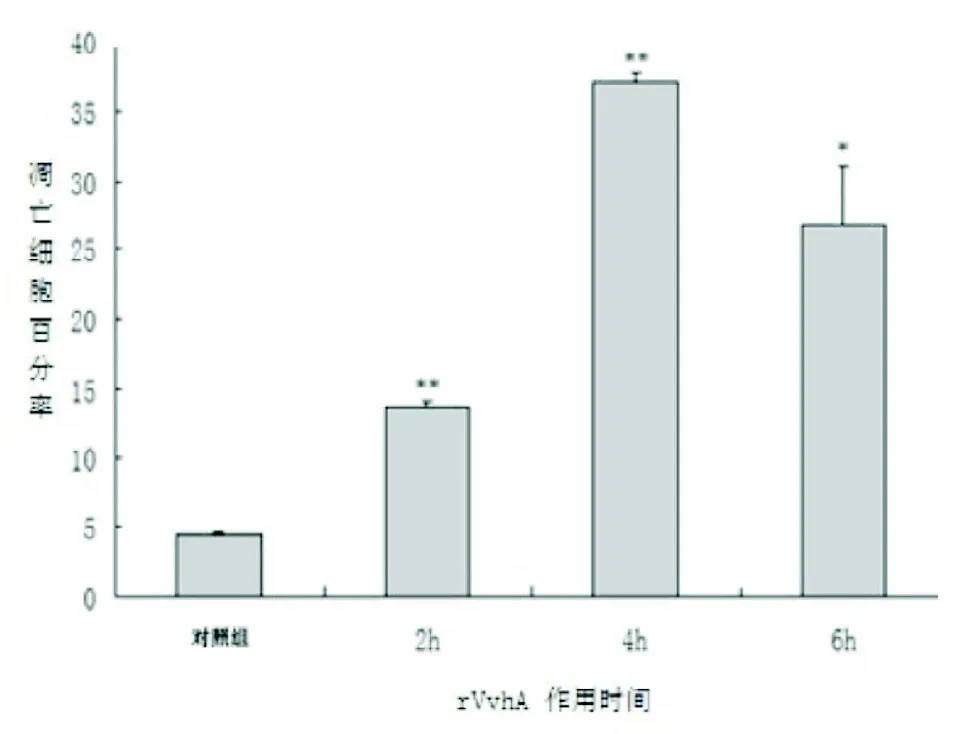
图4 不同浓度rVvhA作用Jurkat T淋巴细胞流式检测凋亡分析图
2.4 rVvhA对Jurkat T细胞核形态的影响 Hochest33258荧光染色后(见图5),正常细胞核呈弥散均匀的蓝色荧光,呈圆形,染色质分布均匀。1.5 HU/mL rVvhA处理组出现细胞核致密固缩,破裂块状,发亮蓝(或发白)荧光染色等凋亡核形态变化。Caspase全酶抑制剂预处理组中,其亮蓝荧光细胞数目有所下降。Caspase全酶抑制剂对rVvhA诱导Jurkat T淋巴细胞凋亡具有一定的抑制作用。
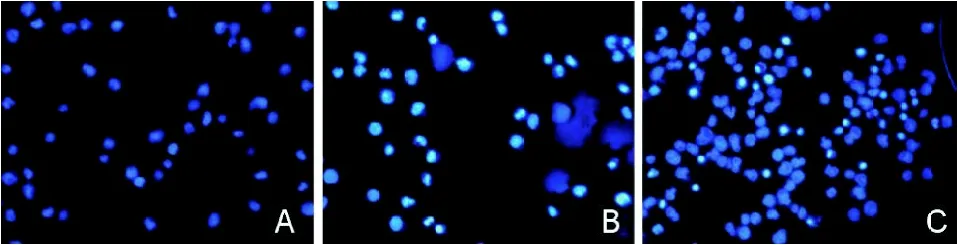
图5 rVvhA作用Jurkat T淋巴细胞4 h后Hochest33258染色结果(×200)
2.5 rVvhA诱导Jurkat T淋巴细胞凋亡过程中Caspase-3活性变化 图6所示,经1.5 HU/mL rVvhA处理Jurkat T淋巴细胞1 h后,Caspase-3活性相比对照组逐渐开始升高。在作用时间4 h内,Caspase-3活性于3 h时达高峰,与对照组比,差异有统计学意义(P<0.05)。
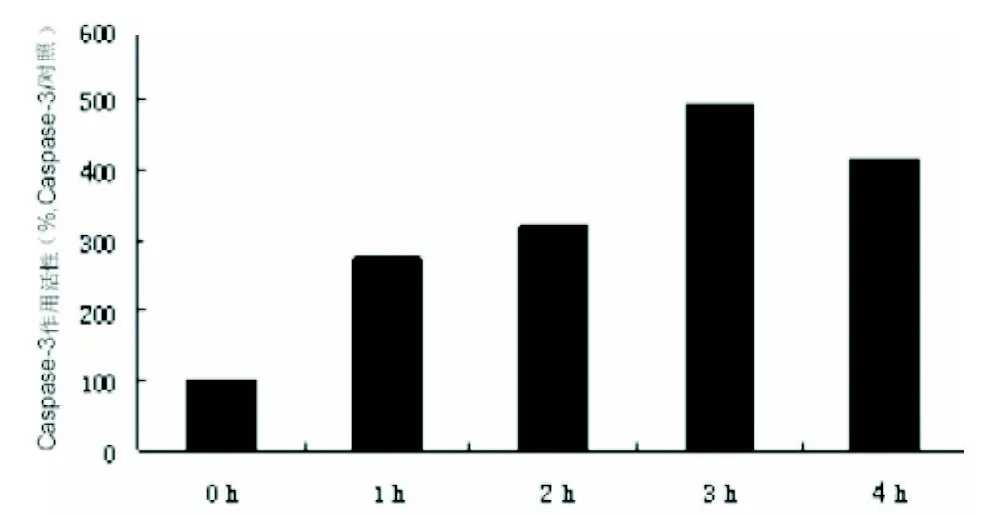
图6 不同时间rVvhA对Jurkat T细胞Caspase-3酶活性的影响
3 讨论
创伤弧菌溶细胞素已被证实对多种哺乳动物细胞具有细胞毒作用,如血管内皮细胞、红细胞、血管平滑肌细胞、巨噬细胞等。前期的工作,我们已证实体外表达的rVvhA溶血活性为0.2μg/HU[1]。创伤弧菌感染能引起严重的原发性败血症,到目前为止,该溶细胞素对淋巴细胞损伤及损伤机制目前尚未明确。Kim等[5]以Jurkat T淋巴细胞株为例,证实创伤弧菌能通过ROS升高和激活MAPK信号通路杀伤人Jurkat T淋巴细胞,但并未涉及具体创伤弧菌哪些致病因子与其杀伤Jurkat T淋巴细胞有关。本课题组已证实体外重组的创伤弧菌溶细胞素亦能引起人ECV304细胞发生凋亡[2]。本实验结果发现体外重组的创伤弧菌溶细胞素rVvhA对人Jurkat T淋巴细胞有明显的细胞毒性,可抑制其生长;4 h的中效浓度(effective concentration for 50%inhibition,EC50)为1.5 HU/mL,低于此浓度时生长抑制不明显,而高于该浓度时,细胞生长受到显著抑制。因此,我们选用此浓度作用人Jurkat T淋巴细胞。在本实验中,经1.5 HU/mL rVvhA处理人Jurkat T淋巴细胞4 h后,经Hoechst33258荧光染色可观察到明显的细胞凋亡的核形态学改变(核固缩、染色质聚集、边缘化等),流式细胞仪检测其诱导的细胞凋亡率为(37.10±0.70)%,说明1.5 HU/mL rVvhA作用浓度较合适诱导人Jurkat T淋巴细胞凋亡。Caspase全酶抑制剂能一定程度抑制由rVvhA诱导的Jurkat T淋巴细胞凋亡,rVvhA诱导的Jurkat T细胞凋亡可能亦于Caspase家族有关。因此,我们推测,创伤弧菌溶细胞素可能是创伤弧菌杀伤T淋巴细胞、Jurkat T淋巴细胞的重要致病因子,可直接参与创伤弧菌对T淋巴细胞的杀伤。
研究表明多种基因参与细胞凋亡的调控,而Caspase蛋白的表达是各种细胞凋亡机制的最后共同通路。在细胞凋亡的信号传递中,Caspase家族居于重要地位, 激活的Caspase可以水解包括细胞调节、细胞信号转导、DNA修复等环节中重要的蛋白, 从而使细胞表现为凋亡特有的形态学及生化特征:细胞皱缩、断裂,染色质聚集,DNA降解等。Caspase处于凋亡诱导信号传递、Caspase级联反应、下游效应因子作用这一凋亡过程中的中心位置。目前认为,在Caspase家族中,Caspase-1、Caspase-11和Caspase-4被认为不直接参与凋亡信号转导,它们主要参与白介素前体的活化;而Caspase-2,Caspase-8,Caspase-9和Caspase-10参与细胞凋亡的起始;参与执行的是Caspase-3,Caspase-6和Caspase-7。故我们利用分光光度法检测rVvhA诱导的Jurkat T淋巴细胞凋亡中Caspase-3的活化情况,以进一步明确和了解创伤弧菌溶细胞素对人Jurkat T淋巴细胞凋亡的影响。本实验发现,当1.5 HU/mL rVvhA作用Jurkat T细胞3 h后,Caspase-3活性达到峰值。
本实验证实并发现,创伤弧菌溶细胞素能直接杀伤Jurkat T淋巴细胞。实验中利用1.5 HU/mL rvvhA 3~4 h,既能引起Jurkat T细胞发生明显的凋亡反应,Caspase-3的酶活性达到峰值,其杀伤效果与杀伤HUVEC及ECV304相比,对淋巴细胞显得更为敏感。因此,我们推断溶细胞素对靶细胞的杀伤可能存在组织细胞特异性,可能与其致病时菌株攻击的靶器官或临床症状相关。而淋巴细胞亦可能是创伤弧菌攻击的重要靶细胞。此外,无论在血管内皮细胞还是淋巴细胞中,我们发现溶细胞素引起的靶细胞凋亡涉及内源性和死亡受体介导的凋亡通路,但由于Jurkat T细胞是天然PTEN缺陷型细胞株,PTEN能直接作用PI3K信号通路,其缺失可能引起AKT磷酸化的增加,AKT是细胞信号转导中极为重要的信号分子,与细胞的增殖等有密切的关系。因此,Jurkat T淋巴细胞对溶细胞素相比ECV304更为敏感是否意味着可能与PTEN涉及的AKT、PI3K、mTOR信号通路有关。若构建PTEN表达载体转染Jurkat T细胞后是否能降低溶细胞素对其的损伤,值得我们思考。综上,我们推测,创伤弧菌溶细胞素可能是创伤弧菌杀伤T淋巴细胞,Jurkat T淋巴细胞重要致病因子,可直接参与创伤弧菌对T淋巴细胞的杀伤,但其对细胞的损伤是否涉及Caspase家族有关凋亡通路,溶细胞素对T淋巴细胞影响的具体分子机制,还有待深入了解。因此,本实验为明确创伤弧菌溶细胞素对免疫细胞的杀伤作用,为进一步了解及完善创伤弧菌的致病机制奠定基础。
[1] Gulig PA, Bourdage KL, Starks AM. Molecular pathogenesis of Vibrio vulnificus[J]. J Microbiol, 2005, 43:118-131.
[2] 桂静, 胡蝶, 楼永良. 创伤弧菌溶细胞素融合蛋白细胞毒活性相关分子机制研究[J].中华微生物学和免疫学杂志, 2008,28(5): 390-395.
[3] 李桂军, 楼永良. 创伤弧菌溶细胞素vvhA基因在大肠杆菌中的表达及其对应激因子的调控[J]. 中华微生物学和免疫学杂志, 2008, 28(1): 24-28.
[4] 李桂军, 楼永良, 严杰. 创伤弧菌溶细胞素基因在大肠杆菌中的表达及溶血活性鉴定[J]. 中国人兽共患病学报, 2007, 23(9): 852-853.
[5] Kim W, Goo S, Lee K, et al. Vibrio vulnificus-induced cell death of human mononuclear cells requires ROS-dependent activation of p38 and ERK 1/2 MAPKs[J]. Immunol Invest,2009,38(1):31-48.
[6] Kim WH. Vibrio vulnificus-induced death of Jurkat T-cells requires activation of p38 mitogen-activated protein kinase by NADPH oxidase-derived reactive oxygen species[J]. Cell Immunol,2008,253(1-2):81-91
[7] 桂静,肖美英,楼永良,等. 创伤弧菌溶细胞素融合蛋白重组、表达与细胞毒活性鉴定[J].细胞生物学杂志,2008,30(1):89-94.
[8] Serini S. Docosahexaenoic acid induces apoptosis in lung cancer cells by increasing MKP-1 and down-regulating p-ERK1/2 and p-p38 expression[J]. Apoptosis,2008,13(9):1172-1183.
[9] Hrstka R, Stulik J, Vojtesek B. The role of MAPK signal pathways during Francisella tularensis LVS infection-induced apoptosis in murine macrophages[J]. Microbes Infect, 2005,7(4):619-625.
[10]Pestka JJ, Uzarski RL, Islam Z. Induction of apoptosis and cytokine production in the Jurkat human T cells by deoxynivalenol: role of mitogen-activated protein kinases and comparison to other 8-ketotrichothecenes[J].Toxicology,2005,206(2):207-219.
Study on the apoptosis of human Jurkat T-lymphocytes induced by recombinant Vibrio vulnificus cytolysin
YAO Wei,XIE Danli,GUO Yajun,LOU Yongliang.
School of Life Science,
School of Laboratory Medicine,Wenzhou Medical College,Wenzhou,325035
Objective:To study the effect of recombinant Vibrio vulnificus cytolysin(rVvhA)on the activity of Caspase-3 and apoptosis in Jurkat T-cells. Method:The growth inhibition of Jurkat T-lymphocytes was measured by MTT assay. The effect of rVvhA on induction of apoptosis of Jurkat T-lymphocytes was studied by Hochest33258 stain and flow cytometry(FCM),respectively. Commercially available colorimetric assay kit was used to measure the activity of caspase-3 based on the spectrophotometric method.Results:Refolded rVvhA was purified with high purity up to 92%;the viability of Jurkat T-cells treated with 1.5 HU/mL rVvhA was inhibited significantly;1.5 HU/mL rVvhA could significantly induce apoptosis on Jurkat T-cells. After treatment with 1.5 HU/mL rVvhA at various times,the activity of Caspase-3 in Jurkat T-cells reached the peak at 3 h.Conclusion:The apoptosis of Jurkat T-cells can be induced by rVvhA, Caspase-3 may play a major role in the apoptosis of rVvhA-exposed cells.
Vibrio vulnificus cytolysin;human Jurkat T-lymphocytes;apoptosis
R446
A
1000-2138(2011)04-0332-05
2010-01-07
浙江省科技计划资助项目(2008C33059)。
姚蔚(1973-),女,浙江湖州人,实验师。
楼永良,教授,硕士生导师,Email:lyl@wzmc.edu.cn。
胡苗苗)
·论 著·
