毛栓菌漆酶的分离纯化及酶学性质研究
2011-01-12关艳丽赵新海张庆华钟丽娟朱巍巍吴红艳
关艳丽,华 霜,赵新海,张庆华,钟丽娟,朱巍巍,吴红艳
(1.辽宁省微生物科学研究院,辽宁朝阳 122000;2.沈阳农业大学,辽宁沈阳 110161)
漆酶是一种含铜的多酚氧化酶,1883年日本人Yoshida首次从漆树分泌物中发现,因而得名。它在植物的多种生物合成和降解中都有作用。随着研究工作的深入,人们发现它广泛存在于自然界多种植物和菌类的分泌物中,并且漆酶在植物中的生物学功能主要是参与木质素合成、细胞壁降解[1]、脱毒、创伤保护和形态分化调控:在工业中,漆酶广泛应用于造纸制浆,果汁、啤酒的澄清,生漆干燥成膜,毛发染色,固定化酶电极,免疫学分析,有机合成和环境保护中有毒废物的处理等很多领域[2]。相对于木素过氧化物酶(Lip)和锰过氧化物酶(MnP)更成为研究的热点。本文对毛栓菌所产生的漆酶进行分离纯化,并对其酶学性质进行研究,为漆酶的生产、应用提供数据支持。
1 材料与方法
1.1 材料
1.1.1 菌种 毛栓菌(Tram etes trogii),由辽宁省微生物科学研究院保存。
1.1.2 培养基 固体培养基为PDA培养基;液体培养基为最佳产酶培养基[3]:玉米面3.5%,豆饼粉4.0%,KH2PO40.1%,MgSO40.15%,VB10.04%。
1.1.3 主要试剂 ABTS(Sigma公司);Sephadex G-100;DEAE-Sepharose Fast Flow(Phar macia公司);考马斯亮蓝G250和考马斯亮蓝R-250(Amresco进口分装);SDS(Sigma进口分装);牛血清白蛋白(BSA,Sigma进口分装);尿素(Sigma公司);丙烯酰胺(Amresco进口分装);TEMED(N,N′-亚甲基双丙烯酰胺(BB I公司进口分装);DTT(Amresco进口分装);愈创木酚(Amresco进口分装);其他试剂为国产分析纯。
1.2 方法
1.2.1 漆酶活性的测定 测定方法参照文献[4]。
1.2.2 蛋白质含量的测定 采用考马斯亮蓝G-250比色法[4]。
1.2.3 漆酶同工酶酶谱检测 采用SDS-PAGE凝胶电泳。漆酶谱带检测:电泳结束后,取下凝胶,用刀片沿泳道切取两部分:一部分用G-250染色,检测蛋白谱带;另一部分先用蒸馏水冲洗,放入含0.1 mol/L HAC-NaAC(pH 4.5)0.4 mmol/L愈创木酚的溶液中,30℃反应30 min,反应结束后两部分进行对照,与愈创木酚反应而着色的带为漆酶带。
1.2.4 漆酶的分离纯化 ①粗酶液的制备:在含200 mL液体培养基的500 mL三角瓶中,接种3个菌塞(用打孔器制成直径10 mm厚2 mm的菌塞),于28℃、140 r/min恒温培养箱中培养7 d,将发酵液8 000 r/min,离心10 min。80%硫酸铵沉淀去除杂蛋白,获得目标蛋白沉淀。将沉淀溶解于2倍体积的10 mmol/L PBS(pH 6.0)缓冲液中,8 000 r/min低温离心10 min,除去不溶的杂蛋白,将上清液过夜透析脱盐平衡得到粗酶液备用;②DEAE-Sepharose层析:将粗酶液加到已用PBS平衡过的DEAE Sepharose Fast Flow柱(3.6 cm×40 cm)上,用0.1~1 mol/L以12滴/min流速洗柱并收集洗脱液,每管收集量2 mL。分别测定各管洗脱液在595 nm处的吸光度和420 nm处的漆酶活性,收集合并酶活性峰值组份于透析袋内,用PEG20000进行浓缩后,4℃保存。
1.2.5 酶学性质 ①分子量的测定:将样品及已知分子量的标准蛋白进行SDS-PAGE,分离胶浓度10%,浓缩胶浓度5%,以低分子量蛋白质Marker为标准,考马斯亮蓝R-250染色;②最适反应温度及热稳定性[5]:在不同温度下按照标准方法测定其相对酶活力(酶活力最高者为100%)。取酶液在不同温度下分别保温30 min,然后迅速冷却至室温,测残余酶相对活力(以未保温的酶液的酶活为100%);③最适反应pH及酸碱稳定性:将酶液分别加在不同pH(2.2~7.0)磷酸氢二钠-柠檬酸缓冲液中,按酶活力测定方法测定不同pH下的相对酶活力(酶活力最高者为100%)。酶液在不同pH缓冲液中28℃保温30 min,然后迅速冷却至室温,分别测定其残余酶活(以未保温酶液的酶活为100%);④金属离子对酶活力的影响:分别配制5 mmol/L的NaCl、KCl、CaCl2、MgSO4、FeCl3、CuSO4·5H2O、MnCl2、ZnSO4·5H2O、AgNO3盐溶液[6]。将酶液加入到以上盐溶液中,加入ABTS启动反应,立即进行漆酶活力测定,以不加离子的反应液为对照;⑤抑制剂对酶活性的影响:用含DTT、EDTA、DMSO、SDS的0.1 mol/L醋酸-醋酸钠缓冲液(pH 4.0)与一定量酶液混合,加入ABTS启动反应,分别测定其酶活力。
2 结果与分析
2.1 漆酶的分离纯化
粗酶液经盐析、透析和浓缩后,上DEAE Sepharose Fast Flow柱层析,NaCl线性梯度洗脱,记录洗脱的蛋白质曲线,对各收集管进行酶活测定,记录结果见图1。由图1可见2个峰,按其洗脱先后顺序分别命名为LacA、LacB。分别将2峰收集合并,用ABTS分别检测各峰值处洗脱液,均显示出漆酶活性,说明毛栓菌产生的漆酶为2种组分的同工酶。LacA和LacB经纯化后比活力分别为11.85、4.52 U/mg;纯化倍数分别为12.88、4.91;回收率分别为17.1%、2.74%。
2.2 漆酶同工酶酶谱检测及分子量测定
毛栓菌发酵液经硫酸铵沉淀、DEAE-Sepharose Fast Flow层析分离、纯化后,得到的酶液进行SDS-PAGE电泳,采用活性染色和考马斯亮蓝染色,结果见图2。由图2可见,纯化后得到蛋白质条带单一,说明该漆酶已达电泳纯。从电泳结果可以看出毛栓菌有2种漆酶同工酶,自上而下分别为LacA、LacB。由SDS-PAGE电泳测得LacA、LacB分子量分别约为54.6和17.7 ku。近年来,有很多不同来源的漆酶得到提纯,并发现不同菌株分泌的漆酶其表观分子量差异很大,但一般为59~390 ku,真菌漆酶的分子量在59~80 ku之间[7]。本试验菌株同工酶分子量均不在此范围内,初步认为是2种新的漆酶同工酶。
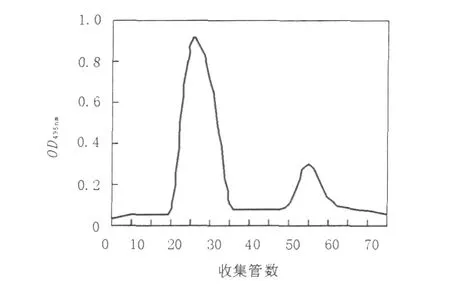
图1 毛栓菌漆酶DEAE sepharose Fast Flow层析曲线Fig.1 DEAE Sepharose Fast Flow chromatography curve of laccase from Trametes trogii
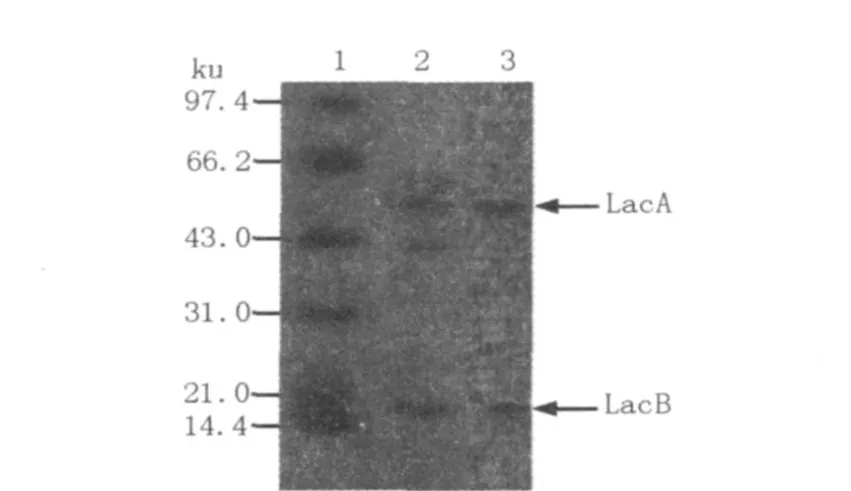
图2 漆酶的SDS-PAGE检测图Fig.2 SDS-PAGE of laccase and proteins
2.3 最适反应温度及热稳定性
在不同温度下LacA、LacB的酶活测定结果见图3,热稳定性分析结果见图4。由图3、4可知,毛栓菌漆酶LacA、LacB的最适反应温度分别为50、60℃,在30~70℃范围内其酶活受温度影响较大,且随温度增高失活率逐渐增加。在40℃以下保温4 h剩余相对酶活仍维持在50%以上,而在最适温度以上保温4 h剩余相对酶活都在35%以下,这说明漆酶LacA、LacB在40℃以下具有较好的热稳定性,但高于60℃很不稳定。在实际应用中,酶反应温度的确定应兼顾最适温度和热稳定性,可在略低于最适温度范围内选择。
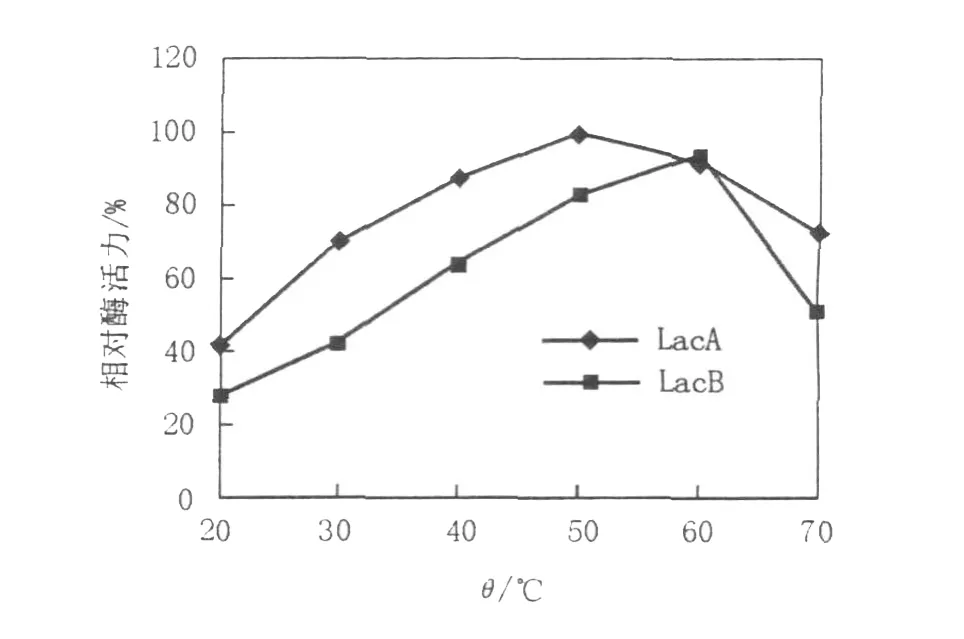
图3 温度对LacA和LacB活性的影响Fig.3 Effect of temperature on laccase A and laccase B acdvity
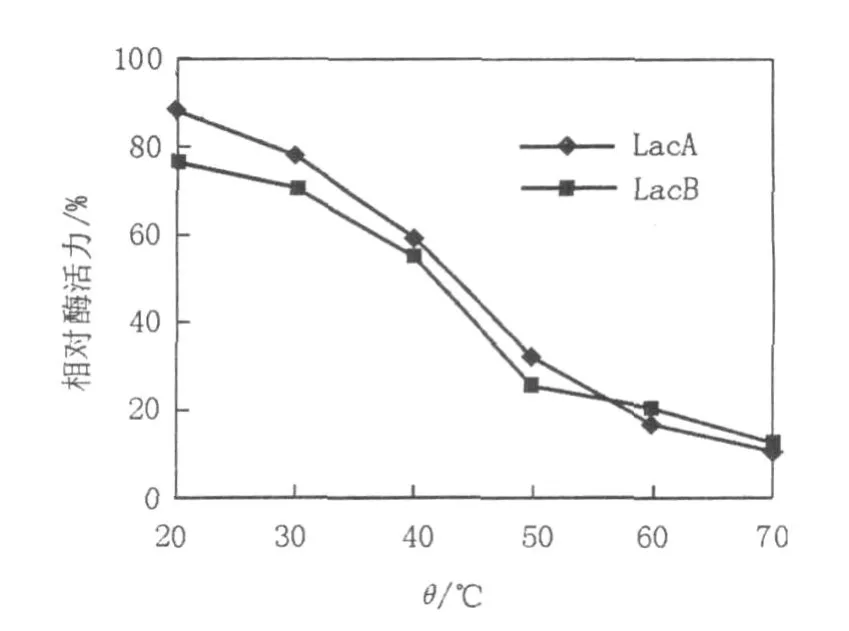
图4 温度对LacA和LacB的稳定性影响Fig.4 Effectof temperature on laccase A and laccase B stabilities
2.4 最适反应pH及pH稳定性
不同pH值下LacA、LacB的酶活测定(图5)结果表明,LacA在pH 4.5时表现最大酶活力,LacB在pH 4.0表现最大酶活力,在pH 3.5~5.0 LacA和LacB相对酶活都高于70%,pH高于6.5时表现酶活最小。图6结果表明,LacA在pH 2.2~4.5比较稳定,残余酶活低保持在70%以上,LacB在pH 2.2~5.0也比较稳定,残余酶活在60%以上。LacA和LacB在pH高于6.5时酶活损失都比较严重,由此表明LacA和LacB都是耐酸性酶。
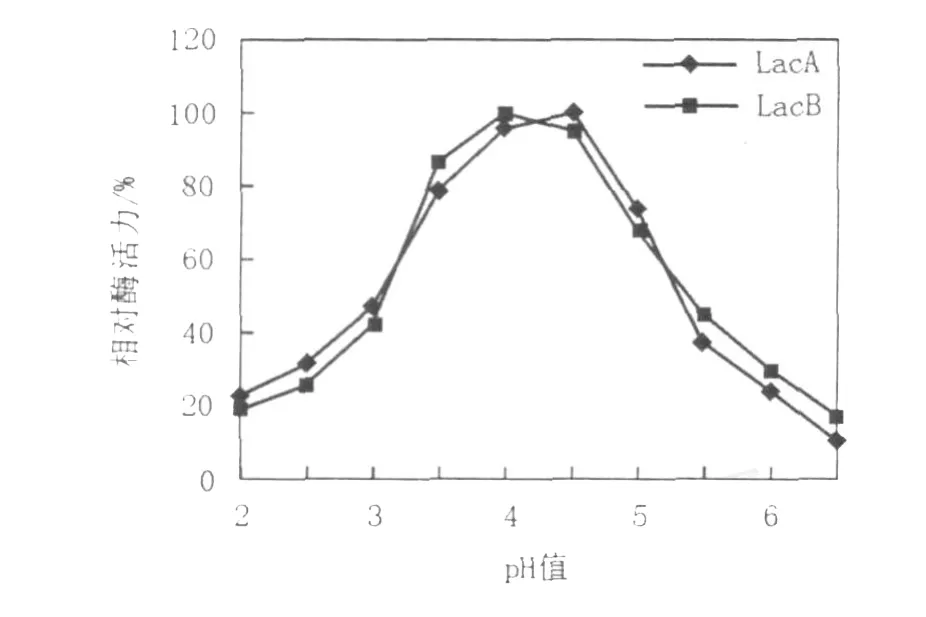
图5 pH值对LacA和LacB的影响Fig.5 Effect of pH on laccase A and laccase B activity
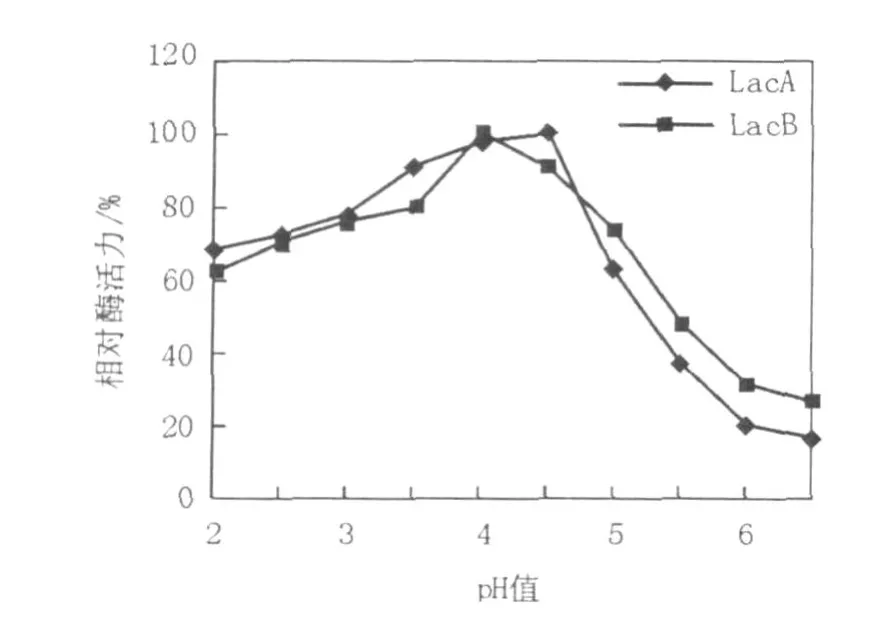
图6 pH值对LacA和LacB稳定性的影响Fig.6 Effect of pH on laccase A and laccase B stabilities
2.5 无机离子对酶活性的影响
从图7的试验结果可以看出,Cu2+、Mg2+对LacA有激活作用,对LacB影响不大;Ag+对两同工酶表现为完全抑制;Fe3+对LacA和LacB有一定的抑制作用;Ca2+、Mn2+、K+、Na+、Zn2+对LacA和LacB影响不大。
2.6 抑制剂对酶活性的影响
从表1的试验结果可以看出,抑制剂DTT、EDTA、DMSO、SDS对酶均有不同程度的抑制作用。DTT对漆酶表现为完全抑制;EDTA在较高浓度时对LacA、LacB有抑制;DMSO、SDS随浓度的增加,抑制作用也逐渐增强。
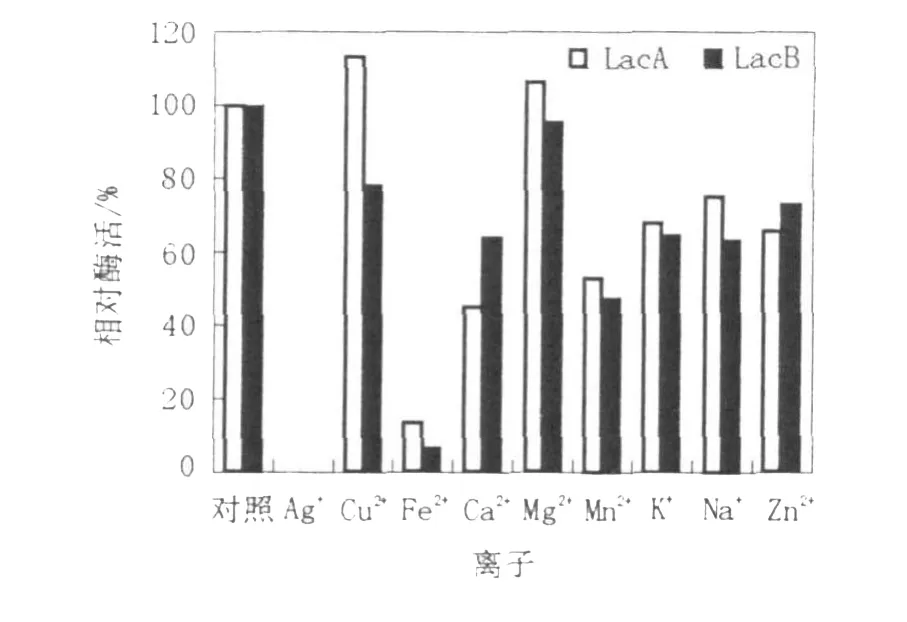
图7 无机离子对LacA和LacB酶活性的影响Fig.7 Effect ofmetal ions on activity ofLacA and LacB
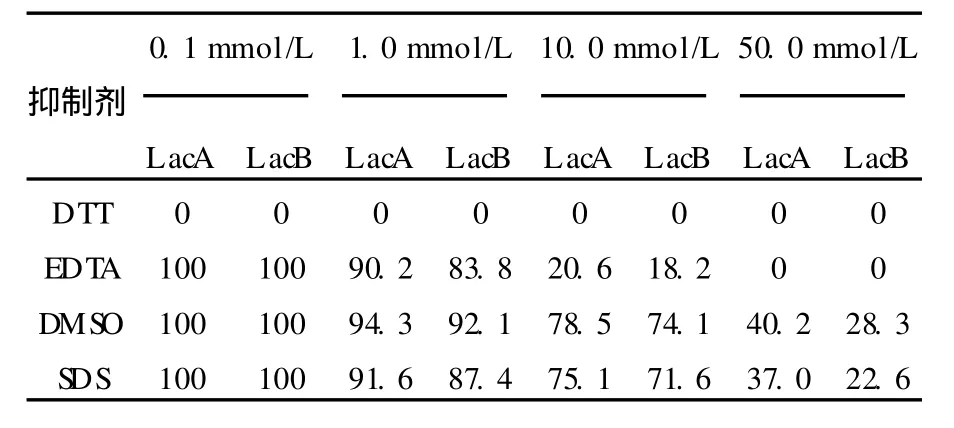
表1 抑制剂对LacA和LacB的影响Table 1 Effect of Inhibitor on activity ofLacA and LacB
3 结 论
本文对毛栓菌所产漆酶的分离纯化及部分酶学性质进行了研究。通过80%硫酸铵盐析、浓缩、透析、DEAE sepharose Fast Flow柱层析、NaCl线性梯度洗脱后,得到2个漆酶同工酶活力峰,分别合并收集并命名为LacA、LacB,然后进行SDSPAGE电泳分析,结果看到蛋白带有多条,漆酶带有2条,可以断定该菌株漆酶含有2型漆酶的组分,测得2种漆酶同工酶的分子量分别为54.6、17.7 ku。
对漆酶LacA、LacB的部分酶学性质进行了研究。LacA和LacB最适反应温度分别为50、60℃,在30~70℃范围内其酶活受温度影响较大,在40℃以下均具有较好的热稳定性,但高于60℃很不稳定;LacA、LacB反应最适pH分别为4.5、4.0,LacA在pH 2.2~4.5,LacB在pH值3.5~5.0,表现较好的稳定性;Cu2+、Mg2+对LacA有激活作用,对LacB影响不大,Ag+对LacA和LacB表现为完全抑制;Fe3+对LacA和LacB有一定的抑制作用;Ca2+、Mn2+、K+、Na+、Zn2+对LacA和LacB影响不大。DTT、EDTA、DMSO、SDS对酶均有不同程度的抑制作用,且随其浓度的升高抑制作用增强。
[1] O′MalleyDM,Whetten R,BaO W.The role of laccase in lignification[J].Plant J,1993,4(5):751-757.
[2] KuznetsovB A,shumakovich G P,KorolevaO V.on applicability of laccase as 1abel in the mediated and mediatorless electroimmunoassay:effect of distance on the directelec tron transfer between laccase and electrode[J].Biosens Bioelectron,2001,16(6):425-430.
[3] 华霜,李莉,关艳丽,等.毛栓菌(Tramets trogii)液体培养产漆酶的研究[J].微生物学杂志,2010,30(4):48-51.
[4] 赵亚华,高向阳.生物化学实验技术教程[M].华南理工大学出版社,2000:40-53.
[5] 郭伟云,汤祥忠,姚朝阳,等.云芝漆酶同工酶的分离纯化及酶学性质[J].河北师范大学学报,2007,31(6):806-809.
[6] 张丽萍,董超,王迎春,等.几种离子对纤维素酶活力的影响[J].河北省科学院学报,2000,17(4):235-238.
[7] 尹艳丽.侧耳属白腐菌漆酶分泌特性研究[D].华中科技大学,2005,4-10.
