肌动蛋白结合脂筏促进巨噬细胞摄入土拉弗朗西斯菌
2011-01-12曾思良蔡家麟吴鉴今黄通来
潘 欣,曾思良,蔡家麟,吴鉴今,杨 光,黄通来
(第二军医大学微生物学教研室,上海 200433)
土拉弗朗西斯菌(Francisella tularensis)最早于1911年在美国加利福尼亚的图莱里县(Tulare County)暴发的鼠疫样疾病的地松鼠(ground squirrel)中分离出来[1]。20世纪30年代和40年代由于大规模的水路运输,该病在欧洲、前苏联和美国流行,因该病最常见于野兔中,也称野兔热(rabbit fever)[2]。土拉弗朗西斯菌包括4个确认的亚种:土拉热(tularensis)亚种(A型)、全北区(holarctica)亚种(B型)、中亚细亚(mediasiatica)亚种和新凶手(novicida)亚种。其他从环境中检测到的亚种尚未成功分离培养。A型菌株(高致病性)几乎专属于北美,而B型分布在整个北半球温带地区,相对弱毒,未治疗的皮肤感染死亡率低于0.5%[3]。我国自1957年首次在内蒙通辽地区从黄鼠体内首次分出土拉弗朗西斯菌后,在黑龙江、青海、西藏、新疆等地又从人、野兔、硬蜱中相继分离出该菌。西藏阿里地区已证实为土拉弗朗西斯菌病的自然疫源地[4]。土拉弗朗西斯菌为革兰阴性、不运动、不形成芽胞的需氧球杆菌,该菌采取有效的方式侵入宿主细胞并在细胞内增殖,在侵入以及在宿主细胞内运输内化期间,曾观察到巨噬细胞膜微结构域中的窖蛋白涉及土拉弗朗西斯菌的早期入侵[5]。最近的研究发现土拉弗朗西斯菌感染巨噬细胞15~30 min,可查见脂筏相关成分如胆固醇和神经节苷脂G M1涉及土拉弗朗西斯菌侵入胞内,肌动蛋白与胆固醇结合为巨噬细胞摄入细菌提供动力;感染60 min以后,脂筏难以查见,但可观察到肌动蛋白富集在细菌周围,可能与细菌在胞内运动或胞间感染有关。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞系和质粒 土拉弗朗西斯菌全北区亚种LVS(Francisella tularensissubsp.holarctica LVS,以下简称FTLVS)及表达绿色荧光蛋白的FTLVS-GFP菌株为本室保存[5]。表达6-磷酸甘露糖受体的J774A.1细胞购于ATCC。
1.1.2 培养条件 细菌用含有IsoVitaleX(BD Biosciences)的巧克力Ⅱ琼脂平板于37℃培养72 h[6]。完全细胞培养基为DMEM(Sigma)中补充了10%胎牛血清(HyClone,未进行热灭活)。活菌操作在生物安全三级实验室完成[7]。
1.2 方法
1.2.1 土拉弗朗西斯菌LVS感染巨噬细胞 用一次性接种环挑取数个土拉弗朗西斯菌LVS克隆悬浮于含10%FBS的DMEM中。5 000 r/min离心10 min。细菌沉淀用含10%FBS的DMEM洗2次,再重悬于含10%FBS的DMEM中。用OD600/克隆形成单位标准曲线将感染复数调整为50。J774A.1细胞接种于细胞培养皿中培养18 h。细胞用暖的完全细胞培养基洗2次。在细胞单层中加入MO I为50的用相应培养基悬浮的细菌,1 000 r/min室温离心5 min,然后37℃下在5%CO2中放置60 min,用暖的完全细胞培养基洗涤3次,换含10μg/mL庆大霉素的完全细胞培养基作用30 min,暖的完全细胞培养基洗2次,换不含庆大霉素的完全细胞培养基,37℃下在5%CO2中培养至指定时间点。
1.2.2 免疫荧光染色 J774A.1接种于培养皿的无菌盖玻片上,细胞感染MO I为50的FTLVSGFP,在给定时间内用4%多聚甲醛固定30 min,PBS洗,用含0.5%Triton X-100的PBS透化30 min,PBS洗,用 Image-iT FX信号增强剂(Invitrogen)封闭30 min,成为固定片。用PBS将霍乱毒素B亚基(cholera toxin B,CTB)(Invitrogen)稀释至1μg/mL,于4℃与固定片孵育10 min,PBS洗。CTB能与脂筏中的神经节苷脂G M1特异结合,触发胞膜窖介导(caveolae-mediated)的毒素内化[8]。用PBS将键合了Alexa 594的兔抗霍乱毒素B亚基IgG(Invitrogen)按1◇200稀释,室温显色15 min。PBS洗后,过一遍双蒸水,晾干。盖玻片用抗褪色金牌介质(Invitrogen)在载玻片上装片。J774A.1接种于培养皿的无菌盖玻片上,细胞感染MO I为50的FTLVS-GFP,培养皿中同时加入终浓度为5μg/mL菲律平Ⅲ(filipin III)(Sigma)。菲律平Ⅲ是一种结合胆固醇的制剂,插入细胞膜后显示蓝色荧光[9]。感染60 min后制成固定片。键合了Alexa 594的鬼笔环肽(phalloidin)(Invitrogen)按1◇500稀释,于室温与固定片孵育20 min。键合了Alexa 594的鬼笔环肽可与细胞肌动蛋白结合显示红色荧光。PBS洗后,过一遍双蒸水,晾干,装片。带有电动Z-轴的Olympus IX81荧光显微镜置于隔离器中[10],每个荧光通道在Z轴取40叠。使用DAPI、FITC和德克萨斯红滤光片。用Volocity 4.1( Improvision)软件融合荧光通道。数据通过生物安全三级实验室内网传出。
2 结果与分析
2.1 脂筏结合肌动蛋白参与FTLVS的早期入侵
脂筏是膜脂质双层内富含鞘磷脂、鞘糖脂、胆固醇、GPI-锚固蛋白和Src-kinase等的微区[11]。神经节苷酯G M1属于含唾液酸的鞘糖脂,鞘脂使脂筏具有不溶于非离子型去垢剂的特点。霍乱毒素B亚基(cholera toxin B,CTB)用于标记脂筏中的神经节苷酯G M1。图1显示FTLVS-GFP感染J774A.1细胞15 min可与神经节苷酯G M1共定位。菲律平Ⅲ是一种结合胆固醇的制剂,插入细胞膜后显示蓝色荧光,5μg/mL可用于标记参与脂筏形成的胆固醇成分。图2显示FTLVS-GFP感染J774A.1细胞15 min可与胆固醇共定位,机动蛋白与胆固醇结合,有助于脂筏成分的运动。感染60 min后,与菲律平Ⅲ或神经节苷脂G M1共定位的FTLVS-GFP难以见到,脂筏逐渐消失。细菌在胞内运动比较自如,图3显示FTLVS-GFP感染J774A.1细胞60 min周围富集细胞肌动蛋白,可能与细菌在胞内运动或胞间感染有关。

图1 脂筏参与捕获土拉弗朗西斯菌Fig.1 Lipid raftswere concerned with the engulfing ofFrancisella tularensisin macrophages

图2 巨噬细胞的胆固醇参与摄取土拉弗朗西斯菌Fig.2 Cholesterolwas concerned with the uptake ofFrancisella tularensisin macrophages.
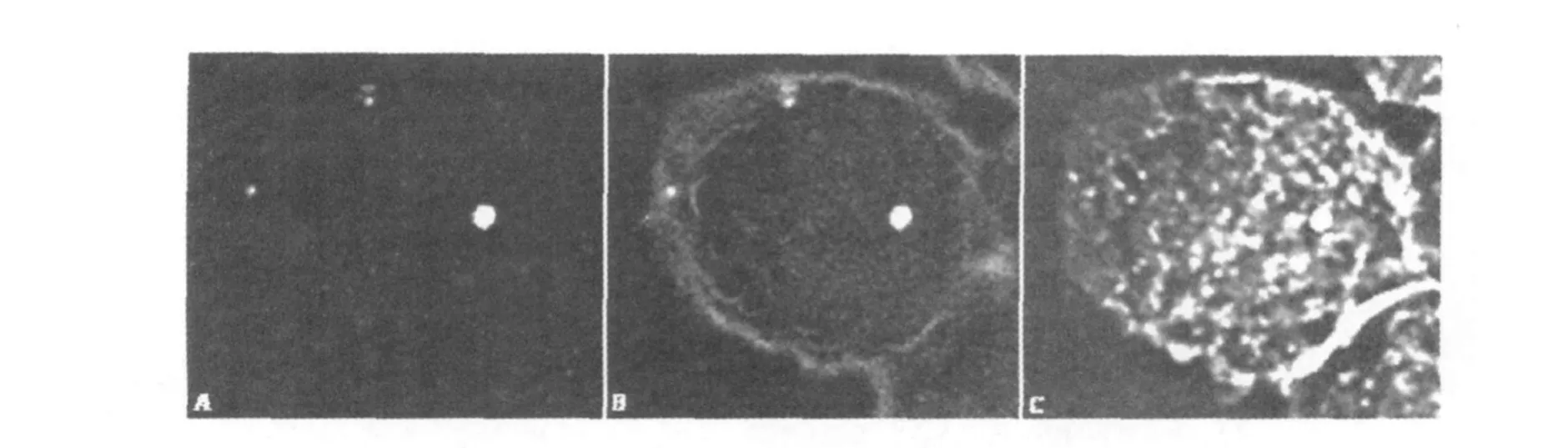
图3 肌动蛋白参与土拉弗朗西斯菌胞内运动Fig.3 Actinswere concerned with the moving ofFrancisella tularensisin macrophages
3 讨 论
巨噬细胞是机体免疫系统的重要细胞成分,在非特异性免疫防御及特异性免疫应答中均起十分关键的作用。巨噬细胞通过其表面受体如甘露糖受体、清道夫受体、Toll样受体等模式识别受体(pattem recognition receptor,PRR)识别微生物表面的病原相关的分子模式(pathogen-associated molecular pattem,PAMP),如细菌的脂多糖、脂蛋白、肽聚糖、脂磷壁酸、未甲基化的CpG DNA、分枝杆菌的脂阿拉伯甘露聚糖、酵母菌的甘露聚糖等[12];另外,巨噬细胞还能通过其表面的补体受体、FcγR(即IgG Fc受体,有Ⅰ、Ⅱ、Ⅲ3种类型)调理吞噬病原体。
土拉弗朗西斯菌是一种选择了多种优化方式有效地侵入宿主细胞并在细胞内增殖的病原体。目前已报道的与土拉弗朗西斯菌摄入相关的PRR类受体主要有甘露糖受体[13]、A类清道夫受体[14],还有补体C3[15]和补体受体CR3[16]。另外,土拉弗朗西斯菌具有PAMP效应的延长因子Tu(elongation factor Tu,EF-Tu)可与巨噬细胞表面的核仁素(nucleolin)结合而被细胞摄入[17]。前期研究也显示巨噬细胞表面的转铁蛋白受体1(transferrin receptor 1)[18]、质膜微区结构域中的窖蛋白-1(caveolin 1)[5]均参与了摄取土拉弗朗西斯菌。
质膜微区结构域包括瓶状反折的小窝(含有窖蛋白)和脂筏(缺少窖蛋白)[19]。脂筏大小为55~300 nm,富含胆固醇、鞘磷脂,可结合多种蛋白质,为多种信号转导途径的对话提供一个平台[20];脂筏还可以承载多种与PRR相关的协同受体调节PAMP-PRR信号[21]。
本研究免疫荧光结果显示,巨噬细胞膜微结构域中的脂筏参与了FTLVS的早期入侵。研究中采用了感染的同时用菲律平Ⅲ快速冲击细胞,从而可以查见细菌周围包绕富含胆固醇的结构域(图2C),胞内的肌动蛋白可与胆固醇结合,促进脂筏运载细菌进入巨噬细胞。由于菲律平Ⅲ长时间处理细胞会干扰细胞膜微结构域,本研究也使用了霍乱毒素B亚基以标记脂筏。图1C显示霍乱毒素B亚基所标记的脂筏中的神经节苷酯G M1可与细菌结合,触发细菌的内化。当细菌离开细胞膜后,脂筏消失(图3B)。随着感染时间的推移,土拉弗朗西斯菌所在囊泡可与肌动蛋白结合(图3C),在胞内运动或引发胞间感染。
由于脂筏可以携带多种信号转导元件,可以进一步研究土拉弗朗西斯菌与脂筏相关的致病或免疫信号通路;由于土拉弗朗西斯菌可以离开脂筏,推测其可能产生了脂筏的降解物质,也值得进一步研究。
[1] 潘欣.医学生物侦检与防护技术概论[M].北京:军事医学科学出版社,2011.
[2] Beckstrom-Sternberg S M,Auerbach RK,Godbole S,et al.Complete genomic characterization of a pathogenic A.II strain of Francisella tularensissubspecies tularensis[J].PLoS One.2007,2(9):e947.
[3] Asare R,Kwaik YA.Exploitation of host cell biology and evasion of immunity byFrancisella tularensis[J].FrontMicrobiol,2010,1:145.
[4] World Health Organization.WHO Guidelines on Tularaemia[JM/OL].World Health Organization,Epidemic and pandemic alert and response,2007.
[5] Pan X,Qi JC,Li GB,et al.Influence ofmembrane microdomain on infection process ofmouse macrophages by Francisella tularensisLVS[J].Med J Chin PLA,2009,34(7):833-837.
[6] Pan X,Tamilselvam B,Hansen EJ,et al.Modulation of iron homeostasis in macrophages by bacterial intracellular pathogens[J].BMC Microbiol,2010,10:64.
[7] 潘欣.高危病原体侦检综合实验[M].北京:军事医学科学出版社,2011.
[8] Lencer W I,Tsai B.The intracellular voyage of cholera toxin:going retro[J].TrendsBiochem Sci,2003,28(12):639-645.
[9] Drabikowski W,Lag wińska E,Sarzala MG.Filipin as a fluorescent probe for the location of cholesterol in the membranes of fragmented sarcoplasmic reticulum[J].Biochim Biophys Acta,1973,291(1):61-70.
[10] Pan X,Qi JC,LongM,et al.New technique:Development of a large-scale isolation chamber system for the safe and humane care of medium-sized laboratory animals harboring infectious diseases[J].J ZhejiangUniv SciB,2010,11(10):771-778.
[11] Simons K,ToomreD.Lipid rafts and signal transduction[J].Nat RevMol CellBio,2000,1:31-41.
[12] Janeway CA Jr,Medzhitov R.Innate immune recognition[J].Annu Rev Immunol,2002,20:197-216.
[13] Schulert GS,Allen LA.Differential infection of mononuclear phagocytes byFrancisella tularensis:role of the macrophage mannose receptor[J].J Leukoc Biol,2006,80(3):563-571.
[14] PieriniLM.Uptake of serum-opsonizedFrancisella tularensisby macrophages can be mediated by class A scavenger receptors[J].Cell Microbiol,2006,8(8):1361-1370.
[15] ClemensDL,Lee BY,Horwitz MA.Francisella tularensisenters macrophages via a novel process involving pseudopod loops[J].Infect Immun,2005,73(9):5892-5902.
[16] Balagopal A,MacFarlane AS,Mohapatra N,et al.Characterization of the receptor-ligand pathways important for entry and survival of Francisella tularensisin human macrophages[J].Infect I mmun,2006,74(9):5114-5125.
[17] Barel M,Hovanessian AG,Meibom K,et al.A novel receptorligand pathway for entry of Francisella tularensisin monocytelike THP-1 cells:interaction between surface nucleolin and bacterial elongation factor Tu[J].BMC Microbiol,2008,8:145.
[18] Pan X,QiJC,Li GB,et al.Effect of the expression of transferrin receptor 1 on the invasion ofFrancisellainto macrophages[J].Med J Chin PLA,2009,34(8):932-935.
[19] Park EK,ParkMJ,Lee SH,et al.Cholesterol depletion induces anoikis-like apoptosis via FAK down-regulation and caveolae internalization[J].J Pathol,2009,218(3):337-349.
[20] Simons K,Ikonen E.Functional rafts in cellmembranes[J].Nature,1997,387(6633):569-572.
[21] Lebeer S,Vanderleyden J,De Keers maecker SC.Host interactions of probiotic bacterial surface molecules:comparison with commensals and pathogens[J].Nat Rev Microbiol,2010,8(3):171-184.
