发芽咖啡豆α-半乳糖苷酶的化学修饰
2011-01-12沈汪洋金征宇
沈汪洋,金征宇
(1.武汉工业学院 食品科学与工程学院,湖北武汉 430023;2.江南大学食品科学与工程学院,江苏无锡 214122)
α-半乳糖苷酶(α-Galactosidase,α-Gal;EC 3.2.1.22)是一种外切糖苷酶,可以分解蜜二糖,又称为蜜二糖酶。此酶主要水解以具有α-半乳糖苷结构的碳水化合物,因此又将蜜二糖酶命名为α-半乳糖苷酶[1]。α-半乳糖苷酶广泛存在于动物、植物及微生物中[2]。咖啡豆α-半乳糖苷酶是从咖啡豆中提取得到的一种α-半乳糖苷酶。由于此酶具有三项显著功能而受到研究者的重视:制备环糊精衍生物[3],法布里病的临床治疗[4],血型转换研究(B 型血转换成O型血)研究[5]。但是利用传统的方法,从咖啡豆中获得α-Gal不能满足目前的研究需求,酶活较低,成为此酶进一步应用的瓶颈。2005年,Marraccini等[6]报道在发芽咖啡豆中发现 α-Gal的酶活普遍高于咖啡豆(绿咖啡豆)来源的α-Gal酶活。本实验追踪国外报道,在从发芽咖啡豆中提取、分离、纯化得到α-Gal的基础上,深入研究α-Gal的化学修饰,找出该酶的活性中心所需的氨基酸种类和数目,为此酶的进一步应用提供理论指导。
1 材料与方法
1.1 试剂
发芽咖啡豆α-半乳糖苷酶实验室自制[7];对硝基苯酚-α-半乳糖苷,碳二亚胺,丁二酮,Sigma公司;焦碳酸二乙酯,对氯汞苯甲酸,二硫苏糖醇,二硫硝基苯甲酸,Amresco公司;N-溴代琥珀酰亚胺,三硝基苯酚,国药集团;其余试剂均为常规分析纯。
1.2 仪器与设备
HT多功能酶标仪:美国Bio-Tek公司;Direct-Q3超纯水系统:美国 Millipore公司;Delta320 pH计:梅特勒-托利多仪器有限公司;HH-2型恒温水浴锅:金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 α-Gal酶活和蛋白测定
酶活测定参照Marraccini的方法[6]。蛋白质含量采用Bradford法[8]测定。
1.3.2 α-Gal的化学修饰
选用几种蛋白质侧链修饰剂对发芽咖啡豆α-Gal进行化学修饰,将蛋白质侧链修饰剂分别与0.05mL α-Gal(0.1mg/mL)酶液等量混合,达到各自所需的修饰浓度,在26℃下保温30min,然后测定发芽咖啡豆α-Gal的残余酶活。以各修饰剂的缓冲液代替修饰剂,在同样条件下测定发芽咖啡豆α-Gal的酶活,以此酶活作为各自对应修饰的发芽咖啡豆α-Gal酶活的100%[9-11]。
1.3.3 色氨酸残基数的测定
用N-溴代琥珀酰亚胺(NBS)修饰发芽咖啡豆α-Gal,氧化的色氨酸残基数按Spande等人[12]的方法测定。将发芽咖啡豆α-Gal用pH4.0的0.1mol/L醋酸缓冲液稀释,定量加入NBS溶液,使其浓度达到实验要求,在25℃下保温30 min,测定280 nm处的光吸收值的下降值(ΔA280nm),当ΔA280nm不再变动时,表明修饰已完成,即可定量计算被修饰的色氨酸残基数(以不加NBS的发芽咖啡豆α-Gal酶液作为对照)。计算方法如下:
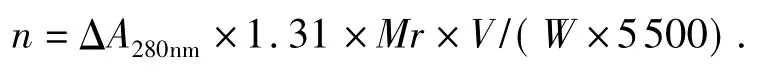
式中,n为每摩尔酶中被NBS氧化的色氨酸残基摩尔数,ΔA280nm为对照酶液在280 nm处的吸光度与NBS氧化后的酶液在相同波长下的吸光度差值,W为酶的重量,1.31为Witkop因数,5500为色氨酸在280nm处的摩尔消光系数,Mr为酶的分子量,V为酶溶液的体积。
2 结果与讨论
2.1 修饰剂的反应条件
在设计化学修饰反应时,仔细选择反应条件是很关键的一步。结合一些参考文献的报道,选择几种化学修饰剂修饰发芽咖啡豆α-Gal。表1列出了各种化学剂及其修饰反应的条件。
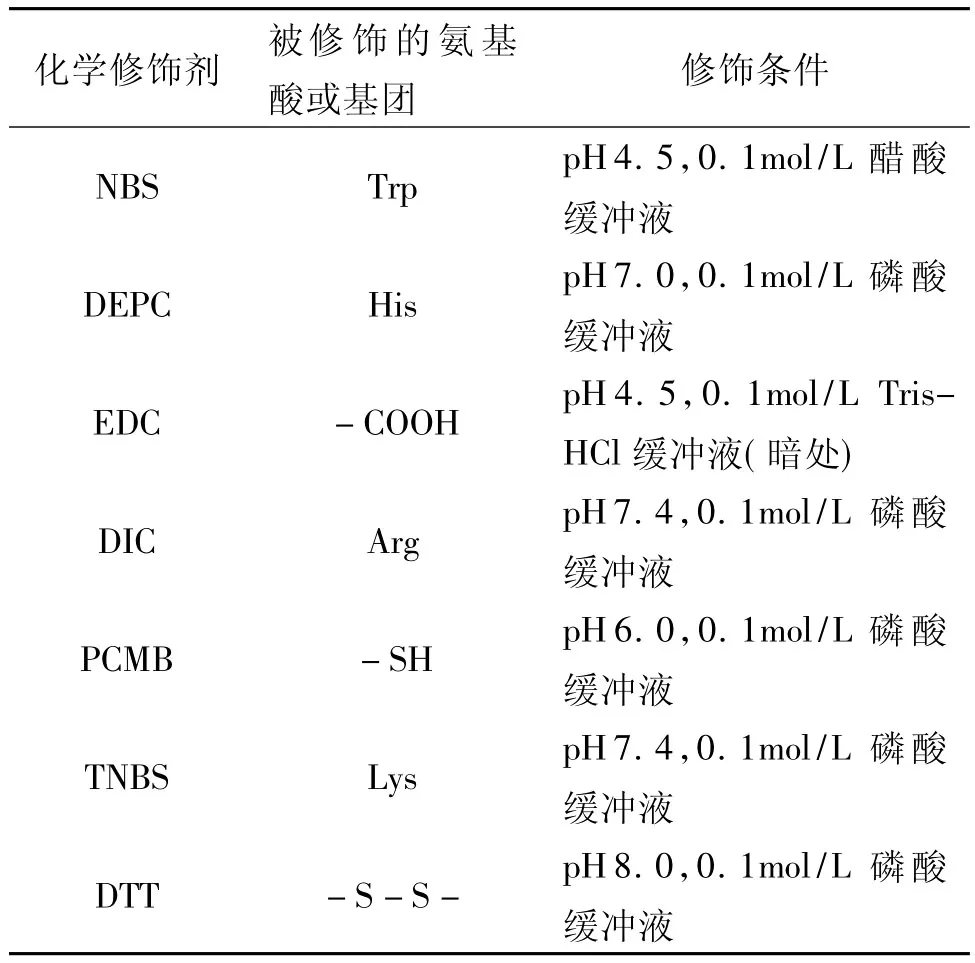
表1 化学修饰反应的条件
2.2 α-Gal的化学修饰结果
七种化学修饰剂对发芽咖啡豆α-Gal的化学修饰结果如表2所示。
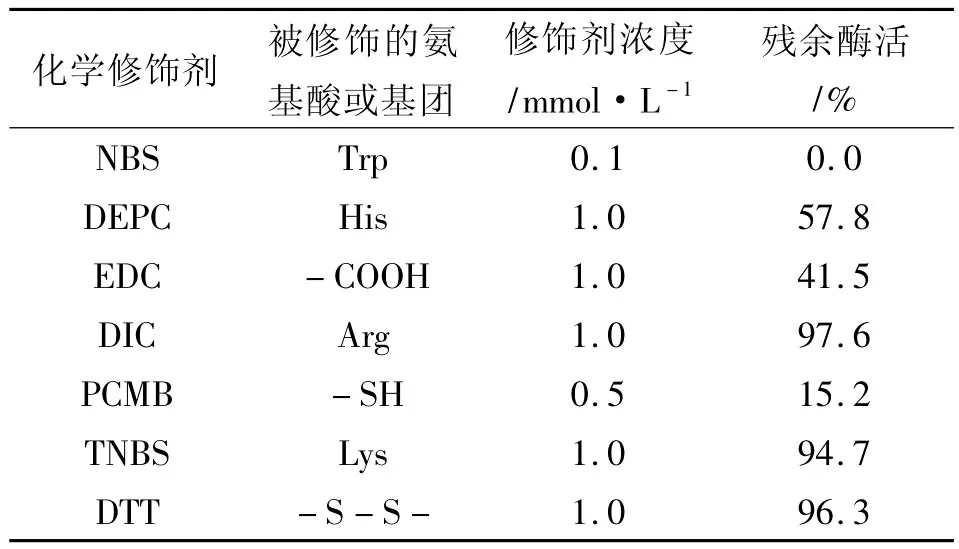
表2 α-Gal的化学修饰
当NBS的浓度为0.1 mmol/L时,α-Gal完全失活,说明色氨酸(Trp)是α-Gal活性中心的必需氨基酸。PCMB浓度为0.5 mmol/L时,α-Gal的活力只剩余15.2%。EDC浓度为1mmol/L时,α-Gal的活力只剩余41.5%。浓度为1mmol/L时,α-Gal的剩余酶活为57.8%。说明巯基(-SH)、羧基(-COOH)和组氨酸(His)可能是发芽咖啡豆α-Gal活性中心的组成部分。DIC、TNBS和DTT对α-Gal的活力影响很小,说明精氨酸(Arg)、赖氨酸(Lys)和-S-S-不是维持发α-Gal酶活的必需基团。
2.3 组氨酸残基的化学修饰
在相同的α-Gal溶液中分别加入不同量的焦碳酸二乙酯(DEPC),测定α-Gal的残余活力,结果如图1所示。随着DEPC浓度的增大,α-Gal的活力逐渐下降,并趋向于一个稳定的值。当DEPC浓度为1.0 mmol/L 时,α-Gal残余酶活只有 57.8%,说明His可能是活性中心的组成部分,结果见图1。
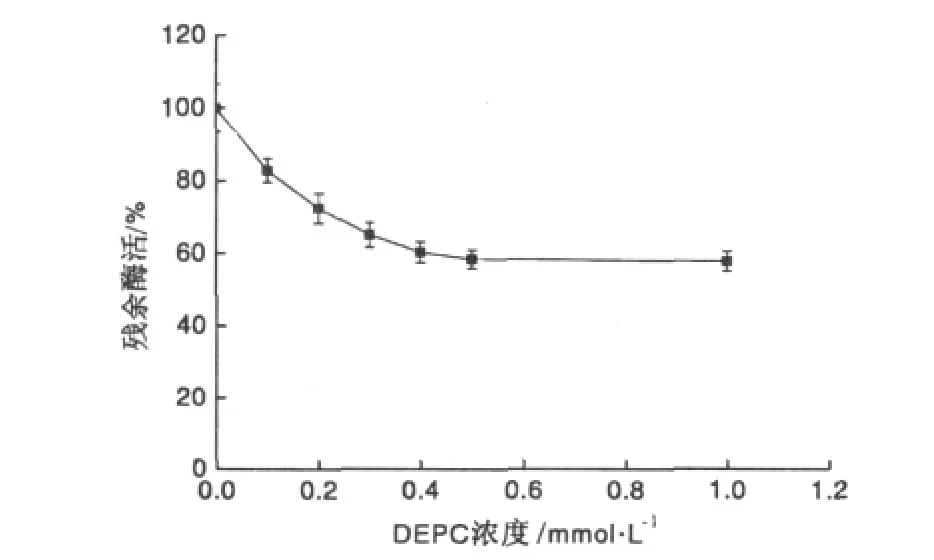
图1 DEPC对α-Gal的修饰
2.4 羧基氨基酸残基的化学修饰
加入不同量的水溶性的碳二亚胺(EDC)对发芽咖啡豆α-Gal活力的影响,结果见图2所示。随着EDC浓度的增大,α-Gal活力逐渐下降,当EDC浓度达到 1.0 mmol/L时,α-Gal残余活力降至41.5%。表明发芽咖啡豆α-Gal活性中心的必需氨基酸可能含有-COOH氨基酸-谷氨酸(Glu)或天门冬氨酸(Asp)。
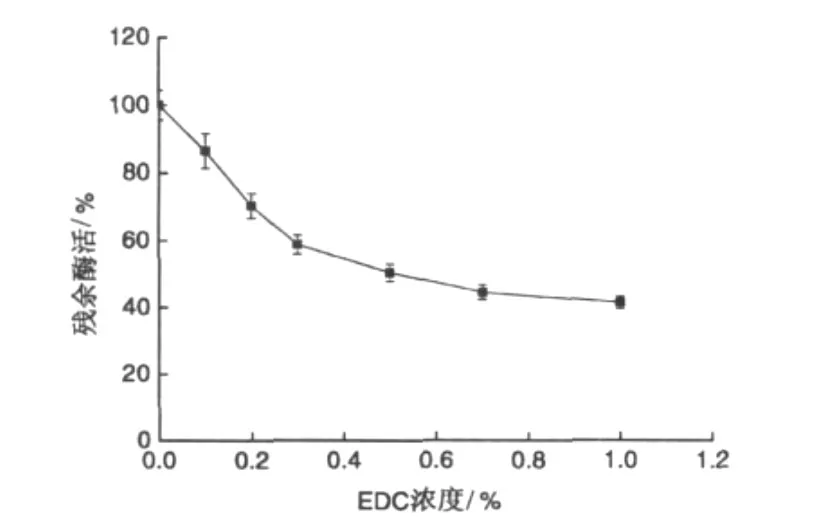
图2 EDC对α-Gal的修饰
2.5 巯基的化学修饰
将不同量的对氯汞苯甲酸(PCMB)加入到发芽咖啡豆 α-Gal溶液中,使其浓度分别为 0.1,0.2,0.3,0.4 和 0.5mmol/L,在26℃下保温 30min,然后测定残余酶活,结果见图3。从图中看出,随着PCMB浓度的增加,α-Gal活力逐渐下降。当PCMB浓度为0.1 mmol/L时,α-Gal残余活力快速降至35.1%,说明-SH的修饰对α-Gal的酶活是十分敏感的。当PCMB浓度增加,达到0.5 mmol/L时,α-Gal残余活力已经降至15.2%。表明-SH是维持α-Gal活性必须的基团。
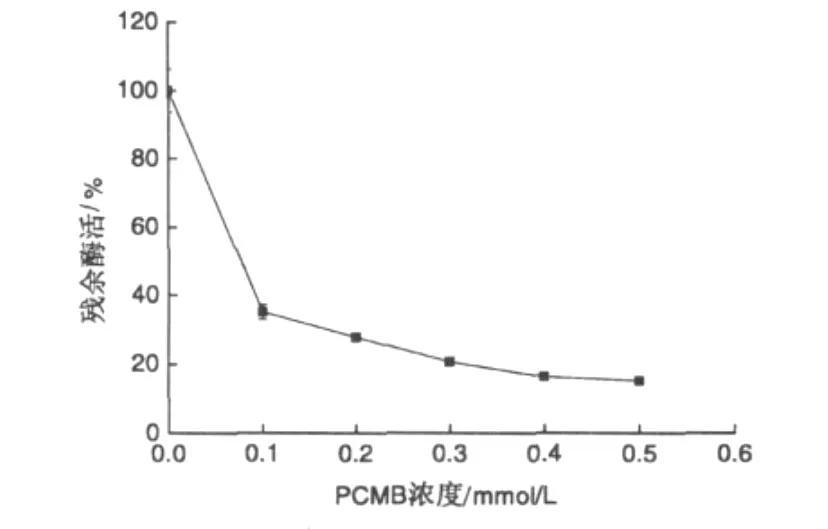
图3 PCMB对α-Gal的修饰
2.6 色氨酸残基的化学修饰
在酸性条件下,NBS能够选择性地修饰蛋白质中的 Trp 残基[13-14]。
(1)色氨酸残基总数的测定
向酶液中加入8mol/L的尿素,加热煮沸5min,置于透析袋中透析,除去尿素。测定酶活,发现检测不出酶活,说明α-Gal已经完全变性。再用不同量的NBS(4mmol/L)修饰,测其280 nm处的吸光值,结果如图4所示。根据A280nm的下降数值计算被氧化修饰的 Trp残基数[15]。
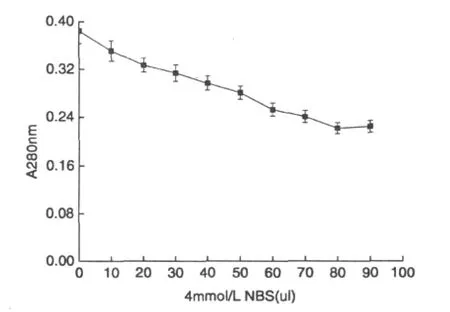
图4 NBS对吸光度的影响
当加入80 μLNBS时,A280达到最低值,继续加入,A280有所回升,说明Trp残基已全部被修饰。计算A280达到最低值时和未添加NBS时的α-Gal酶液的吸光值的差值,得到ΔA280nm。带入公式计算,发现NBS共修饰了15个Trp残基。由于尿素使α-Gal变性后分子内部氨基酸完全暴露,可全部被修饰,所以发芽咖啡豆α-Gal分子中共有15个色氨酸残基。
(2)色氨酸残基的修饰与酶活力的定量关系
采用邹氏作图法研究酶的修饰与酶活力的定量关系,该方法已成为化学修饰定量处理的主要方法[16]。用不同量的NBS修饰发芽咖啡豆α-Gal,同时测定其酶活,以不加NBS的酶液酶活为100%。
其测定结果按照下式进行数据处理:
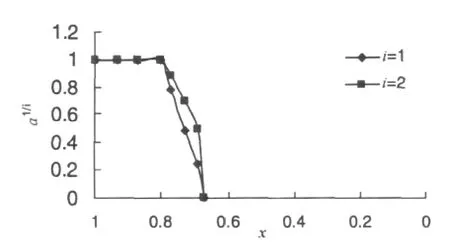
图5 α-Gal残余活力分数与被修饰色氨酸残基残余分数的关系
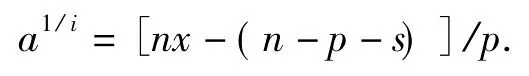
式中:a是活力剩余分数;x是Trp残基的剩余分数;n是Trp残基的总数;s是反应最快的非必需基团数;p是反应较快的基团数,其中包括i个必需基团。
利用邹氏作图法处理数据[10],结果如图5所示。当i取值为1时,以a1/i对x作图基本符合直线关系,得到较好的拟合。当i取值为2时,以a1/i对x作图不符合直线关系。根据邹氏作图法的原理,取符合直线拟合的数据来反映酶残余活力分数与被修饰Trp残基残余分数的关系。
当i=1时,将符合直线关系的数据作图,以α-Gal残余活力分数a为纵坐标,以被修饰色氨酸残基残余分数x为横坐标。得到的直线如图6所示。
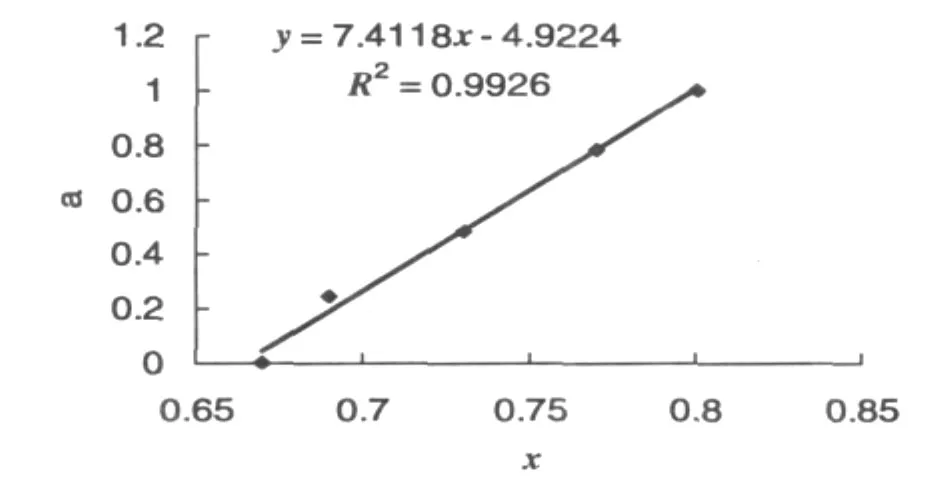
图6 α-Gal残余活力分数与被修饰色氨酸残基残余分数的关系
从直线关系得到:n/p=7.4118;(n-p-s)/p=4.9224。α-Gal中 Trp残基总数为 15,经计算,p值约为2;s值约为3。这说明在发芽咖啡豆α-Gal的15个色氨酸残基中,有3个反应最快的酶活性非必需基团;2个反应较快的基团,其中1个为酶活性必需基团;还有10个反应最慢或根本不反应的基团。
3 结束语
在一定浓度条件下,化学修饰剂对发芽咖啡豆α-Gal的化学修饰结果显示:色氨酸是α-Gal活性中心的必需氨基酸,-SH、-COOH和组氨酸对α-Gal的活性有影响,精氨酸、赖氨酸和-S-S-不是α-Gal的必需基团。
邹氏作图法显示发芽咖啡豆α-Gal中色氨酸残基总数为15,其中有3个反应最快的酶活性非必需基团;2个反应较快的基团,其中1个为酶活性必需基团;还有10个反应最慢或根本不反应的基团。
[1] 杨冠东,刘芳,李荷.α-半乳糖苷酶的研究进展概况[J].现代食品科技,2006,22(3):275-276,279.
[2] Dey P M,Pridham J B.Biochemistry of α-galactosidase [J].Advances in Enzymology and Related Areas of Molecular Biology,1972,36:91-130.
[3] Koizumi K,Tanimoto T,Fujita K,et al.Preparation,isolation,and characterization of novel heterogeneous branched cyclomalto-oligosaccharides having β--galactosyl residue(s)on the side chain[J].Carbohydrate Research,1993,238:75-91.
[4] Peters F,Vermeulen A,Kho T.Anderson-Fabry's disease:α-galactosidase deficiency J].Lancet,2001,357:138-140.
[5] Lenny L L,Goldstein J.The production of group O cells[J].Biotechnology,1991,19:75-100.
[6] Marraccini P,Rogers W J.Biochemical and molecular characterization of from coffee beans[J].Plant Physiology and Biochemistry,2005,43:909-920.
[7] Shen W,Jin Z,Xu X,et al.New source of α-D-galactosidase:germinating coffee beans [J].Food Chemistry,2008,110:962-966.
[8] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254
[9] Miles E W.Modification of histidyl residues in proteins by diethylpyrocarbonate[J].Methods in Enzymology,1977,47:431-442.
[10] 钱世钧,郝凤兮,孟广震.大肠杆菌AS1.375 L-天门冬酰胺酶的选择性化学修饰[J].微生物学学报,1984,24:352-356.
[11] 夏初临,陈惠黎.人胎盘谷胱甘肽S-转移酶动力学及抑制剂的研究[J].生物化学杂志,1989,5(4):294-300.
[12] Spande T F,Witkop B E.Methods in Enzymology[M].New York:Academic Press,1967
[13] 王红梅,刘嘉莉,杨萍,等.聚半乳糖醛酸酶中色氨酸残基的化学修饰[J].高等学校化学学报,1995,16:211-215.
[14] 阎伯旭,曲音波,高培基.色氨酸残基在内切葡聚糖酶分子中的作用[J].中国生物化学与分子生物学报,1998,14:181-185.
[15] 刘仙,高国粉,杨丽,等.菊粉酶中色氨酸残基的化学修饰及其荧光光谱[J].高等学校化学学报,2007,28:23-25.
[16] 袁勤生.现代酶学[M].上海:华东理工大学出版社,2001.
