新疆加工番茄顶端叶片黄化现象的初步研究
2011-01-11崔燕华向本春
崔燕华,向本春
(石河子大学绿洲农作物病害防控重点实验室,石河子832003)
新疆是全球最适合加工番茄种植的地区之一,也是我国加工番茄种植和加工的重要基地,种植面积和生产能力占全国的90%以上[1],2009年种植面积则达到历史最高值7500hm2[2]。
加工番茄在新疆大面积栽培时间较短,但由于加工番茄特殊的栽培措施及生长特点,病虫害发生有种类日益增多,发病越来越重的趋势,使加工番茄的产量及品质受到重大影响,其中病毒病害发生比较严重。通过近2年在新疆加工番茄主产区田间深入调查,我们发现在加工番茄生长中后期植株常表现顶端叶片黄化,且全疆各地均有发生。
高温天气和生理性缺素、植物病毒等可引起植物黄化[3-4],高温天气和生理性缺素引起的黄化病属于非侵染性病害,其病害分布特点与侵染性病害不同。加工番茄病毒病在田间多引起花叶、环斑、畸形、变色和坏死等症状[4]。变色中的黄化主要指叶片的局部或全部颜色黄化。目前,能引起番茄产生黄化的病毒主要为番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)[5]、番茄侵染性褪绿病 毒 (tomato infectious chlorosis virus,TICV)[6]和 番 茄 褪 绿 病 毒 (tomato chlorosis virus,ToCV)[7]。番茄黄化曲叶病毒病的典型症状为植株矮化,上部叶片和新芽黄化、卷曲;番茄侵染性褪绿病毒病主要表现为脉间黄化,叶片从下部向上部逐渐变黄,有时老叶出现叶卷和坏死斑点。番茄褪绿病毒病的症状与番茄侵染性褪绿病毒病的症状相似。
加工番茄顶端黄化与普通的黄化症状表现不一致,目前尚无文献报道。本实验对此进行了初步的研究。
1 材料与方法
1.1 材料
1.1.1 毒源
2009年7月-2010年9月,从新疆兵团农六师军户农场、共青团,农七师123团、125团,农八师143团、145团、147团,农十二师三坪农场,呼图壁县,玛纳斯县,石河子大学农试场,石河子大学农学院实验站,乌苏县,吉木萨尔县,和硕县等15个地区采集加工番茄顶端黄化样品。
1.1.2 实验试剂
磷钨酸、Na2HPO4、NaH2PO4、NaCO3、NaHCO3、NaCl、Tween-20、浓硫酸、邻苯二胺等均为国产分析纯;硝酸(优级纯);30%H2O2(优级纯);超纯水(18.25MΩ.cm);辣根酶标记山羊抗小鼠IgG购自北京博奥森生物技术有限公司;酶联免疫板(costar 3590)购自Corning公司。
标准溶液:K、Ca、Na、Mg混合标准溶液50μg/mL,100μg/mL,200μg/mL;B、Mn、Mo、Zn混合标准溶液0.5μg/mL,1.0μg/mL;Fe单元素标准溶液5μg/mL,10μg/mL。溶液用超纯水配制。
1.1.3 抗血清
番茄花叶病毒(tomato mosaic virus,ToMV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、蚕豆萎蔫病毒(broad bean wilt virus,BBWV)的单克隆抗体,ToMV和烟草花叶病毒(tobacco mosaic virus,TMV)抗体均由浙江大学生物技术研究所周雪平教授惠赠。
1.1.4 特异性引物
根据已报 道 的 TMV[8]、ToMV[2]、CMV[9]、马铃薯M病毒(potato virus M,PVM)、马铃薯S病毒(potato virus S,PVS)的外壳蛋白基因序列设计引物(表1),由上海生工公司合成。

表1 TMV、ToMV、CMV、PVM、PVS的特异性引物Tab.1Special primers of TMV,ToMV,CMV,PVM and PVS
1.2 方法
1.2.1 田间调查与采样
从新疆加工番茄主产区农六师军户农场、共青团农场,农七师123团、125团,农八师143团、145团、147团,农十二师三坪农场,呼图壁县,玛纳斯县,石河子大学农试场,石河子大学农学院实验站,乌苏县,吉木萨尔县,和硕县等地采集表现正常及顶端黄化植株样品,并进行田间症状、分布特点、发病率的调查。
1.2.2 顶端叶片元素含量测定
选取农八师147团17连,农七师143团11连,石河子大学农试场4连,石河子大学农学院实验站的正常植株及表现顶端黄化植株的顶端叶片进行K、Ca、Na、Mg、B、Fe、Mn、Mo、Zn元素含量测定,每个样品设4个重复。
样品前处理参考诸堃等[10]的方法:在105℃杀青30min,75℃下烘2-3d后室温储存备用。
微波消解[11]:称取0.5~1.0g处理后的番茄样品于消化罐,加入8mL硝酸和3mL 30%H2O2,置于微波消解炉内(空白对照只加入8mL硝酸和3 mL 30%H2O2),于功率1500W 下消化40min。微波炉上赶酸,冷却后定容至50mL,用电感耦合等离子发射光谱仪测定元素含量,每个样品测定3次。
1.2.3 田间样品病毒提纯及病毒粒子电镜观察
参考并改进周雪平等[12]的方法:取150g新采集的田间样品加300mL 0.2mol/L pH 7.2的磷酸缓冲液(含0.005mol/L EDTA,1%巯基乙醇)匀浆,滤液中加入30%(W/W)氯仿,振荡15min后,5000r/min离心20min;上清液中加入6%(W/V)PEG-6000和0.25mol/L NaCl,4 ℃下搅拌溶解4 h,冰箱中放3~4h,5800r/min离心30min;沉淀用上述磷酸缓冲液悬浮,4℃搅拌30min;6000r/min离心15min;上清液在超速离心机中4℃下35000r/min离心2h,沉淀重新悬浮后,6000r/min离心15min。上清液即为病毒粒子粗提液。提纯的病毒粗提液用1%磷钨酸负染后,透射电镜观察[13]。
1.2.4 间接酶联免疫吸附法(ELISA)测定田间样品
采用间接ELISA方法,用稀释的待测抗原包被微量反应板16~18h,封闭后,加适量稀释的被测抗原的抗体 ToMV(1∶10000)、CMV(1∶5000)、BBWV(1∶3000)单克隆抗体,ToMV 和 TMV(1∶5000)抗体0.1mL,反应后再加适当浓度的酶标抗体,经TMB底物反应显色,加2mol/L硫酸终止。然后在BIO-RAO Model 550酶联免疫检测仪上,于490nm处,以空白对照孔调零后测各孔OD值[14-15]。将待测样品OD值与阴性对照OD值进行比较 :(P/N)<1.5视为阴性;1.5≤P/N<2.1视为可疑;P/N≥2.1视为阳性(染病);P/N>5视为强阳性[16]。每个样品设3个重复。
1.2.5 病毒总RNA的提取
病毒总RNA的提取采用改良的LiCl方法进行[17]。
1.2.6 cDNA的合成
cDNA反转录在25μL体系中进行。取植物总RNA 8μL、R9随机引物(或 M4T)2μL、10mmol/L dNTP 4μL、buffer 4μL、RNasin inhinbitor 1 μL。将以上试剂混合后室温放置30min后加入1 μL M-MLV (200U/μL)反转录酶,42 ℃孵育60 min,72℃10min,4℃保存备用。
1.2.7 PCR扩增
PCR反应在25μL体系中进行。体系如下:10×buffer 2.5μL、2.5mmol/L dNTP 1.0μL、10 μmol/L上游引物和下游引物各1.0μL、cDNA模板0.5μL、Taq DNA 聚合酶(2U/μL)0.25μL、ddH2O 18.25μL,混合后于PCR仪上完成PCR反应,反应结束后将PCR产物保存在4℃备用。TMV和PVM的扩增程序为94℃预变性4min;94℃变性45s;50℃退火35s;72℃延伸45s,30个循环后72℃继续延伸10min。ToMV和CMV的扩增程序为94℃预变性4min;94℃变性45s;52℃退火45s;72℃延伸50s,30个循环后72℃继续延伸10min。PVS的扩增程序为94℃预变性4min;94℃变性45s;55℃退火35s;72℃延伸30s,30个循环后72℃继续延伸10min。PCR产物经1.0%琼脂糖凝胶电泳后观察。

图1 加工番茄顶端黄化症状Fig.1Top-yellowing of infected processing tomato
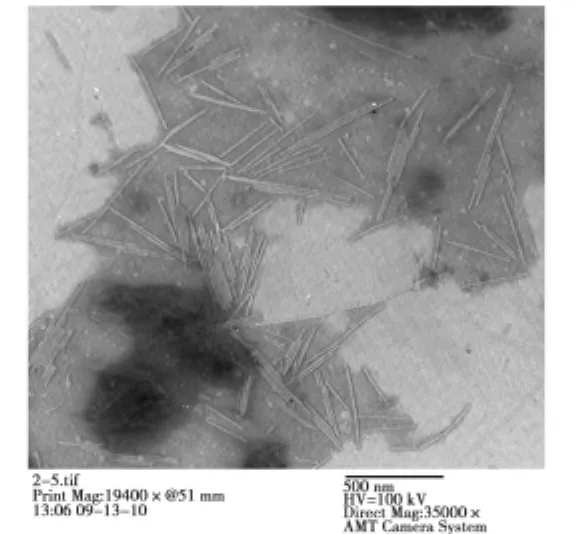
图2 加工番茄顶端黄化病毒粗提液的电镜照片Fig.2The electron micrograph of virus preparation from top-yellowing of processing tomato
2 结果与分析
2.1 加工番茄顶端黄化病田间分布及发病率
2009-2010年的新疆加工番茄主产区的田间调查结果见2。加工番茄顶端黄化在全疆各地均有发生,症状基本一致,均是植株顶端出现黄化,而中、下部叶片表现正常(图1),田间呈随机分布状。不同地块和不同时间调查发现,加工番茄顶端黄化发生于7月下旬,直到果实采收。随着时间推移,发病率逐渐增加。发病率多为2%~50%。加工番茄品种内均有发病,但无明显差异。

表2 新疆加工番茄顶端黄化田间分布及发病率Tab.2The field distribution and incidence of top-yellowing of processing tomato in Xinjiang
2.2 样品中9种元素含量测定
通过微波消解、电感耦合等离子体发射光谱法检测了加工番茄顶端黄化样品及同一田块正常植株样品中9种元素的含量。结果显示,田间感病植株中B、K、Mo、Na、Zn的含量明显高于同一田块的正常叶片,而 Mg、Mn的含量(μg/g)稍微低于同一田块的正常叶片(表3、表4)。RSD为0.2539%~4.0752%。
2.3 病毒的提纯及电镜观察结果
观察结果(图2)显示:在田间顶端黄化植株中既存在粒子长度为300nm左右的病毒,又有长度为700 nm左右和超过1000nm的病毒存在,这表明加工番茄顶端黄化样品中存在多种病毒粒子。
2.4 间接酶联免疫吸附法测定田间样品
利用TMV、ToMV、CMV、BBWV的抗体对田间表现顶端黄化样品进行了ELISA检测,检测结果表明:30个样品中有29个样品呈阳性含有ToMV病毒,可能含有ToMV病毒的样品1个(P/N为2.022>1.5),其中P/N>5的强阳性样品7个,检测率为96.7%;30个样品均带有CMV病毒,强阳性样品7个,检测率为100%;20个样品带有TMV病毒,检测率为66.7%;21个样品带有BBWV病毒,P/N>1.5的可能含有BBWV病毒的样品9个,4个为强阳性样品,检测率为70.0%(表5)。

表3 加工番茄顶端黄化植株与正常植株顶端叶片中9种元素含量测定Tab.3The content detection of nine elements in processing tomato with top-yellowing and normal plants
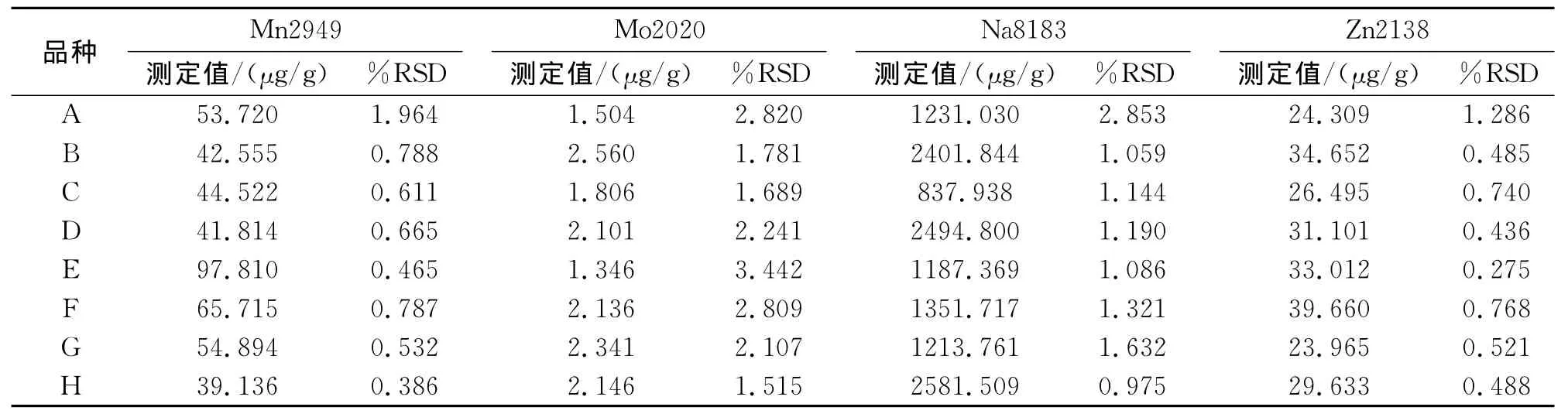
表4 加工番茄顶端黄化植株与正常植株顶端叶片中9种元素含量测定Tab.4The content detection of nine elements in processing tomato with top-yellowing and normal plants

表5 田间样品ELISA检测结果Tab.5ELISA detection of processing tomato samples with top-yellowing

续表5
2.5 田间样品RT-PCR检测
提取石河子大学农试场站4连田间顶端黄化番茄样品的总RNA,利用TMV(图3)、ToMV(图4)、CMV(图5)、PVS(图6)、PVM(图7)等的特异性引物进行RT-PCR,获得了与预期目标同样大小的片段。

图3 引物对TA/TB的RT-PCR扩增产物凝胶电泳图Fig.3The agrose gel eletrophoresis of RT-PCR products of the TA/TB primer
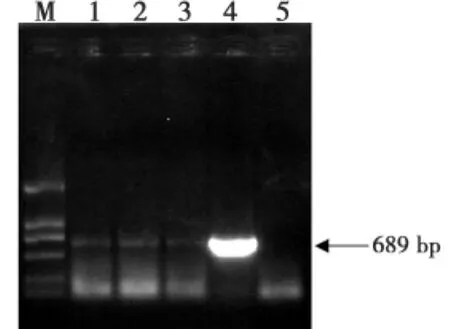
图4 引物对To1/To2的RT-PCR扩增产物凝胶电泳图Fig.4The agrose gel eletrophoresis of RT-PCR products of the To1/To2primer

图5 引物对C1/C2的RT-PCR扩增产物凝胶电泳图Fig.5The agrose gel eletrophoresis of RT-PCR of the C1/C2primer
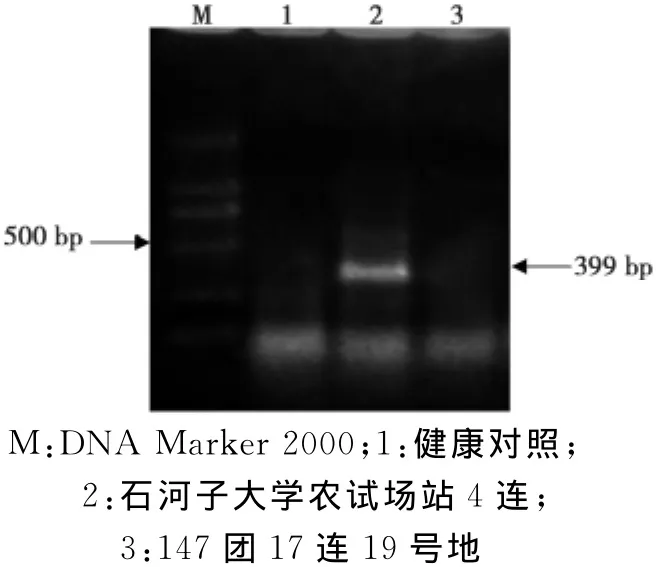
图6 引物对PVS-F/R的RT-PCR扩增产物凝胶电泳图Fig.6The agrose gel eletrophoresis of RT-PCR products products of thePVS-R/L primer

图7 引物对PVM-F/R的RT-PCR扩增产物凝胶电泳图Fig.7The agrose gel eletrophoresis of RT-PCR products of thePVM-R/L primer
3 讨论与结论
1)2009-2010年对呼图壁县、玛纳斯县、石河子市周边、乌苏县、奎屯市周边、吉木萨尔县、和硕县等新疆加工番茄主产区进行的广泛调查,初步明确了加工番茄顶端黄化在新疆广泛发生,症状表现一致,田间随机分布,但发病率和发病程度有一定差异,但在品种、栽培方式上无明显差异。
2)利用微波消解、电感耦合等离子体发射光谱法对表现顶端黄化植株和正常植株顶端叶片中9种元素含量测定的结果表明田间感病植株除Mg、Mn元素稍微偏低外,其他如B、K、Mo、Na、Zn的含量都明显高于同一田块的正常叶片。加工番茄顶端黄化的发病率不高,同时在田间随机分布。且据报道高温天气和生理性缺素引起的黄化病属于非侵染性病害[3],在田间大面积发生,无发病中心。因此,初步认为加工番茄顶端黄化并非由生理性缺素引起。
3)利用电镜观察、ELISA和RT-PCR扩增法均证明顶端黄化样品中有多种病毒的存在。许多文献报道,多种病毒能危害加工番茄,且有些病毒也能引起黄化,虽然这些黄化与番茄顶端黄化有所不同,但本研究确实证明在顶端黄化叶片中有病毒存在。因此,初步认为这种黄化可能与病毒有关,但这些病毒中哪一种病毒引起加工番茄顶端黄化,或者这些病毒是否通过混合感染引起黄化还有待于进一步研究。
[1]杨关勇,李宏,曹金芳.新疆加工番茄产业发展探讨[J].农村科技,2006(2):50-51.
[2]姜玉霞,向本春,安仙丽,等.新疆加工番茄上番茄花叶病毒的分子鉴定[J].新疆农业科学,2008,45(3):484-489.
[3]孙茜.番茄疑难杂症图片对照诊断与处方[M].北京:中国农业出版社,2005.
[4]裘维蕃.植物病毒学[M].北京:科学出版社,1985.
[5]周涛,师迎春,陈笑瑜,等.北京地区番茄黄化曲叶病毒病的鉴定及防治对策[J].植物保护,2010,36(2):116-118.
[6]Sedyo Hartono,Tomohide Natsuaki,Haruki Sayama.Yellowing disease of tomatoes caused by tomato infectious chlorosis virus newly recognized in Japan[J].J Gen Plant Pathol,2003,69:61-64.
[7]Jane Morris,Elspeth Steel,Penny Smith.Host range studies for tomato chlorosis virus,and Cucumber vein yellowing virus transmitted by Bemisia tabaci (Gennadius)[J].European Journal of Plant Pathology,2006,114:265-273.
[8]周雪平,刘勇,薛朝阳,等.烟草花叶病毒蚕豆株系外壳蛋白基因3′端非编码区的克隆与序列分析[J].病毒学报,1997,13(3):240-247.
[9]宋婷婷,陈荣溢,杨雷亮.应用多重RT-PCR检测烟草上的 TMV和CMV[J].辽宁农业科学,2007(1):53-54.
[10]诸堃,王君,李刚.微波消解-ICP-AES测定植物样品中多种微量元素[J].光谱实验室,2009,26(5):1168-1171.
[11]Carmen Cristina Elekes,Irina Dumitriu,Gabriela Busuioc.The appreciation of mineral element accumulation level in some herbaceous plants species by ICP-AES method[J].Environ Sci Pollut Res,2010,17:1230-1236.
[12]周雪平,陈集双,李德葆.马铃薯Y病毒组病毒高产量提取方法的建立[J].微生物学通报,1994,21(3):184-186.
[13]Monette P L,James D.Use of in vitro cultures of Nicotiana benthamiana for the purification of grapevine virus A[J].Plant Cell,Tissue and Organ Culture,1990,23:131-134.
[14]许文博,都业娟,黄家风.加工番茄CMV与TOMV的ELISA检测及其相关性分析[J].石河子大学学报:自然科学版,2009,27(2):199-201.
[15]Wahyuni W S,Dietzgen R G,Hanada K.Serological and biological variation between and with subgroupⅠandⅡstrains of cucumber mosaic virus[J].Plant Pathol,1992,41:282-297.
[16]柳爱春,刘超,赵芸,等.利用ELISA检测两种兰花病毒的研究[J].浙江农业科学,2009,21(2):92-95.
[17]常波,向本春,刘升学,等.加工番茄条斑坏死病原黄瓜花叶病毒外壳蛋白基因的克隆和序列分析[J].石河子大学学报:自然科学版,2006,24(4):420-414.
