致奶牛乳房炎链球菌新疆分离株的α-半乳糖苷酶酶活性测定及分析
2011-01-11王晓兰王静梅剡根强韩伟
王晓兰,王静梅,剡根强,韩伟
(石河子大学动物科技学院,石河子832003)
1985年Bau首次从Bottom yeast中分离出α-半乳糖苷酶,但是直到20世纪80年代,学者们才开始对α-半乳糖苷酶进行大规模的深入研究,目前该酶在食品、饲料、医药工业等领域的应用受到高度重视。
α-半乳糖苷酶(α-Galactosidase,E.C.3.2.1.22),属外切糖苷酶类,特异性水解具有α-半乳糖苷结构的碳水化合物,如蜜二糖、棉子糖和水苏糖等低聚糖[1]。通过对各种碳水化合物为基质的蜜二糖酶特性的研究,发现该酶的主要作用对象是以具有α-半乳糖苷[3]结构的碳水化合物,因此后来将蜜二糖酶命名为α-半乳糖苷酶。
奶牛乳房炎是影响新疆奶业发展的主要因素,所以调查奶牛乳房炎病原[2],选择有效药物预防和治疗奶牛乳房炎就显得尤为重要。链球菌是导致牛乳腺炎较常见的细菌,在自然界分布广泛,于健康奶牛的皮肤、牛奶及乳房内均可分离到该类这些细菌。
本实验主要对北疆地区石河子、奎屯、克拉玛依等地区14个规模化奶牛场临床型乳房炎进行病原的细菌学调查,再对分离出的101株链球菌进行种属的生化鉴定。而酶学活性测定是酶学研究,细菌分类的关键,其中的产α-半乳糖苷酶活性测定按伯杰细菌[3]分类中鉴定链球菌是必不可少的关键步骤之一。因而,有必要探索出在畜牧兽医方面检测α-半乳糖苷酶活性测定的方法。
1 材料与方法
1.1 材料
1.1.1 菌种
101株链球菌从北疆地区奶牛场临床型乳房炎乳样中分离、纯化而得到;α-半乳糖苷酶阳性菌株(酵母菌、屎肠球菌、黑曲霉),购自国家兽医微生物菌种保藏中心(CVCC)。
对硝基酚α-D-吡喃半乳糖苷(pNP-α-Gal),(批号:10646)购于Sigma公司(美国);美国伯乐550酶标仪。
1.1.3 试验溶液
醋酸钠缓冲液(0.05mol/L、pH 值为5.5):A液为称取3个结晶水的醋酸钠0.680g定容至100 mL,B液为吸取冰醋酸0.3mL定容至100mL。用B液调节A液pH值为5.5。
对硝基酚-α-D-吡喃半乳糖苷溶液[4](10mmol/L):称取0.068g对硝基酚α-D-吡喃半乳糖苷,用醋酸钠缓冲液(0.05mol/L、pH 值5.5)溶解,置于盛有10mL蒸馏水的棕色试剂瓶中,于4℃冰箱保存备用。
将新鲜的培养好的101株链球菌中,每管分别加入无菌生理盐水(冷却至室温)3mL左右,制备成菌悬液。
1.2 方法
1.2.1 测定方法
吸取100μL制备好的菌悬液,置于微量酶标板孔上,在405nm波段上测定其吸光度(OD值)作为本底值,同样用移液排枪一并吸入100μL底物液与菌悬液100μL(1∶1)充分混合并振荡,在酶标仪405 nm波段上再次测定其吸光度(OD值),对101株链球菌测定OD值(均设阳性对照和阴性对照)。
1.2.2 不同链球菌培养基对酶促反应的影响
手术完毕后仔细检查甲状旁腺,同时根据具体情况进行以下处理:(1)对可疑的甲状旁腺组织,切取部分送术中冰冻,确认为旁腺后自体移植。(2)如甲状旁腺血供良好,呈淡黄色或棕色,行原位保留。(3)如甲状旁腺变为暗紫色,用注射器针头穿刺或尖刀片切开其包膜,如颜色仍无好转,及时切除后行自体移植。(4)明确为误切的甲状旁腺行自体移植。移植方法为:将甲状旁腺切成约1 mm大小组织块移植于同侧的胸锁乳突肌或带状肌内。
将待测菌株分别接入血斜面培养基、API STREP培养基和链球菌选择性培养基,按1.2.1中的测定方法,分别测定3次,取其平均值。
1.2.3 不同产α-半乳糖苷酶阳性菌株的比较
选用培养基:将产α-半乳糖苷酶的阳性菌酵母菌和屎肠球菌接种于所选适宜的培养基,按1.2.1中的测定方法,分别测定3次,取其平均值。
1.2.4 酶促反应时间进程对产α-半乳糖苷酶活性的影响
按1.2.1将反应液[5](100μL底物液与100μL菌悬液比例1∶1)充分混合振荡后,反应液于40℃下分别选择合适的时间间隔保温,测定产α-半乳糖苷酶菌株的吸光值,分别测定3次,取其平均值。
1.2.5 反应体系pH值对α-半乳糖苷酶活性的影响
用冰乙酸和氢氧化纳溶液配制pH值从4.5到7.5,级差为1的缓冲液。用级差不同pH值的缓冲液制备对硝基酚α-D-吡喃半乳糖苷溶液,制备底物液并且再次测定其pH值,然后根据1.2.1中的测定方法测定吸光值,分别测定3次,取其平均值。
2 结果与分析
2.1 产α-半乳糖苷酶阳性链球菌的检出率
对101株链球菌随机分为A、B、C、D、E五组,按1.2.1的方法测定(当所测定链球菌的OD值大于阴性对照拟判定为产α-半乳糖苷酶的阳性链球菌,当所测定链球菌的OD值小于阴性对照拟判定为产α-半乳糖苷酶的阴性链球菌)。结果(表1)表明,对于造成奶牛乳房炎主要病原菌之一的链球菌,每一组均有产α-半乳糖苷酶阳性链球菌的菌株,且比例较高。

表1 产α-半乳糖苷酶阳性检出率Tab.1The results ofα-Galactosidase positive rate
2.2 不同链球菌培养基对酶促反应的影响
将101株链球菌接种于API STREP培养基中,实验过程中发现链球菌的生长较为贫瘠、散落,链球菌菌量很少,对于测定产α-半乳糖苷酶链球菌的方法和判断都会造成影响,故弃用。
菌株在链球菌选择性培养基上生长饱满、密集,链球菌菌量较足,避免了血斜面培养基血液中的一些物质对产α-半乳糖苷酶造成的干扰。因此,本实验选用链球菌选择性培养基做为首选培养基。图1显示,含有血斜面的培养基比链球菌选择性培养基的OD值差异显著(P<0.05)。
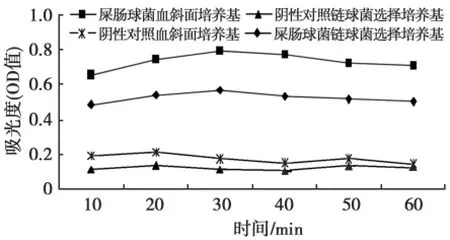
图1 不同培养基对产α半乳糖苷酶的酶促反应的影响Fig.1The influence of different culture medium to enzymatic reaction ofα-Galactosidase
2.3 不同产α-半乳糖苷酶阳性菌株的选择
图2显示,产α-半乳糖苷酶阳性菌株的酵母菌比屎肠球菌OD值差异显著(P<0.05)(由于黑曲霉[5]对生物安全的危害较大,故未检测),因此筛选出的酵母菌为产α-半乳糖苷酶标准阳性菌株。

图2 不同产α-半乳糖苷酶阳性菌株的比较Fig.2The results of comparison positive different isolates producingα
2.4 酶促反应时间进程对产α-半乳糖苷酶活性的影响
图3显示,反应开始前2~10min反应速度最快,10min时吸光值为0.406,达到最高,之后反应速度减缓,酶活力下降,20min时降至最低,随后趋于平缓。

图3 酶-底物作用的时间对酶活的影响Fig.3The time of enzyme-substrate response to enzyme live influence
2.5 反应体系pH值对α-半乳糖苷酶活性的影响
图4显示,α-半乳糖苷酶的最适pH值为5.5,α-半乳糖苷酶在一定的pH范围内(4.5~7.0)保持相当的活性。
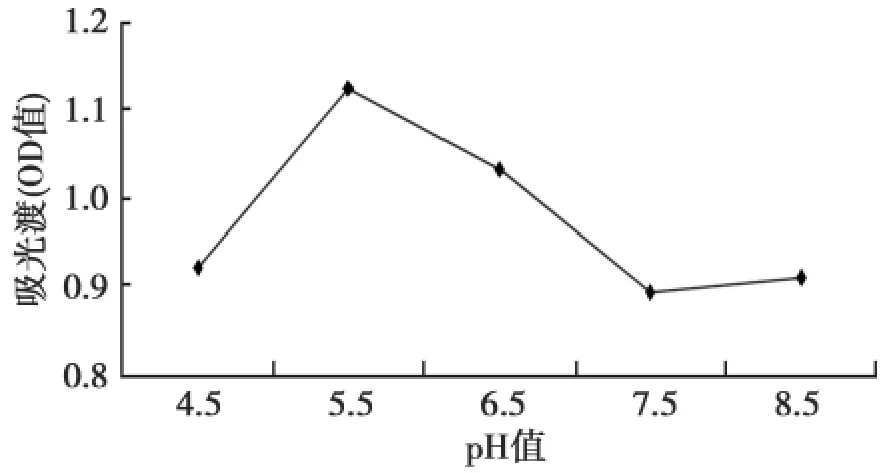
图4 反应体系pH值对α-半乳糖苷酶活性的影响Fig.4The influence ofα-Galactosidase to the pH value
3 讨论
通过对本实验结果的分析,发现影响α-半乳糖苷酶活力的因素为:酶-底物的反应条件(pH、菌株、使用时间)、链球菌生长周期、选择性链球菌的培养基、缓冲液的配制、底物溶解度和底物溶液的浓度。这些因素将直接或间接影响酶-底物的酶促反应的结果。
链球菌对生长的营养环境要求较高,有明显的溶血现象[2],且血液中含有各种蛋白质、酶的诱导剂和颉抗剂、矿物质等。为避免以上因素对α-半乳糖苷酶实验结果判定和测定方法的干扰,弃用血斜面培养基。
酶促反应的限速步骤一般为一级反应或二级反应的速度,而且初始反应物浓度较高,有利于反应的正向进行,因而在反应初期表现为速度较快,也正是表征酶活力的关键参数。故此反应时间不宜过长,为了提高实验结果准确性,本底值宜选择较小值。
酶促反应所用的缓冲溶液也会直接影响到酶的活力。缓冲液的pH值则因不同产α-半乳糖苷酶的菌株的不同而异。pH值不仅影响酶分子的空间构像,也会影响底物分子的解离状态,测定酶活力时通常用pH值恒定的缓冲溶液。李孝辉等[8]指出,pH在5.0~6.5时α-半乳糖苷酶活性比较稳定。对于从北疆地区奶牛乳房炎样品中分离出来的主要病原菌之一链球菌,产α-半乳糖苷酶活力最佳时反应体系的pH 值5.5为最佳,在pH(4.5~7.0)值较宽范围均能保持相当的活性。
目前,关于测定α-半乳糖苷酶与底物pNP-α-Gal作用所需的时间,报道不一[8-10]。本实验测定α-半乳糖苷酶活力最佳时间为10min,同文献[4,8]的结果一致。
[1]Naumoff D G.Phylogenetic analysis ofα-galactosidases of the GH27family[J].Molecular Biology,2004,38:388-399.
[2]陆承平.兽医微生物学[M].北京:中国农业出版社,2001.
[3]东秀珠,蔡秒英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[4]王春林,陆文清.饲用型青酶α-半乳糖苷酶活力测定的研究[J].工业微生物,2005,35(1):28-31.
[5]高红伟,宫锋,王璇琳,等.α-半乳糖苷酶活性测定方法的研究[J].军事医学科学院院刊,2006,30(6):559-561.
[6]高新.α-半乳糖苷酶及其在输血等方面的应用[J].中国实验血液学杂志,2000,8(3):236.
[7]潘宝海.扬奇青霉发酵生产饲用α-半乳糖苷酶的研究[D].北京:中国农业大学,2002.
[8]李孝辉,竺莉红,吴吉安,等.青霉α-半乳糖苷酶的纯化及酶学性质的研究[J].浙江农业学报,2003,15(2):99-102.
[9]Lenney L L,Hurst R,Goldstein J,et al.Tansfusion to group subjects of 2units of red cells enzymatically converted from group B to group A[J].Tansfusion,1994,34(3):209.
[10]潘宝海,李德发,陆文清,等.对硝基酚-α-D-吡喃半乳糖法测定饲用α-半乳糖苷酶(黑曲霉)活力的方法[J].中国农业大学学报,2002,7(5):107-111.
