杂色鲍β-1, 3-葡聚糖识别蛋白基因的克隆和表达
2011-01-11王宝珍张子平王艺磊王国栋邹志华王淑红贾锡伟
王宝珍, 张子平, 王艺磊, 王国栋, 邹志华, 王淑红, 贾锡伟
(1. 集美大学 水产学院 水产科学技术与食品安全重点实验室, 福建 厦门 361021; 2. 美国德克萨斯州立大学 化学与生化系, 德克萨斯 圣马克斯 78666)
杂色鲍β-1, 3-葡聚糖识别蛋白基因的克隆和表达
王宝珍1, 张子平2, 王艺磊1, 王国栋1, 邹志华1, 王淑红1, 贾锡伟1
(1. 集美大学 水产学院 水产科学技术与食品安全重点实验室, 福建 厦门 361021; 2. 美国德克萨斯州立大学 化学与生化系, 德克萨斯 圣马克斯 78666)
从杂色鲍(Haliotis disversicolor)的表达序列标签(EST)中首先鉴定出β-1, 3-葡聚糖识别蛋白基因片段(beta-1,3-glucan recognition protein,saβgrp)。通过 5′RACE 获得 5′端序列, 并用由头至趾(head to toe)PCR方法检测全长cDNA序列的正确性。saβgrp的cDNA全长为1 459 bp, 包括387 bp的5′非编码区, 987 bp的开放阅读框, 85 bp的3′非编码区。saβgrp开放阅读框编码328个氨基酸。与现有报道的β-1,3-葡聚糖识别蛋白均含信号肽不同, 本研究所获得的杂色鲍saβGRP不含信号肽, 为非分泌型蛋白。实时定量PCR分析表明: 经副溶血弧菌诱导后, 24 h的实验组saβgrp的表达水平极显著高于对照组(P<0.01), 48 h的实验组saβgrp基因显著高于对照组(P<0.05)。
saβgrp; 副溶血弧菌; 杂色鲍(Haliotis disversicolor)
无脊椎动物因缺乏抗体和获得性免疫, 所以主要通过先天性免疫来发挥免疫防御作用。先天性免疫反应作为机体防御感染的第一道防线, 其发挥防御作用的关键主要是对病原相关分子模式(pathogenassociated molecular patterns, 简称 PAMPs)的识别,这一识别主要是由模式识别受体(pattern-recognition receptors, 简称 PRR)来完成[1]。
目前, 很多模式识别蛋白基因已被分离或克隆,如脂多糖和(或)β-1, 3-葡聚糖识别蛋白、肽聚糖识别蛋白、革兰氏阴性菌结合蛋白、C型凝集素、半乳糖苷结合凝集素、含硫酯键蛋白、纤维蛋白素原样结构域免疫凝集素、清道夫受体和hemolin等[2]。
β-1,3-葡聚糖识别蛋白(beta-1,3-glucan recognition protein, 简称 GRP), 又称β-1,3-葡聚糖结合蛋白, 与脂多糖葡聚糖结合蛋白(lipopolysaccharide and beta-1,3-glucan binding protein, 简称LGBP)属于同一基因的不同亚型[3]。两者已在很多物种中分离或克隆, 主要集中在节肢动物门(Arthropoda)甲壳纲(Crustacea), 部分软体动物也有报 道 ,如 :βgrp˙˙已 在 欧 洲 龙 虾(Homarus gammarus)[4]、凡纳滨对虾(Litopenaeus vannamei, 登录号:AY723297)、斑节对虾(Penaeus monodon)[5]、日本囊对虾(Marsupenaeus japonicus, 登录号:AB162766)、致倦库蚊(Culex quinquefasciatus, 登录号: XM_001845229)、淡水螺(Biomphalaria glabrata,登录号: EF121825)、太平洋牡蛎(Crassostrea gigas,登录号: AB377114)、盘鲍(Haliotis discus discus)[2]等中报道;lgbp已在日本囊对虾[3]、淡水螯虾(Pacifastacusleniusculus)[6]、凡纳滨对虾[7]、南美蓝对虾(Penaeus stylirostris)[8]、中国明对虾(Fenneropenaeus chinensis)[9]、合浦珠母贝(Pinctada fucata, 登录号: FJ775601)等中报道。已有报道显示β-1,3-葡聚糖识别蛋白有识别非己物 质[10-12], 激活前酚氧化酶系统[6,13-15], 激活凝血级联系统[11]和激活导致一系列细胞毒素因子/细胞溶解因子/抗菌因子释放的血细胞脱粒[16-18]等功能。
杂色鲍(Haliotis disversicolor)是中国南方一种重要的经济养殖贝类, 然而随着养殖规模的不断扩大, 养殖环境的日益恶化, 再加上种质退化现象的出现, 各种病害频繁发生, 不仅给养殖户带来重大的经济损失, 也成为制约鲍养殖持续健康发展的主要因素。本研究从杂色鲍中克隆到β-1,3-葡聚糖识别蛋白并分析经副溶血弧菌诱导后saβgrp基因在肝胰脏中的表达情况, 可为研究软体动物先天性免疫系统中的免疫识别和信号通路提供良好的参考资料, 也可为开发新的免疫增强剂提供科学依据。
1 材料与方法
1.1 材料和主要试剂
杂色鲍购自厦门培阳水产养殖有限公司, 体长(5.23±0.34)cm, 体质量(16.70±2.41)g, 于 25oC 的砂滤海水中暂养3周后用于试验。
总 RNA提取的试剂 RDP由实验室自行配制;M-MLV逆转录酶购自Promega公司, 琼脂糖凝胶回收试剂盒购自上海捷瑞生物公司, pMD18-T载体连接试剂盒购自大连宝生物公司, DH5α菌株为实验室自备, SYBR Green Realtime PCR Master Mix试剂购自TOYOBO公司, 1 kb plus DNA Ladder购自天根生化公司。
1.2 杂色鲍副溶血弧菌感染实验
暂养三周后的杂色鲍首先用不同浓度的副溶血弧菌50 μL进行腹足注射, 并用新鲜灭菌海水作为对照, 获得其半致死浓度为6.7×107cfu/mL。然后设一个实验组和一个对照组, 每组3个平行水箱, 每个水箱 20只鲍。实验组每只注射 50 μL浓度为6.7×107cfu/mL的副溶血弧菌菌液, 对照组每只注射 50 μL的新鲜灭菌海水。分别在腹足注射后的 8、24、48和 96 h采取存活个体的肝胰腺, 用液氮固定后于-80℃保存备用。副溶血弧菌(Vibro parahemolyticus)系由厦门大学张朝霞分离鉴定的鲍病原菌[19], 本课题组曾将之成功应用于研究鲍对致病菌和非致病菌的不同反应[20]。
1.3 EST序列分析
在对本实验室所构建的杂色鲍肝胰脏 cDNA线性化文库进行大规模 EST测序的基础上, 结合生物信息学方法初步筛选获得杂色鲍β-1,3-葡聚糖识别蛋白基因的序列片段, 发现其与淡水螺、致倦库蚊、太平洋牡蛎的β-1,3-葡聚糖识别蛋白基因有很高的相似性。
1.4 杂色鲍β-1, 3-葡聚糖识别蛋白基因5’cDNA末端的克隆
使用M13正反向引物对所挑选的EST克隆进行重新测序, 已知的序列片段已包含β-1, 3-葡聚糖识别蛋白基因的部分开放阅读框和 3’非编码区。在已知序列的基础上, 设计5’特异性引物进行5’cDNA末端的克隆。5’cDNA末端的克隆严格按照 SMART™RACE cDNA amplification kit (Clontech, USA)的说明书进行操作, PCR产物使用1%的琼脂糖电泳检测,分离纯化的目的基因片段连接到 pMD18-T载体上,转化到 DH5α感受态细胞中, 挑选阳性克隆进行测序, 经 3次序列拼接获得 cDNA全长, 所使用的 5’特异性引物见表1。
1.5 head to toe PCR方法检测开放阅读框的序列准确性
在所获得的β-1,3-葡聚糖识别蛋白基因 cDNA全长的5’和3’非编码区分别设计一个正向和反向引物(即βGRP head primer 和βGRP toe primer, 见表1), PCR检测开放阅读框的序列准确性。反应程序:94 ℃ 3 min, 94℃ 30 s, 68℃ 30 s, 72℃ 2 min, 35循环; 72℃ 10 min, 4℃ 10 min。回收目的片段转化到感受态细胞中, 挑选阳性克隆进行测序。
1.6 生物信息学分析
使 用 (http://cn.expasy.org/tools/pi_tool.html.)预测等电点和分子质量。采用SignalP (http://www.cbs.dtu.dk/services/SignalP)寻找信号肽序列, 预测蛋白服务器 (http://cubic.bioc.columbia.edu/predictprotein)
预测蛋白质的功能基序。蛋白多重比对使用 Bioedit(http://www.mbio.ncsu.edu/BioEdit/)来执行。用MEGA 4.0软件中的邻接法构建系统进化树。
1.7 实时荧光定量PCR
以 SYBR Green I为荧光染料, 采用实时定量PCR技术对副溶血弧菌感染后saβgrp基因进行表达分析。通过 ABI公司荧光定量引物设计软件设计saβgrp和β-肌动蛋白(β-actin)的定量引物(表 1)。PCR扩增后电泳检测无引物二聚体, 测序检测确保每对定量引物扩增出单一的含有已知序列的片段。用 3 μg DNAse处理过的 RNA 作为模板, 按照M-MLV RT Usage information (Promega) 在 20 μL反应体系中使用6碱基的随机引物进行合成cDNA第一条链。在实时定量PCR中, 每个反应用相当于25 ng RNA逆转录来的 cDNA, 在 SYBR Green PCR Master Mix (Applied Biosystems)中进行, 并用 ABI 7500 Real Time System 分析。反应条件为: 95ºC 1 min;(95 ºC 15 s; 60 ºC 60 s) 40 循环。分析溶解曲线图再次确认每对定量引物扩增出单一的PCR产物。使用相对循环阈值的方法计算相对浓度, 以2-ΔΔCT数值表示saβgpr经β-actin内校正后的表达水平 (ΔCT=saβgprCT值-β-actinCT值, ΔΔCT=实验组样品ΔCT值-校准样品ΔCT值), 每个时相检测5只鲍鱼, 每只鲍鱼进行 3次技术重复。数据采用平均值和标准误表示。采用 SPSS软件通过 t-test对ΔΔCT值进行统计分析,P<0.05(双尾检测法)为差异显著,P<0.01为差异极显著。
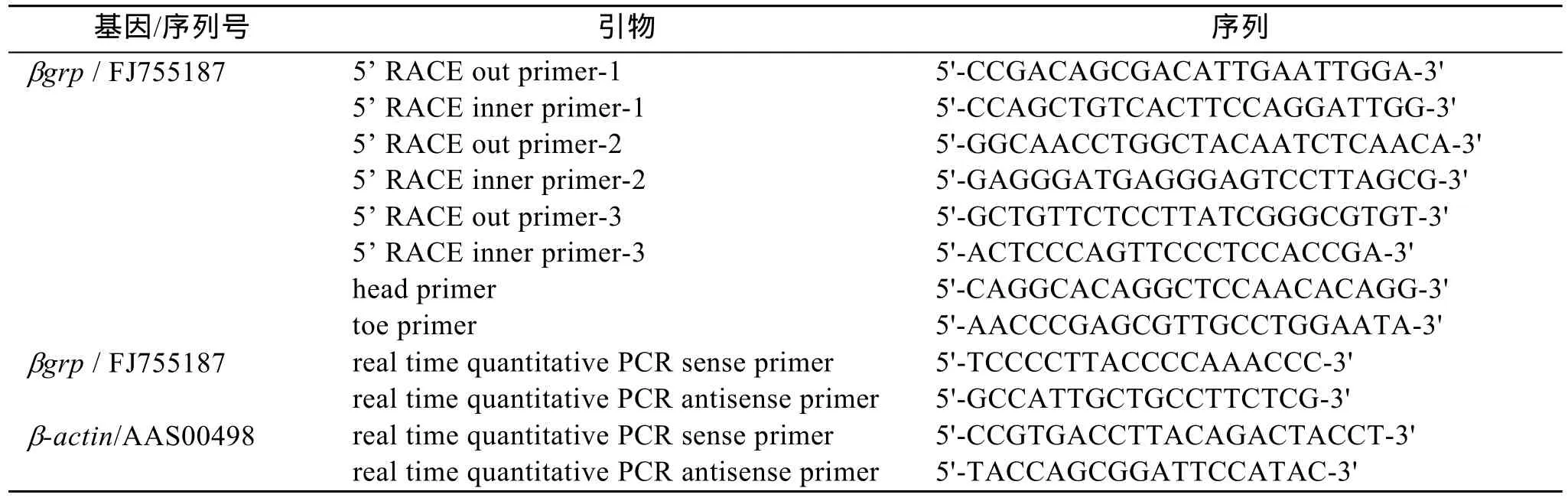
表1 本实验所用引物Tab. 1 Primers used in this study
2 结果
2.1 5’RACE 结果
β-1,3-葡聚糖识别蛋白基因5’端cDNA序列经3次序列拼接获得, 3次5’RACE所获得的目的片段大小依次分别为340 bp、389 bp和484 bp, 第一轮PCR产物没有明显特异条带出现, 第二轮 PCR产物电泳结果见图1。
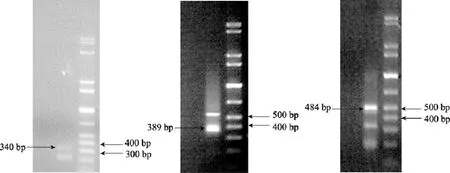
图1 saβgpr 5’RACE-PCR产物琼脂糖凝胶电泳图Fig. 1 The agarose gel electrophoresis of 5’RACE-PCR product of saβgpr
2.2 saβGRP序列分析
将5’RACE获得的3个saβgrp基因片段和来自文库的 EST序列片段进行拼接, 得到 1 459 bp的saβgrp基因全长cDNA序列(Genbank accession No.FJ755187), 且经head to toe PCR 方法检测开放阅读框序列准确无误。该序列包括387 bp的5’非编码区,987 bp的开放阅读框和85 bp的3’非编码区。3’非编码区有两个典型的polyA加尾信号。
saβgrp开放阅读框序列可编码 328个氨基酸,预测分子量为36.9 KDa, 等电点为5.90。SingalP软件分析发现saβGRP无信号肽。推测的氨基酸序列用Predict Protein软件分析发现saβGRP含有以下位点和基序(图2): 一个蛋白激酶C磷酸化位点, 一个β-1,3-葡聚糖酶位点(Trip-Glu-Ile-Asp, 即 W144-E149-I150-D151), 一个β-1,3-多糖连接识别基序(F202-G220),一个多糖结合基序(V119-P136)和一个葡聚糖酶基序(W144-A155)。此外, saβGRP没有虾βGRP特有的细胞粘着位点 RGD(Arg-Gly-Asp), 而在氨基酸序列的124位置发现EGD(Glu-Gly-Asp)。

图2 saβgrp基因全长cDNA序列及其推导的氨基酸序列Fig. 2 The full length cDNA sequence and deduced amino acid sequence of saβgrp
另外, 挑选包括杂色鲍在内的 9个无脊椎动物的β-1,3-葡聚糖识别蛋白的氨基酸序列, 采用Bioedit软件进行多重序列比对(图3), 发现杂色鲍的序列稍微不同于其他物种的序列, N端序列短于其他物种。尽管一些保守的基序均能在序列中发现, 但是氨基酸序列长度因物种不一样而有差异。

采用 MEGA 4.0软件, 以邻位相连法构建系统进化树(图 4)。软体动物和节肢动物分成两个支, 然而杂色鲍自成一支。

图3 杂色鲍和其他物种βGRP氨基酸序列的多重比较Fig. 3 Multiple alignment of the βGRP amino acid sequences of Haliotis diversicolor and other species
2.3 副溶血弧菌感染后saβgrp基因的表达结果
经副溶血弧菌诱导后,saβgrp在肝胰脏中的表达结果见图 5。统计学分析显示, 24 h的实验组saβgrp表达水平极显著高于对照组(P<0.01), 48 h的实验组saβgrp表达水平显著高于对照组(P<0.05),其他时相的对照组和实验组无统计学差异。
3 讨论
本研究结合EST序列分析和SMART RACE技术克隆获得杂色鲍的β-1,3-葡聚糖识别蛋白基因,saβGRP同其他物种的β葡聚糖识别蛋白一样, 都含有一个糖苷水解酶16超家族结构域, 同属于糖苷水解酶16超家族成员。另外, saβGRP与节肢动物及软体动物其他物种的同源氨基酸之间的多重序列比对结果(图3)显示, 除了稍微的差异外, 主要的序列基序很保守, 并未因物种不同而有很大的变化, 因而可以推测这些基序的功能保守性。葡聚糖酶催化活性所必需的4个氨基酸残基(Trp-Glu-IIe-Asp, WEID)[2-3,7,9]均存在于 saβGRP的序列中。虽然没在 saβGRP序列中发现虾类葡聚糖识别蛋白特有的细胞粘着位点RGD[3,7-9], 但发现了谷氨酸、甘氨酸、天冬氨酸 3个氨基酸残基(Glu-Gly-Asp, EGD)。此外, 识别和水解碳水化合物的活化位点, 多糖结合基序(V119-P136)和葡聚糖酶基序(W144-A155)以及识别和结合多糖所必需的β-1,3-多糖连接识别基序(F202-G220)也均存在于 saβGRP的序列中[2-3,7-9]。
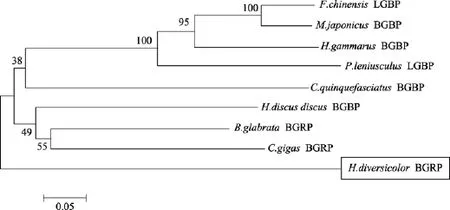
图4 杂色鲍和其他物种βGRP氨基酸序列系统发育树Fig. 4 Phylogenetic tree of the βGRP amino acid sequences of Haliotis diversicolor and other species
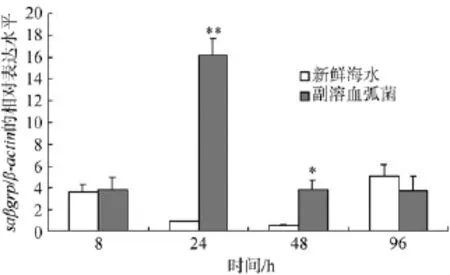
图5 副溶血弧菌感染后 saβgrp基因在肝胰脏中的表达水平Fig. 5 The expression of saβgrp in response to V. parahaemolyticus challenge (with β-actin as endogenous control).
然而, 作者推测saβGRP可能为一种新型的β葡聚糖识别蛋白,分类地位属于同一属的杂色鲍和皱纹盘鲍, 系统进化树(图 4)显示杂色鲍的β葡聚糖识别蛋白同皱纹盘鲍的该基因不属于同一支, 且与其他物种的β葡聚糖识别蛋白之间存在较远的进化距离。saβGRP与现有报道的β-1,3-葡聚糖识别蛋白N端均含信号肽不同, 其 N端不含信号肽, 是一个非分泌型蛋白。淡水螺β葡聚糖识别蛋白的N端也未含信号肽, 但相关的结构和功能分析未见报道,系统进化树显示其与saβGRP不在一个分支。在盘鲍和虾类的β葡聚糖识别蛋白氨基酸序列中均可发现的1~2个N糖基化位点[2-3,7-9], 在saβGRP的氨基酸序列中不存在。皱纹盘鲍和部分虾类的β葡聚糖识别蛋白含有脂多糖结合基序[2,7-9], 在saβGRP的氨基酸序列中也未发现。
病毒和细菌是导致杂色鲍大量死亡的主要病原,且目前分离鉴定到的细菌大多为弧菌, 因此作者选择副溶血弧菌进行杂色鲍感染应激实验。实时定量PCR结果显示, 24 h的实验组saβgrp表达水平极显著高于对照组(P<0.01), 48 h的实验组杂色鲍saβgrp表达水平显著高于对照组(P<0.05), 此结果表明saβGRP是一种急性诱导蛋白, 可快速识别入侵的副溶血弧菌, 在杂色鲍的先天性免疫系统中发挥重要的作用。类似的现象也在其他物种的β葡聚糖识别蛋白中发现, 如日本囊对虾[3]、凡纳滨对虾[7]、中国明对虾[9]LGBP和皱纹盘鲍βGRP[2]在不同细菌或细菌毒素的感染下, 其表达量均可见升高; 半定量结果也显示家蚕(Bombyx mori)[21]和白腹丛蚊(Armigeres subalbatus)[22]βGRP在不同病原菌的感染下表达升高。
总之, 作者从杂色鲍中克隆到一新型β-1,3-葡聚糖识别蛋白基因, 实时定量PCR结果表明saβGRP是一种急性诱导蛋白, 可在先天性免疫系统中发挥重要的作用, 这为研究杂色鲍抗病防御分子机制提供了参考资料, 且为防治鲍大规模暴发性死亡提供科学的依据。
[1]Medzhitov R, Janeway C A Jr. Innate immunity: the virtues of a nonclonal system of recognition[J]. Cell,1997, 91(3): 295-298.
[2]Nikapitiya C, Zoysa M D, Lee J. Molecular characterization and gene expression analysis of a pattern recognition protein from disk abalone,Haliotis discus discus[J]. Fish Shellfish Immunol, 2008, 25:638-647.
[3]Lin Y C, Vaseeharan B,Chen J C. Identification and phylogenetic analysis on lipopolysaccharide and β-1,3-glucan binding protein (LGBP) of kuruma shrimpMarsupenaeus japonicus[J]. Dev Comp Immunol, 2008,32: 1260-1269.
[4]Hauton C, Hammond J A, Smith V J. Real-time PCR quantification of the in vitro effects of crustacean immunostimulants on gene expression in lobster (Homarus gammarus) granular haemocytes[J]. Dev Comp Immunol, 2005, 29(1): 33-42.
[5]Sritunyalucksana K, Lee S Y, Söderhäll K. A beta-1,3-glucan binding protein from the black tiger shrimp,Penaeus monodon[J]. Dev Comp Immunol,2002, 26(3): 237-245.
[6]Lee S Y, Wang R, Söderhäll K. A lipopolysaccharideand beta-1,3-glucan-binding protein from hemocytes of the freshwater crayfishPacifastacus leniusculus. Purification, characterization, and cDNA cloning[J]. J Biol Chem, 2000, 275(2): 1337-1343.
[7]Cheng W, Liu C H, Tsai C H, et al. Molecular cloning and characterisation of a pattern recognition molecule,lipopolysaccharide- and beta-1,3-glucan binding protein (LGBP) from the white shrimpLitopenaeus vanname[J]. Fish Shellfish Immunol, 2005, 18(4):297-310.
[8]Roux M M, Pain A, Klimpel K R, et al. The lipopolysaccharide and beta-1,3-glucan binding protein gene is upregulated in white spot virus-infected shrimp(Penaeus stylirostris)[J]. J Virol, 2002, 76(14):7140-7149.
[9]Liu F, Li F, Dong B, et al. Molecular cloning and characterisation of a pattern recognition protein,lipopolysaccharide and beta-1,3-glucan binding protein(LGBP) from Chinese shrimpFenneropenaeus chinensis[J]. Mol Biol Rep, 2009, 36(3): 471-477.
[10]Jiang H, Ma C, Lu Z Q, et al. β-1,3-Glucan recognition protein-2 (βGRP-2) fromManduca sexta: an acute-phase protein that binds β-1,3-glucan and lipoteichoic acid to aggregate fungi and bacteria and stimulate prophenoloxidase activation[J]. Insect Biochem Mol Biol, 2004, 34: 89-100.
[11]Tamura H, Tanaka S, Oda T, et al. Purification and characterization of a (1/3)- β -D-glucan binding protein from horseshoe crab (Tachypleus tridentatus)amoebocytes[J]. Carbohydr Res, 1996, 295: 103-116.
[12]Fabrick J A, Baker J E, Kanost M R. cDNA cloning,purification, properties and function of a β-1,3-glucan recognition protein from a pyralid moth,Plodia interpunctella[J]. Insect Biochem Mol Biol, 2003, 33:579-594.
[13]Chen C, Rowley A F, Ratcliffe N A. Detection, purification by immunoaffinity chromatography and properties of β-1,3-glucan-specific lectins from the sera of several insect species[J]. Insect Biochem Mol Biol,1998, 28: 721-731.
[14]Ma C, Kanost M R. A β-1,3-glucan-recognition protein from an insect,Manduca sexta, agglutinates microorganisms and activates the phenoloxidase cascade[J]. J Biol Chem, 2000, 275: 7 505-7 514.
[15]Jayaraj S S, Thiagarajan R, Arumugam M, et al. Isolation,purification and characterization of beta-1,3-glucan binding protein from the plasma of marine musselPerna viridis[J]. Fish Shellfish Immunol,2008, 24(6): 715-725.
[16]Hoffmann J A, Hetru C. Insect defensins: inducible antibacterial peptides[J]. Immunol Today, 1992, 13:411-415.
[17]Thornqvist P O, Johansson M W, Soderhall K. Opsonic activity of cell adhesion proteins and β-1,3-glucan binding proteins from two crustaceans[J]. Dev Comp Immunol, 1994, 18: 3-12.
[18]Beschin A, Bilej M, Raymakers H J, et al. Identification and cloning of a glucan- and lipopolysaccharide-binding protein fromEisenia foetidaearthworm involved in the activation of prophenoloxidase cascade[J]. J Biol Chem, 1998, 18: 24948-24954.
[19]张朝霞, 王军, 孙永全, 等. 九孔鲍暴发性流行病的病原与病理[J]. 厦门大学学报, 2001, 40(4): 949-956.
[20]Wang S H, Wang Y L, Zhang Z X, et al. Response of innate immune factors in abaloneHaliotis diversicolor supertextato pathogenic or nonphathogenic infection[J].J Shellfish Res, 2004, 23(4): 1173-1177.
[21]Ochiai M, Ashida M. A pattern-recognition protein for beta-1,3-glucan. The binding domain and the cDNA cloning of beta-1,3-glucan recognition protein from the silkworm,Bombyx mori[J]. J Biol Chem, 2000, 275(7):4995-5002.
[22]Wang X, Rocheleau T A, Fuchs J F, et al. Beta 1,3-glucan recognition protein from the mosquito,Armigeres subalbatus, is involved in the recognition of distinct types of bacteria in innate immune responses[J].Cell Microbiol, 2006, 8(10): 1581-1590.
Molecular cloning and characterization of beta-1, 3-glucan recognition protein from small abaloneHaliotis diversicolor
WANG Bao-zhen1, ZHANG Zi-ping2, WANG Yi-lei1, WANG Guo-dong1, ZOU Zhi-hua1, WANG Shu-hong1, JIA Xi-wei1
(1. Key Laboratory of Science and Technology for Aquaculture and Food Safety of Fujian Province University,Fisheries College, Jimei University, Xiamen 361021, China; 2. Department of Chemistry and Biochemistry,Texas State University, 601 University Drive, San Marcos, TX 78666, USA)
Dec., 15, 2009
saβgrp;Vibrio parahaemolyticus;Haliotis disversicolor
The cDNA of the beta-1,3-glucan recognition protein in small abaloneHaliotis diversicolor(saβgrp)was cloned. It was originally identified from an expressed sequence tag (EST) fragment in a normalized cDNA library. Its 5’ cDNA end was obtained by 5’ rapid amplification of cDNA end (RACE) techniques and its complete sequence was confirmed by head to toe PCR. The full length cDNA ofsaβgrpwas of 1459 bp, consisting of a 5’-terminal UTR of 387 bp, an open reading frame of 987 bp, and a 3’-terminal UTR of 85 bp. The deduced protein was composed of 328 amino acids, with an estimated molecular weight of 36.9 kDa and a predicted pI of 5.90. Different from other reported GRPs that contain a signal peptide, the putative saβGRP does not contain a signal peptide and thus belongs to non-secretary proteins. Real time quantitative PCR analysis revealed that afterVibrio Parahaemolyticusinjection, the expression level ofsaβgrpin hepatopancreases at 24 h was most significantly higher than that of the control group (P<0.01), while at 48 hour post-injection, it was significantly higher than that of the control group (P<0.05).
Q751
A
1000-3096(2011)08-0067-09
2009-12-15;
2011-03-02
国家自然科学基金资助项目(20877034); 福建省自然科学基金资助项目(2009J0102); 福建省教育厅A类项目(JA08137); 集美大学创新团队基金资助项目(2010A001)
王宝珍(1984-), 女, 福建晋江人, 硕士, 主要从事水产动物功能基因和基因组学的研究, 电话: 0592-6182723, E-mail:bzwang1984@hotmail.com; 王 艺 磊 ,通 信 作 者 , E-mail: ylwang@jmu.edu.cn
谭雪静)
