海胆相关菌株抗菌活性筛选及其生物学特性
2011-01-11刘祝祥陈奇辉贺建武陈义光
黄 苛, 刘祝祥, 陈奇辉, 贺建武, 粟 银, 张 丽, 陈义光
(吉首大学 植物资源保护与利用湖南省高校重点实验室, 生物资源与环境科学学院, 湖南 吉首 416000)
海胆相关菌株抗菌活性筛选及其生物学特性
黄 苛, 刘祝祥, 陈奇辉, 贺建武, 粟 银, 张 丽, 陈义光
(吉首大学 植物资源保护与利用湖南省高校重点实验室, 生物资源与环境科学学院, 湖南 吉首 416000)
以8个菌株(3株革兰氏阳性菌、3株革兰氏阴性菌和2株真菌)作为指示菌, 采用管碟法对分离自南海硇洲岛马粪海胆(Hemicentrotus pulcherrimus)中的106株细菌(含放线菌)进行抗菌活性筛选, 并对其中抗菌活性较强的菌株进行了基于16S rRNA基因序列的系统发育分析和生物学特性研究。结果显示, 具有抗菌活性的细菌59株, 占受试菌株总数的55.7%。综合分析形态特征、生理生化特征和基于 16S rRNA基因序列的系统发育分析数据, 结果表明, 10株具有较强抗菌活性的菌株分别属于Halobacillus属(JSM 076029、JSM 076017、JSM 076062),Bacillus属(JSM 076053、JSM 076009),Pontibacillus属(JSM 076056),Planococcus属(JSM 076050),Jeotgalibacillus属(JSM 076100),Salinicoccus属(JSM 076102)和Serratia属(JSM 076077)。
海胆相关细菌; 抗菌活性; 生物学特性; 系统发育
由于海洋环境的多样性和特殊性, 其微生物无论是物种类群, 还是新陈代谢途径、生理生化类型与次生代谢产物等, 都存在着丰富的新颖性和多样性,因而蕴藏的新资源更为丰富和多样化[1-3]。海洋微生物具有产生大量新型天然活性物质的潜力, 但相应的研究开发工作尚处于初级阶段, 其代谢产物被筛选的仅约为 1%[4]。海洋中的微生物分布非常广泛,它们有的自由生活在海水中, 有的存在于一些海底沉积物或海泥的表面, 还有一部分与海洋动植物处于共生、共栖、寄生或附生的关系。越来越多的研究也表明, 海洋微生物, 尤其是那些跟海洋动物或海洋植物存在附生、共生或寄生等关系的相关微生物, 能产生一些结构独特并具强烈生理活性的代谢产物[5]。Bernan等[6]的研究结果显示, 自由海水中活性菌株筛得率为 10%, 海洋底泥为 27%, 海洋动植物相关微生物高达 48%。由此可见, 从海洋动植物相关微生物的代谢产物中分离筛选新活性物质的可能性要更高。近年来研究发现, 部分以前被认为是海洋动植物产生的重要生物活性物质, 实际上是由这些动植物的相关微生物所产生的[7-9]。海洋无脊椎动物产生的大量结构新颖的天然产物, 因具有独特的生物活性已被应用于细胞生物学研究和临床[10], 但是直接从海洋无脊椎动物来提取这些化合物存在供应量低、价格昂贵的问题。所以, 从海洋无脊椎动物中分离这些能产生化合物的微生物具有重要意义。
本实验室近年来开展了南海低等动物相关微生物资源与生态方面的系列研究, 发现南海低等动物相关微生物的多样性高, 潜藏着较多的新类群, 且具有较高比例的菌株能产生抗菌、抗癌等生物活性物质[11-12]。本文报道了对分离自南海硇洲岛海域马粪海胆(Hemicentrotus pulcherrimus)的相关细菌(含放线菌)的抗菌活性筛选及部分阳性菌株的生物学特性研究结果, 以期为海胆相关微生物资源的开发利用提供一定的理论依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂
引物由北京三博远志生物有限责任公司合成,其他试剂同文献[13]。
1.1.2 菌株来源
用于本次抗菌活性筛选用的实验菌株共 106株细菌(含放线菌), 分离自湛江硇洲岛海域的马粪海胆样品[11], 保存于吉首大学微生物资源与生态实验室。用于抗菌活性筛选的8株敏感指示菌(3株革兰氏阳性菌、3株革兰氏阴性菌和 2株真菌)由吉首大学微生物资源与生态实验室提供, 分别为: 枯草芽孢杆菌(Bacillus subtilis)、藤黄八叠球菌(Sarcina lutea)、金黄色葡萄球菌(Staphylococcus aureus)、产气杆菌(Enterobacter aerogenes)、大肠杆菌(Escherichia coli)、变形杆菌(Proteus vulgaris)、黑曲霉(Asperillus niger)和白色念珠球菌(Candida albicans)。
1.1.3 培养基
(1)斜面种子培养基: NaCl 19.45 g, MgCl25.9 g,Na2SO43.24 g, CaCl21.9 g, 蛋白胨5 g, 酵母膏1 g,复合盐A液(KCl 27.5 g, Na2CO38 g, Ferric Citrate 5 g,水1 000 mL)20 mL, 复合盐B液(SrCl34 g, KBr 80 g,H3BO322 g, Na2SiO34 g, (NH4)2SO41.6 g, Na2HPO48 g, 水1 000 mL)1 mL, 琼脂20 g, 水1 000 mL, pH 7.5;(2)液体种子培养基: 葡萄糖15 g, 甘露醇5 g, 蛋白胨10 g, 牛肉膏2 g, CaCO31 g, NaCl 20 g, 其他成分同斜面培养基, 不加琼脂; (3)发酵培养基: 葡萄糖20 g, 蛋白胨5 g, 大豆粉5 g, 酵母膏1 g, NaCl 20 g,CaCO31 g, 复合盐A液20 mL, 复合盐B液1 mL,水 1 000 mL, pH 7.5; (4)营养琼脂(nutrient agar, NA):牛肉膏5 g, 蛋白胨10 g, NaCl 5 g, 琼脂20 g, 水1 000 mL, pH 7.5。
1.2 抗菌活性初筛
刮取一支成熟的斜面菌体, 接种于装有 80 mL发酵培养基的500 mL三角瓶中, 200 r/min, 28°C培养96 h, 3个重复。发酵液4 000 r/min离心10 min, 取上清液, 用于抗菌活性测定。
1.3 抗菌活性复筛
采用复发酵法进行菌株发酵: 先培养液体摇瓶种子培养基, 250 mL三角瓶装种子培养基50 mL, 按一支斜面孢子或菌体接一瓶种子瓶的量把斜面种子接到液体种子培养基中, 28℃, 200 r/min振荡培养48 h,得到种子液; 再用此种子液按 10%接种量接入发酵培养基中, 按1.2所述方法进行发酵和发酵液制备。
1.4 抗菌活性测定
采用管碟法[14]测定发酵液抗菌活性。每管加样20 μL, 每样重复3次, 28°C培养48 h, 测抑菌圈直径。
1.5 基于 16S rRNA基因序列的系统发育分析
基因组DNA的提取、16S rRNA基因的PCR扩增、PCR产物的纯化及对纯化后的产物测序均按崔晓龙等[15]使用的方法进行(测序过程由宝生物公司完成)。扩增和测序用一对细菌通用引物: 正向引物PA(8-27f: 5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物 PB(1523-1504r: 5′-AAGGAGGTGATCCAGCCGCA-3′)。所得序列提交 GenBank注册, 获取序列号。根据测序结果, 用Blast搜索软件从GenBank、EMBL和 DDBJ等公共数据库中调出相似性较高的相关菌株的16S rRNA基因序列, 用CLUSTAL X[16]进行多序列比对, 并用MEGA 4.0(Molecular Evolutionary Genetics Analysis)软件包采用邻接法(Neighbor-Joining)进行聚类分析并构建系统进化树[17], 以重复1 000次自展(bootstrap)法检测系统进化树各分支的置信度[18]。
1.6 生物学特性
按照文献[19]的方法进行形态特征、培养特征和生理生化特征实验。
2 结果
2.1 抗菌活性筛选
2.1.1 初筛
用管碟法对分离出的 106株菌株进行了抗菌活性初筛, 统计发酵液至少对 1株指示菌有抗菌活性的菌株, 发现有59株的发酵产物具有不同程度的抗菌活性, 占受试菌株的55.7%。具体结果统计如表1。
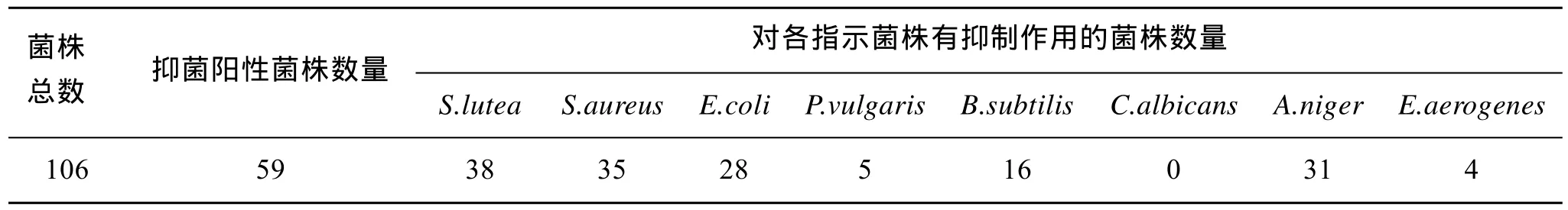
表1 海胆分离菌株抗菌活性筛选结果统计表Tab. 1 Results of antimicrobial tests of strains isolated from Hemicentrotus pulcherrimus in the South China Sea
2.1.2 复筛
对 59株抗菌活性阳性菌株进行复筛, 结果发现有 10株菌株的发酵产物抗菌活性较强、抗菌谱较广(表 2)。其中JSM 076062抗菌活性最强, 对 6株指示菌有抗菌活性; JSM 076009、JSM 076050和JSM 076100抗菌活性相对较弱; 其余6株分别对5株指示菌有抗菌活性。这 10株抗菌活性较好的菌株都能够同时抑制革兰氏阴性和阳性菌株; 除了JSM 076077和JSM 076100外, 8株对真菌也有抑制作用。

表2 海胆分离菌株抗菌活性复筛结果Tab. 2 Results of the second-round antimicrobial activity screening of strains isolated from Hemicentrotus pulcherrimus in South China Sea
2.2 抗菌活性阳性菌株的生物学特征
对10株抗菌效果较好的菌株进行了培养特征、细胞形态和生理生化特征等生物学特性的观察。结果发现, 10株菌的 NaCl耐受范围广(0~25%), 其中JSM 076102为耐盐菌, JSM 076050和JSM 076077为轻度嗜盐菌, 其他 7株为中度嗜盐菌[20]。10个菌株都为中温菌, 最适生长温度在25~32°C之间。其他生物学特征特征见表3。
2.3 基于 16S rRNA基因序列的系统发育分析
对10个抗菌活性较强、抗菌谱较广的菌株进行基因组DNA提取、16S rRNA基因PCR扩增测序后,所得序列提交GeneBank注册, 序列号见系统发育树(图1)。基于16S rRNA基因序列的系统发育分析结果表明, 这 10个菌株属于两个门(Firmicutes, Proteobacteria)中的4个科(Bacillaceae, Enterobacteriaceae,Planococcaceae, Staphylococcaceae)的7个属, 除了1株(JSM 076077)属于Proteobacteria门外, 其他9株均属于Firmicutes门。
从10株菌株的生物学特性来看, 这些菌株的生物学特性与各自的典型菌株差异不明显, 综合分析生物学特性和系统发育分析的结果, 可以初步认为,这 10株具有较强抗菌活性的菌株分别属于Halobacillus属(JSM 076029、JSM 076017、JSM 076062),Bacillus属(JSM 076053、JSM 076009),Pontibacillus属(JSM 076056),Planococcus属(JSM 076050),Jeotgalibacillus属(JSM 076100),Salinicoccus属(JSM 076102)和Serratia属(JSM 076077), 其中JSM 076056是本实验室有效发表新种Pontibacillus halophilus的典型菌株[21]。
3 讨论
根据已有的报道, 海洋抗菌活性物质产生菌株主要集中在交替单胞菌属(Alteromonassp.), 节杆菌属(Arthobacter), 芽孢杆菌属(Bacillus), 黄杆菌属(Flavobacterium), 微球菌属(Micrococcus), 莫拉菌属(Moraxella), 假单胞菌属(Pseudomonas), 海洋假互生单胞菌属(Pseudoalteromonas), 小红卵菌属(Rhodovulum), 玫瑰杆菌属(Roseobacter), 红细菌属(Ruegeria), 希瓦氏菌属(She-wanella), 葡萄球菌属(Staphylococcus), 弧菌属(Vibrio)等属的菌株[22-23]。本研究结果表明, 南海海胆相关可培养细菌中有较高比例的菌株能产生抗菌生物活性物质, 抗菌阳性率高达55.7%, 与Bernan等[6]的研究结果一致。系统发育分析结果表明这些菌株具有丰富的生物多样性,分属于 2个门 4个科的 7个属(Bacillus,Jeotgalibacillus,Halobacillus Pontibacillus,Planococcus,Salinicoccus,Serratia)。除了Bacillus外, 有关其余6个属菌株抗菌活性筛选的研究鲜见报道[22-23]。本研究及本实验室近年来的相关研究结果表明, 南海硇洲岛海域的部分无脊椎动物相关微生物具有丰富的多样性[11-12], 并蕴藏了较多的新类群(物种)[21,24-27],海胆等无脊椎动物的相关微生物中有很多菌株能产生抗菌活性物质。

表3 10株抗菌活性菌株的生物学特性Tab. 3 Phenotypic characteristics of the ten antimicrobial-activity-positive strains
海洋无脊椎动物产生的大量结构新颖的天然产物, 因其具有独特的生物活性已被应用于临床医学及细胞生物学研究[28], 但是直接从海洋无脊椎动物来提取这些化合物存在供应量低, 价格昂贵的问题。海洋中的微生物分布非常广泛, 它们有的自由生活在海水中, 有的存在于一些海底沉淀物或海泥的表面, 还有一部分与海洋动植物处于共生、共栖、寄生或附生的关系。从海洋微生物中已经发现了许多结构新颖的化合物, 其中许多化合物具有较高的抗肿瘤活性, 海洋微生物作为抗肿瘤活性物质的新来源正日益为国内外海洋研究工作者所重视。近10年来的研究表明海洋微生物提取物中至少有 10%具有细胞毒活性, 美国每年有1 500个海洋化合物单体被分离出来, 其中 1%具抗肿瘤作用[29-31], 日本科学者研究发现, 27%的海洋微生物具有抗菌活性[32]。如盐藻等可产生胡萝卜素, 不仅具有药用功能, 而且还是一种脂溶性的、良好的食用色素, 可以应用于食品加工工业[33]; Beja等[34]用现代分子生物学技术在海洋细菌中发现了细菌视紫红质。从海洋微生物中发现的生物活性物质包括胺及酰胺类、乙酰配基类、吲哚生物碱类、环肽类及聚丙酸酯类等, 其生物活性包括抗菌、抗微生物、抗肿瘤、抗病毒、抗辐射、酶及酶的抑制剂等等。越来越多的研究也表明, 海洋微生物, 尤其是那些跟海洋动物或海洋植物存在共生或寄生等关系的微生物, 能产生结构独特并具强烈生理活性的代谢产物[35], 姜健等[36]和张连茹等[37]分别从海胆及海胆卵中分离得到抗菌, 抗肿瘤, 抗氧化和产唾液酸的微生物。总之, 从海洋微生物中分离出的这些活性物质在医药、化妆品、保健食品、着色剂、食品添加剂, 科学研究和工业发展等方面具有广阔的应用前景, 为推动整个人类社会的发展提供了丰富的资源[38-41]。

图1 根据16S rRNA基因序列构建的10株具有抗菌活性菌株的系统发育树Fig. 1 Neighbor-Joining tree constructed based on 16S rRNA gene sequence analysis showing the phylogenetic relationships among ten antimicrobial-activity-positive strains and their closely related taxa. Numbers at nodes indicate bootstrap values (>50%) based on a neighbor-joining analysis of 1000 resampled datasets. Bar, 2 substitutions per 100 nucleotides
[1]张秀明, 张晓华. 海洋微生物培养新技术的研究进展[J]. 海洋科学, 2009, 33(6): 99-104.
[2]Jensen P R, Williams P G, Zeigler L, et al. Species-specific secondary metabolite production in marine actinomycetes of the genusSalinispora[J]. Appl Environ Microbiol, 2007, 73: 1146-1152.
[3]Donia M, Humann M T. Marine natural products and their potential applications as anantiinfective agents[J].Lancet Infect, 2003, 3: 338-348.
[4]Knight V, Sanglicr J J, Dituillio D, et al. Diversifying microbial natural products for dug discovery[J]. Appl Microbiol Biotechnol, 2003, 62: 446-458.
[5]Faulkner D J. Marine nature products[J]. Natural Product Reports, 2001, 18: 1-49.
[6]李盛英, 郑忠辉. 国外海洋抗肿瘤活性物质的研究与开发[J]. 海洋通报, 2003, 22(2): 78-80.
[7]Patrick J W. Oceans and human health: risks and remedies from the seas[M]. Academic Press, 2008: 431-455.
[8]刘全永, 胡江春, 薛德林, 等. 渤海水母体细菌的微生态分布及弧菌生物学特性[J]. 应用生态学报, 2001,12(6): 901-905.
[9]岳家兴. 海洋微生物与抗肿瘤活性物质[J]. 生命科学仪器, 2006, 4(10): 19-25.
[10]Newman D J, Cragg G M. Marine products and related compounds in clinical and advance preclinical trails[J].J Nat Prod, 2004, 67: 1216-1238.
[11]黄苛, 张丽, 刘祝祥, 等. 硇洲岛海胆可培养细菌的多样性[J]. 微生物学报, 2009, 49(11): 1424-1429.
[12]肖怀东, 陈义光, 刘祝祥, 等. 湛江硇洲岛海葵相关可培养细菌系统发育多样性研究[J]. 微生物学报,2009, 49(2): 246-250.
[13]陈义光, 李文均, 崔晓龙, 等. 具抗肿瘤活性放线菌菌株YIM90022的分离和系统发育分析[J]. 微生物学报, 2006, 46(5): 696-701.
[14]胡昌勤, 刘炜. 抗生素微生物检定法及其标准操作[M]. 北京: 气象出版社, 2004: 2.
[15]Cui X L, Mao P H, Zeng M, et al.Streptimonospora salinagen.nov., sp.nov., a new member of the familyNocardiopsaceae[J]. Int J Syst Evol Microbiol, 2001,51: 357-363.
[16]Thompson J D, Gibson T J, Plewniak F. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research, 1997, 24(4): 476-488.
[17]Tamura K, Dudley J, Nei M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Mol Biol Evol, 2007, 24, 1596-1598.
[18]Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap[J]. Evolution, 1985, 39:783-791.
[19]东秀珠, 蔡妙英. 常见细菌鉴定手册[M]. 北京: 科学出版社, 2001: 43-65.
[20]任培根, 周培瑾. 中度嗜盐菌的研究进展[J]. 微生物学报, 2003, 43(3): 42-43.
[21]Chen Y G, Zhang Y Q, Xiao H D, et al.Pontibacillus halophilussp. nov., a moderately halophilic bacterium isolated from a sea urchin[J]. Int J Syst Evol Microbiol,2009; 59: 1635-1639.
[22]Hentschel U, Schmid M, Wagner M, et al. Isolation and phylogenetic analysis of bacteria with antimicrobial activities from the Mediterranean spongesAplysina aerophobaandAplysina cavernicola[J]. FEMS Microbiol Ecology, 2001, 35: 305-312.
[23]Dobretsov S, Dahms H U, Qian P Y. Antibacterial and anti-diatom activity of Hong Kong sponges[J]. Aquat Microb Ecol, 2005, 38: 191-201.
[24]Chen Y G, Wang Y X, Zhang Y Q, et al.Nocardiopsis litoralissp.nov.,a halophilic marine actinomycete isolated from a sea anemone[J]. Int J Syst Evol Microbiol, 2009, 59: 2708-2713.
[25]Chen Y G, Zhang Y Q, Xiao H D, et al.Pontibacillus halophilussp. nov., a moderately halophilic bacterium isolated from a sea urchin[J]. Int J Syst Evol Microbiol,2009, 59: 1635-1639.
[26]Chen Y G, Zhang Y Q , Shi J X, et al.Jeotgalicoccus marinussp. nov., a marine bacterium isolated from a sea urchin[J]. Int J Syst Evol Microbiol, 2009, 59:1625-1629.
[27]Chen Y G, Zhang Y Q, Huang H Y, et al.Halomonas zhanjiangensissp. nov., a halophilic bacterium isolated from a sea urchin[J]. Int J Syst Evol Microbiol, 2009,59: 2888-2893.
[28]Newman D J, Cragg G M. Marine natural products and related compounds in clinical and advanced preclinical trials[J]. Journal of Natural Products, 2004, 67:1216-1238.
[29]王正平, 张庆林, 胡艳红. 海洋微生物抗肿瘤活性物质的研究进展[J]. 化学工程师, 2004, 4: 41-42.
[30]杨瑞丽, 袁献温, 郑杰, 等.一株海洋放线菌发酵液抗肿瘤活性初探[J]. 台湾海峡, 2007, 26(3): 351-355.
[31]陈钢, 朱卫. 海洋微生物抗肿瘤活性物质研究进展[J]. 浙江海洋学院学报(自然科学版), 2008, 27(3):321-326.
[32]刘雪莉, 钱伯初. 日本海洋天然活性物质研究简况[J]. 中国海洋药物, 1997, 16(1): 45-49.
[33]刘发义, 李烈英. 超临界流体萃取技术在海洋生物活性物质提取中的应用[J]. 海洋科学, 1996, 4: 41-44.
[34]Béja O, Aravind L, Koonin E V,et al. Bacterial rhodopsin: evidence for a new type of phototrophy in the sea[J]. Science, 2000, 289(5486): 1902.
[35]Faulkner D J. Marine natural products[J]. Natural Product Reports, 1998, 15(2): 113-158.
[36]姜健, 范圣第, 杨宝灵, 等.海洋动植物共附生微生物的分离和抗菌活性研究[J]. 微生物学通报, 2005,32(2): 65-68.
[37]张连茹, 杨梅, 于淼, 等.海胆卵内生菌分离及其生物活性的初步探讨[J]. 厦门大学学报(自然科学版),2008, 47(5): 728-732.
[38]Mincer T J, Jensen P R, Kauffman C A,et al.Widespread and persistent populations of a major new marine actinomycete taxon in ocean sediments[J]. Applied and Environmental Microbiology, 2002, 68(10):5005.
[39]Dobretsov S, Qian P Y. The role of epibotic bacteria from the surface of the soft coralDendronephthyasp.in the inhibition of larval settlement[J]. Journal of Experimental Marine Biology and Ecology, 2004, 299(1):35-50.
[40]Chelossi E, Milanese M, Milano A, et al.Characterisation and antimicrobial activity of epibiotic bacteria from Petrosia ficiformis (Porifera, Demospongiae)[J].Journal of Experimental Marine Biology and Ecology,2004, 309(1): 21-33.
[41]Fernandez-Chimeno R I, Canedo L, Espliego F, et al.IB-96212, a novel cytotoxic macrolide produced by a marineMicromonospora. I. Taxonomy, fermentation,isolation and biological activities[J]. J Antibiot (Tokyo),2000, 53(5): 474-478.
Screening and biological characteristics of antibiotic- producing bacteria from sea urchins
HUANG Ke, LIU Zhu-xiang, CHEN Qi-hui, HE Jian-wu, SU Yin, ZHANG Li, CHEN Yi-guang
(Key Laboratory of Plant Resources Conservation and Utilization of Hunan Province, College of Biology and Environment Science, Jishou University, Jishou 416000, China)
Oct., 12, 2010
Associated bacteria with sea urchin; antimicrobial activity; biological characteristics; phylogenetic analysis
The antimicrobial activity of 106 marine bacteria, isolated from sea urchins (Hemicentrotus pulcherrimus) collected from the coastal area of the Naozhou island in the South China Sea, were screened using the cylinder-plate method on 8 indicator microorganisms, i.e. three Gram-positive bacteria (Bacillus subtilis,Sarcina lutea,Staphylococcus aureus), three Gram-negative bacteria (Aerobacter aerogenes,Escherichia coli,Proteus vulgaris), and two fungi (Asperillus niger,Candida albican). Out of 106 test strains, 59 were positive in antimicrobial activity (55.7%), in which 10 strains exhibited strong antimicrobial activity. These 10 strains were submitted for 16S rRNA gene amplification and phylogenetic analysis after morphological, biochemical,and physiological characterization. It was found that the 10 strains were within the phyla Firmicutes and Proteobacteria, belong to the generaHalobacillus(JSM 076029, JSM 076017, JSM 076062),Bacillus(JSM 076053, JSM 076009),Pontibacillus(JSM 076056),Planococcus(JSM 076050),Jeotgalibacillus(JSM 076100),Salinicoccus(JSM 076102), andSerratia(JSM 076077).
Q939
A
1000-3096(2011)08-0025-07
2010-10-12;
2011-01-23
国家自然科学基金项目(30970007)
黄 苛(1983-), 男(瑶族), 湖南溆浦人, 硕士, 研究方向为微生物资源与生态, E-mail: hkll520@163.com; 陈义光, 通信作者,电话: 0743-8564416, E-mail: mchenjsu@yahoo.com.cn
梁德海)
