菌株B10对食用菌木霉病的拮抗作用及菌株鉴定
2011-01-11孙立梅张海涛
郝 捷,李 莉,陈 飞,李 杨,孙立梅,王 鹤,侯 静,张海涛
(1.沈阳农业大学,辽宁沈阳 110866;2.辽宁省微生物科学研究院,辽宁朝阳 122000)
食用菌生产过程中,大多使用木质素、纤维素含量较高的原料,木霉是发生最为普遍和危害严重的真菌病害之一[1-2],其对食用菌的侵染能力非常强[3]。由于大规模传统生产多数使用常温常压灭菌,以及运输过程中菌袋被扎破等原因,使得食用菌发菌过程中容易受到木霉的侵染。在辽宁省朝阳市召都巴乡和鞍山市岫岩县香菇发菌期间,出现的染菌袋中被木霉侵染的超过半数,发菌期间不方便开袋使用化学药剂进行杀灭,地栽期间出现的木霉虽然可以使用多菌灵等化学药剂,但是木霉对其依然具有较强的抗性,农药残留对食用菌的品质也会有很大影响[4-5]。芽胞杆菌在动植物生产种植的应用已经非常普遍[6-7],而在食用菌栽培生产中应用研究较少,生物防治在食用菌产业中的应用更显突出。本试验将以实际生产中发现的新菌株对致病菌木霉的生物防治展开研究。
1 材料与方法
1.1 材料
1.1.1 菌株 在食用菌实际生产中发现1株对栽培袋中的致病菌木霉具较强抑菌作用的菌株,经挑取纯化后命名为B10。木霉(Trichoder m a spp.)T101、T102、T104,本课题组从食用菌染菌的菌袋中分离;木霉29、74(保藏中心编号3.3029,3.2774),辽宁省微生物菌种保藏中心提供。
1.1.2 仪器 高速冷冻离心机(Sigma 3K15型);T6-新锐可见分光光度计(北京普析通用有限公司);外径8 mm牛津杯;细菌微量生化反应管(杭州天和微生物试剂有限公司)。
1.2 方法
1.2.1 B10菌体与木霉的抑制作用 B10在NA培养基上32℃活化24 h,挑取1环于10 mL无菌水中,稀释至10-3,吸取1 mL于PDA平板中,涂布均匀,32℃培养至长出菌落,用8 mm打孔器打孔制成菌碟准备待用。分别挑取木霉29、74、T101、T102、T104各1环于10 mL无菌水中,稀释至10-3,吸取1 mL于PDA平板中,涂布均匀,26℃培养48 h,用8 mm打孔器打孔制成菌碟准备待用。将打孔好的B10菌碟,分别与5种木霉接种PDA平板中,菌碟相距3 cm,3次重复,放入恒温培养箱中26℃培养72 h后测量抑菌圈大小和拮抗带宽。拮抗带宽按照下式计算:
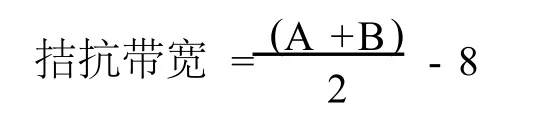
式中,A为抑菌圈的最大直径(mm),B为抑菌圈的最小直径(mm),8为牛津杯的外径(mm)。1.2.2 B10发酵液对木霉的拮抗作用[8-9]B10发酵液的制备:将B10接种于LB液体培养基中,32℃,170 r/min振荡培养24 h作为种子液,按5%接种量转接于装有100 mL LB液体培养基的250 mL三角瓶中,32℃,170 r/min振荡培养,设置12、24、36、48、60、72 h 6个培养时间段,然后8 000 r/min,4℃离心10 min,取上清液用0.45μm细菌滤器过滤,得到发酵上清液,存于冰箱,4℃保存备用。发酵液拮抗实验用牛津杯法,将木霉29、74打孔后的菌碟分别接入培养皿距离中心1.5 cm左右位置,培养36 h,待木霉从菌碟上扩散至PDA培养基上,并接近中心位置时,将牛津杯微热放在培养皿中,距离中心位置1.5 cm左右,与木霉菌碟平行,向牛津杯加入200μL发酵上清液,培养24 h后,再向牛津杯中加入200μL发酵上清液,以不接菌的LB培养基为对照,培养至木霉长满培养皿,测发酵上清液抑菌圈大小。
1.2.3 发酵上清液中蛋白质含量测定 参照文献[10],以牛血清蛋白为标准蛋白测蛋白质含量。
1.2.4 B10的鉴定 B10生理生化实验参照《伯杰氏细菌鉴定手册》[11]、《常见细菌系统鉴定手册》[12]使用细菌微量生化反应管测定。16S rDNA序列扩增与测序,DNA提取参照《分子生物学实验指南》[13]中基因组制备的方法,以引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)20 bp和1492r(5′-GGTTACCTTGTTACGACTT-3′)19 bp进行PCR扩增,PCR反应条件:预变性98℃5 min;循环95℃35 s,55℃35 s,72℃1 min 30 s,35个循环,延伸8 min。经切胶纯化的PCR产物交由生物工程(上海)有限公司完成测序。
2 结果与分析
2.1 B10对木霉抑制作用
如图1所示,B10对木霉29、74、T101、T102、T104均有不同程度的抑制,拮抗线非常明显,抑菌圈清晰。因T101与29,T102、T104与74菌落形态一致,故后续实验仅选用木霉29和木霉74。经测定,对木霉29、74的抑菌圈分别达到32.3、29.8 mm,拮抗带宽分别是24.3、21.8 mm,拮抗效果明显。
2.2 B10发酵液对木霉的拮抗作用
经过6个时间段的培养,通过细菌滤器获得的发酵上清液对木霉29、74做拮抗实验,以不接菌的LB培养基为对照组(CK),每个处理设3个重复。实验结果观察,抑菌圈呈椭圆形,水平方向为最大直径,竖直方向为最小直径,取平均值,结果见表1。在6个时间段中,CK与12 h对木霉均没有呈现明显的拮抗圈,拮抗现象不明显,木霉可以紧贴牛津杯外缘生长。36 h的发酵上清液对木霉29、74的拮抗效果最佳,拮抗带宽最长,分别达到16.85、14.23 mm,且最大直径与最小直径相差不大,效果最为明显,见图2。
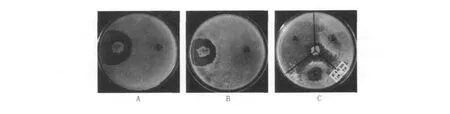
图1 B10对木霉的菌体拮抗Fig.1 Antagonism of bacterium B10 on theTrichoder ma
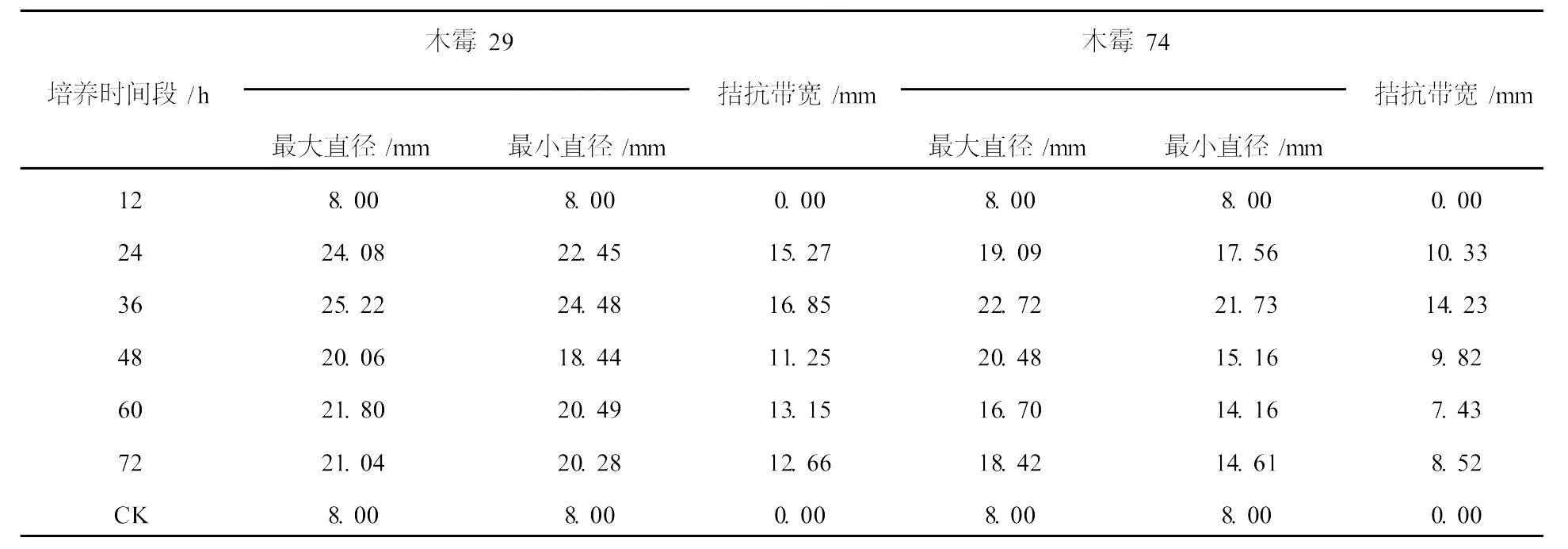
表1 发酵上清液对木霉29、74的拮抗抑菌圈大小测定Table 1 Measurement of the size of inhibition zone ofTrichoder ma29 and 74 by the antagonism of abacterial fer mentation liquid
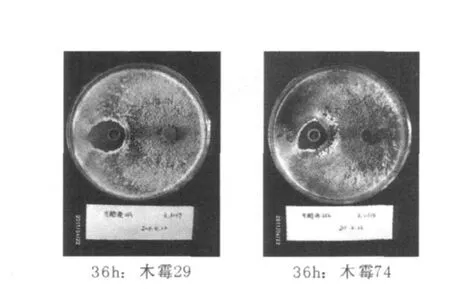
图2 36 h发酵上清液对木霉的拮抗Fig.2 Antagonism of abacterial fer mentation liquid onTrichoder mafor 36 h
2.3 发酵上清液中蛋白质含量
测得牛血清白蛋白的光密度OD595nm见表2,绘制牛血清白蛋白标准曲线见图3。通过蛋白质标准曲线,得到6个时间段发酵上清液的蛋白质含量,分别为0.158、0.307、0.441、0.573、0.466、0.549 mg/mL,如图4所示,48 h发酵上清液蛋白质含量最高,但36 h对木霉的拮抗效果最佳。

表2 蛋白质标准曲线Table 2 Protein standard curve
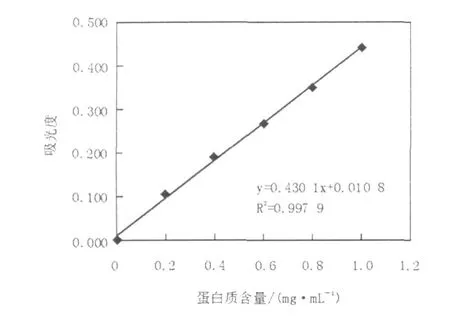
图3 蛋白质标准曲线Fig.3 Protein standard curve

图4 发酵上清液蛋白质含量Fig.4 The protein content in abacterial fermentation liquid
2.4 B10鉴定

图5 B10革兰染色显微照片(1 000×)Fig.5 Micrograph of Gram stain of bacterium B10(1 000×)
菌株形态观察:菌落圆形,边缘粗糙,表面隆起、褶皱,乳黄色,菌落不透明,好氧,化能异养,1 000倍光学显微镜下观察,菌体呈杆状,革兰染色阳性,如图5。细菌快速生化反应试验对B10菌的鉴定结果见表3,并参考文献[14-15],可判断B10菌为枯草芽胞杆菌(B acillus subtilis)或死谷芽胞杆菌(B acillus vallism ortis)。

表3 B10菌的主要生理学特性Table 3 Physiological characteristics of strain B10
菌株分子鉴定:16S rDNA序列测定片段长度为1 420bp,序列提交GenBank,登录号:JN112317,比对结果显示该菌株序列与芽胞杆菌属同源性最高,相似性大于99%,利用MEGA5的Maximum Likelihood进行系统发育树的构建,如图6。与B acillus vallism ortisstrain EA6-11遗传距离最近,置信度为90,结合生理生化实验和16S rDNA分子鉴定,确定为死谷芽胞杆菌(Bacillus vallism ortis)。
3 讨 论
本试验所用的菌株,其菌体对食用菌栽培袋中的致病菌木霉拮抗效果比较明显,进一步研究发现发酵上清液具有较强拮抗作用,发酵液经过离心、过滤等操作步骤,使得有效成分有所损失,需要加大剂量分2次加至400μL才能观察到明显的抑菌圈。发酵上清液具有拮抗作用与存在胞外分泌物有关,通过蛋白质含量测定,72 h与48 h蛋白质含量相当,但拮抗效果不如36 h明显,说明36 h的有效成分较多。所以在后续研究中,使用36 h发酵液即可。
经过生理生化实验和16S rDNA分子鉴定,确定该菌株为死谷芽胞杆菌,它是一类较新的种。芽胞杆菌是较复杂的一个类群,除了较早定的Bacillus subtilis、B.am yloliquefaciens、B.licheniform is、B.pum ilus、B.atrophaeus等5个种外,陆续分化出B.vallism ortis、B.m ojavensis、B.tequilensis等新种[16]。死谷芽胞杆菌(B.vallism ortis)作为一新种,在应用中还较少利用,本试验对木霉的拮抗效果非常明显,将该菌制成菌剂在食用菌栽培过程中的应用,还需深入研究。
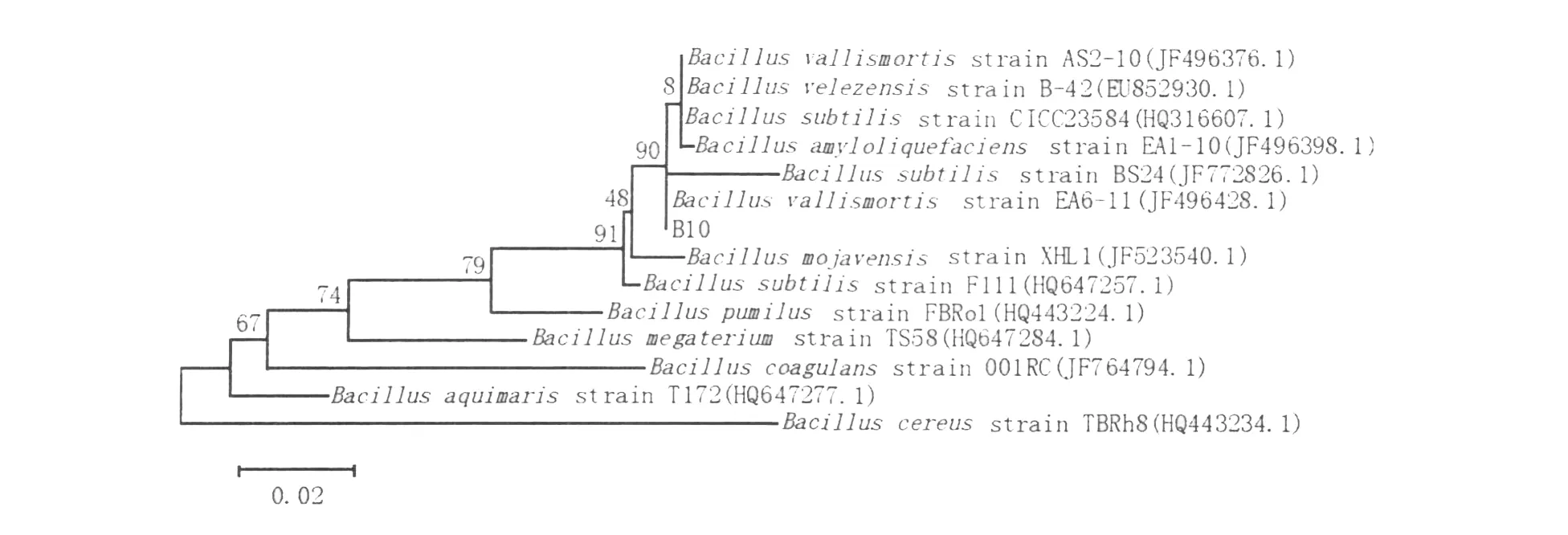
图6 以16S rDNA序列同源性为基础的系统发育树Fig.6 Phylogenetic tree based on sequence homology of 16S rDNA
[1] 吴小平,吴晓金,谢宝贵,等.木霉对食用菌侵染机制的初步研究[J].菌物学报,2007,36(增):441-447.
[2] 孟庆国,王志,邓春海,等.食用菌病虫害综合防治技术要点[J].微生物学杂志,2002,22(2):60-61.
[3] ParkM S,Bae K S,Yu S H.Molecular andMorphologicalA-nalysis ofTrichoder maisolates associated with GreenMold Epidemic ofOyster mushroom in Korea[J].Journal of Huazhong Agricultural university,2004,23(1):157-164.
[4] 田连生,陈菲.木霉对多菌灵的生物降解特性研究[J].土壤学报,2009,46(6):1127-1131.
[5] 曾东方,罗信昌.强力安对食用菌生产中杂菌的毒力测定[J].微生物学杂志,1998,18(3):37-39.
[6] 蔡雁,郝勃,喻子牛.抗动物病原菌芽胞杆菌的筛选、初步鉴定和抗菌活性[J].微生物学杂志,2005,25(5):19-22.
[7] 赵阳国,任南琪,程玉鹏.1株芽胞杆菌的分类鉴定及其抑菌产物特性[J].微生物学杂志,2006,26(6):1-6.
[8] 王刚,张彭湃,陈红卫,等.枯草芽胞杆菌B-(1-41)对小麦纹枯病菌的抑制作用[J].微生物学杂志,2006,26(4):20-22.
[9] 刘莹,杨翔华,佟明友,等.拮抗菌株的筛选及其发酵滤液抑菌活性考察[J].微生物学杂志,2006,26(3):77-80.
[10] MarionM B.AnalyticalBiochemistry,1976,72,248-254.
[11] RE布坎南,NE吉本斯,等.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984.
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13] Sambrook J,RussellDW.Molecule Cloning:A LaboratoryManua1 3rded[M].Beijing,China(北京):Science Press,2002.
[14] Roberts,M.S.,Nakamura,L.K.,Cohan,F.M.,Bacillus vallismortissp.nov.,a close relative ofBacillus subtilis,isolated from soil in Death Valley[J].Int.J.Syst.Evol.Microbiol.,1996,46(2):470-475.
[15] 张慧,杨兴明,冉炜,等.土传棉花黄萎病拮抗菌的筛选及其生物效应[J].土壤学报,2008,45(6):1096-1101.
[16] 曹凤明,沈德龙,李俊,等.应用多重PCR鉴定微生物肥料常用芽胞杆菌[J].微生物学报,2008,48(5):651-656.
