1株高产多糖红曲霉菌株的分离鉴定及生物学特性研究
2011-01-11汪鹏荣刘伟芬陈文静蒋冬花蓝丽精
汪鹏荣,刘伟芬,陈文静,蒋冬花,蓝丽精
(浙江师范大学化学与生命科学学院,浙江金华321004)
多糖是一类由醛糖或酮糖通过糖苷键连接而成的天然高分子多聚物,常是细胞表面信号识别、抗原抗体反应、细胞间信息传递和感受的关键因子[1],具有免疫调节、抗肿瘤、抗氧化、抗病毒等药理作用[2]。自1970年日本千原羽田从香菇中分离出一种抗肿瘤的多糖后,科学界掀起了食用真菌多糖研究的热潮。目前,已在国内临床应用的真菌多糖主要有香菇多糖、云芝多糖、云芝糖肽、灵芝肽多糖、猴头菌多糖、银耳多糖等[3]。红曲霉(Monascus spp.)是一类十分重要的药用真菌,系中药红曲的基原菌[4],是一类小型丝状腐生真菌,属子囊菌亚门(Ascomycotina)不整囊菌纲(Plectomycetes)散囊菌目(Eurotiales)红曲科(Monascaceae),目前国内外对其功能性成分莫纳卡林K(Monacolin K)、γ-氨基丁酸(γ-Aminobutyric Acid,GABA)和红曲色素进行了广泛而深入的研究,但对红曲多糖的研究却不多。本研究根据红曲霉菌株的生长特性及赵振锋等[5]有关红曲菌胞外多糖的测定方法,对市售红曲米、红腐乳中的红曲霉菌株进行分离纯化,从中得到56株红曲霉菌株,然后通过摇瓶发酵培养测定胞外多糖含量,最终筛选出1株高产胞外多糖的红曲霉菌株并对其进行分类鉴定,为进一步发掘红曲霉菌株生物资源做有益探索。
1 材料与方法
1.1 材料
1.1.1 菌种来源以市售红腐乳及采自浙江金华地区的红曲米为材料分离纯化红曲霉菌株。
1.1.2 培养基PDA培养基:马铃薯200 g,葡萄糖20 g,水1 000 mL,pH自然(固体培养基加琼脂粉18 g);査氏培养基(Cza)[6]:葡萄糖30 g,NaNO33 g,酵母提取物1 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂粉20 g,水1 000 mL,pH 6,121℃灭菌30 min;发酵培养基[7]:蔗糖40 g/L,酵母粉4.5 g/L,KH2PO4·3H2O 3.5 g/L,MgSO40.4 g/L,发酵液起始pH 5.0;CYA培养基[8]:蔗糖30 g,NaNO33 g,酵母提取物5 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.05 g,FeSO4·7H2O 0.01 g,琼脂18 g,水1 000 mL,pH 6.0;MEA培养基[8]:麦芽浸出粉20 g,蛋白胨1 g,葡萄糖2 g,琼脂15 g,补水至1 000mL,pH 6.0。
1.2 方法
1.2.1 红曲霉菌株的分离用接种针挑取小块红腐乳外皮(或研磨成粉状的红曲米),在PDA培养基上进行连续多次划线分离,直到产生早期为白色、后期为红色或紫色的单菌落,再用PDA固体培养基纯化培养,将所获菌株编号,置4℃冰箱中保存,备用。
1.2.2 菌种活化传代和发酵种子的培养[6]用PDA固体斜面培养基进行菌种活化传代,菌株每4周转接1次;30℃培养5 d,再转接到PDA固体平板上,30℃活化培养72 h后用作发酵种子。
1.2.3 液体发酵培养和产多糖菌株的初筛取活化培养72 h的红曲霉菌饼接入PDA液体培养基中,30℃摇床培养36 h作为种子液,然后将种子液接种到液体发酵培养基中,接种量为8%,250 mL三角瓶装100 mL培养液,180 r/min 30℃培养96 h,最后取发酵液分析检测粗多糖的产量,进行菌株筛选。
1.2.4 发酵液中多糖含量的测定[5]发酵滤液定容至100 mL,取发酵液15 mL加入60 mL无水乙醇中,5℃下静置8 h过滤,沉淀在80℃烘干12 h至恒重,称量即为胞外粗多糖含量。
1.2.5 红曲霉菌株的鉴定①形态学观察:将筛选出的高产菌株分别接种到MEA和CYA培养基中,在25℃培养7、14和25 d,观察记录菌落特征,根据李钟庆等[8]红曲菌分种检索表及参考郭红珍等[9]的描述对高产多糖菌株进行形态学鉴定;②生理生化特征测定:碳源利用实验:不含糖的查氏培养基中分别加4%的果糖、麦芽糖、葡萄糖、蔗糖、乳糖、番薯粉、可溶性淀粉、甘油,配制好培养基后灭菌接种,30℃培养箱中培养5 d后观察结果;氮源利用试验:不含NaNO3的查氏培养基中分别加入0.3%的硫酸铵、硝酸钠、氯化铵、蛋白胨、牛肉膏、酵母粉、亚硝酸钠,配制好培养基后灭菌接种,30℃培养箱中培养5 d后观察结果;明胶水解试验:用含有0.5%蛋白胨、15%明胶的培养基,调pH值为7.0,分装于试管,灭菌。挑取孢子用穿刺法接种于试管中央,另取2支不接种作空白对照(因明胶培养基在20℃以上融化,故观察时先将培养管在4℃冰箱中冷却,待对照管已完全凝固后,再记录结果),30℃培养箱中培养7、14 d。在20℃观察菌的生长情况和明胶是否液化,如明胶凝块部分或全部变为可流通的液体,则明胶水解阳性;如果菌已生长,明胶未液化,但明胶表面菌落下出现凹陷小窝也是轻度水解,也可视为阳性;③rDNA ITS序列分析:采用改良的CTAB法提取基因组DNA。用真菌通用引物对(ITS1/ITS4)对红曲霉进行rDNA ITS的PCR扩增和测序。引物F:5'-ATT ACG CCA GCA TCC TTGC-3';引物R:5'-TTT ACA ACT CCC AAA CCCC-3'。PCR反应条件:95℃预变性5 min,94℃变性40 s,56℃退火1 min,72℃延伸1.5 min,35个循环,72℃延伸7 min,4℃保存备用。以DL Marker 2 000为分子量标准,扩增产物经1%琼脂糖凝胶电泳,在凝胶成像系统仪上观察并记录结果。将扩增的PCR产物送上海生工进行测序,将获得的ITS序列在GenBank的核酸序列库中进行同源性序列分析,与数据库中已知红曲霉菌rDNA ITS序列进行比较,确定红曲霉的分类地位。
2 结果与分析
2.1 红曲霉的分离纯化
通过分离、纯化和初步鉴定,共获得56株红曲霉菌株。
2.2 高产多糖红曲霉菌株的筛选
将筛选出的56株红曲霉菌株接入PDA液体培养基中摇瓶培养36 h,然后接种到液体发酵培养基中,30℃摇瓶发酵培养96 h后,发酵液用乙醇沉淀法测胞外多糖含量。测定结果表明:不同红曲霉菌株产生多糖的能力存在显著差异,部分红曲霉菌株发酵液中多糖的产量见表1,其中多糖产量较高的菌株有M-5、M-6、M-10等,又以M-6菌株的产量最高达4.73 g/L。以M-6红曲霉菌株为研究对象进行菌种鉴定和生物学特征研究。
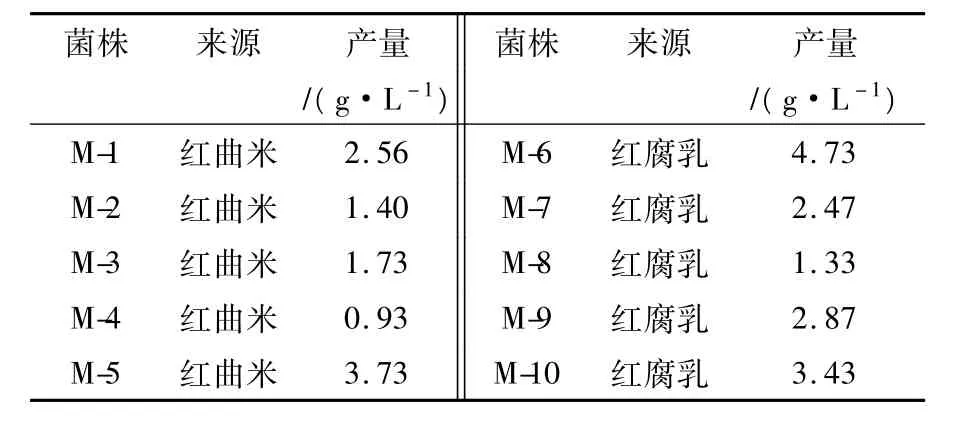
表1 10株红曲霉菌株发酵液中多糖的产量Table 1 The polysaccharide production of ten monascus strains
2.3 高产多糖红曲霉M-6菌株的鉴定
2.3.1 形态特征①菌落特征:在CYA上,25℃培养后7 d,菌落直径22 mm,表面质地丛转毛状,边缘流苏状,菌落中心的颜色由初期的白色慢慢向粉红色转变,但是菌落四周由于菌丝在继续生长颜色仍是白色,同时可以看出从第7天起该菌株已经开始向培养基分泌色素物质(图1A);在MEA上,25℃培养后7 d,菌落直径32 mm,平坦而稀疏,中间微微隆起,边缘完整,外形呈圆形皮膜状,菌丝体边缘呈白色,中间渐呈粉红色(图1B);②显微特征:菌丝直径2~7 μm,具横隔,分枝状,含有色素颗粒(图1C);闭囊壳呈椭球形,单生在类似柄的菌丝上,直径30~50 μm,里面充满密集排列的孢子,子囊孢子卵形或者球形(图1D);分生孢子有时着生在侧梗上,但是往往着生在菌丝顶端,形状为犁形,具有平截基部,成熟时为圆形(图1E)。
2.3.2 生理生化特征①碳源利用:由表2可知,高产菌株M-6能较好地利用除甘油外的6种碳源,其中麦芽糖为其最适生长碳源,而在甘油培养基中几乎不生长;②氮源利用:由表2可知,高产多糖菌株M-6均能利用表中所列的5种氮源,但在有机氮源中较无机氮源中生长的好,而且在以酵母粉为氮源的培养基中生长最好;③明胶水解:高产多糖菌株M-6不能水解明胶,而据邢旺兴[10]报道,紫色红曲霉能够水解明胶,因此可推断菌株M-6属于红曲霉中其他种属。
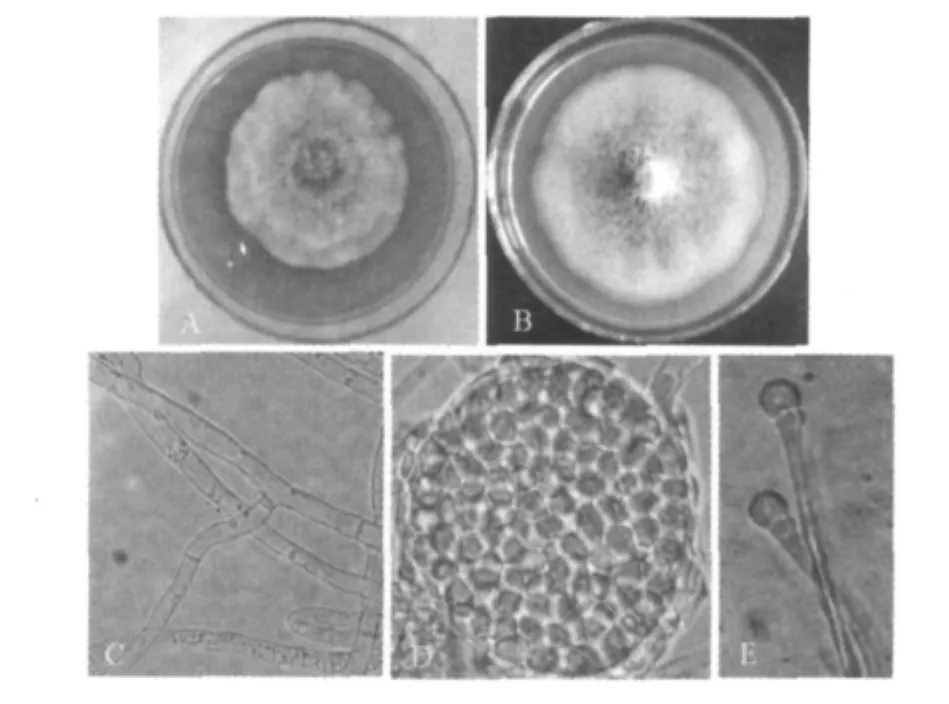
图1 菌株M-6的菌落特征和显微特征图Fig.1 Morphological and Colony characteristics of the strain M-6
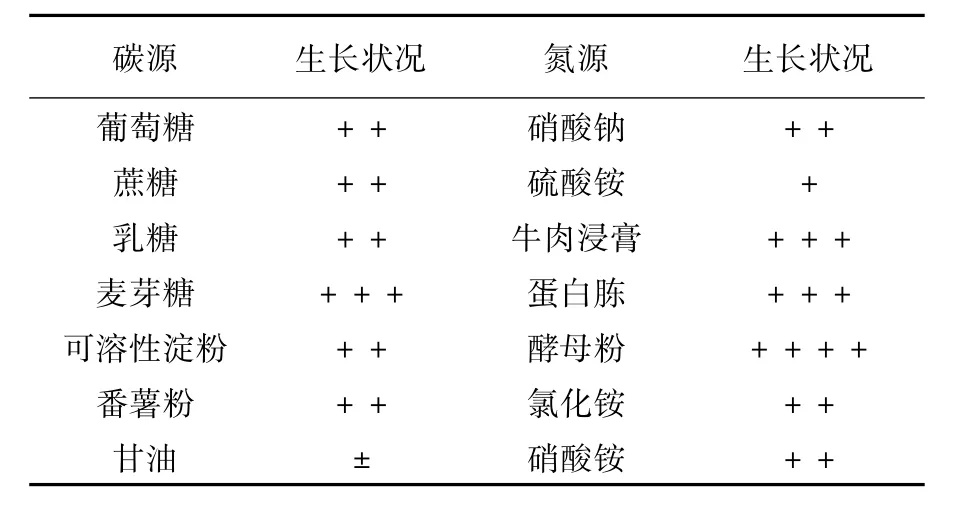
表2 菌株M-6的碳源、氮源利用结果Table 2 Results of carbon source and nitrogen source utilization of the strain M-6
2.3.3 rDNA ITS序列与分析用真菌通用引物ITS1/ITS4以菌株M-6基因组为模板进行PCR扩增,得到长度为544 bp的片段(图2)。将菌株M-6的ITS PCR扩增产物进行测序,将该菌株的序列与GenBank中其他红曲霉进行比对和同源性分析。结果表明,该菌株与红色红曲霉(Monascus rubber)、紫色红曲霉(Monascus purpureus)、丛毛红曲霉(Monascus pilosus)、烟灰色红曲霉(Monascus fumeus)的同源性都高达99%(部分比对结果见表3)。
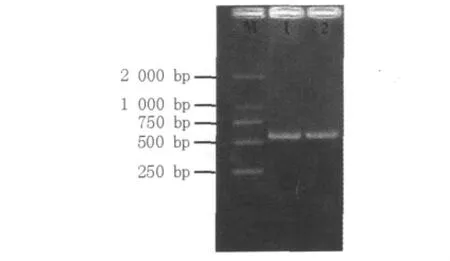
图2 PCR扩增产物电泳检测图Fig.2 The electrophoresis of PCR amplification products
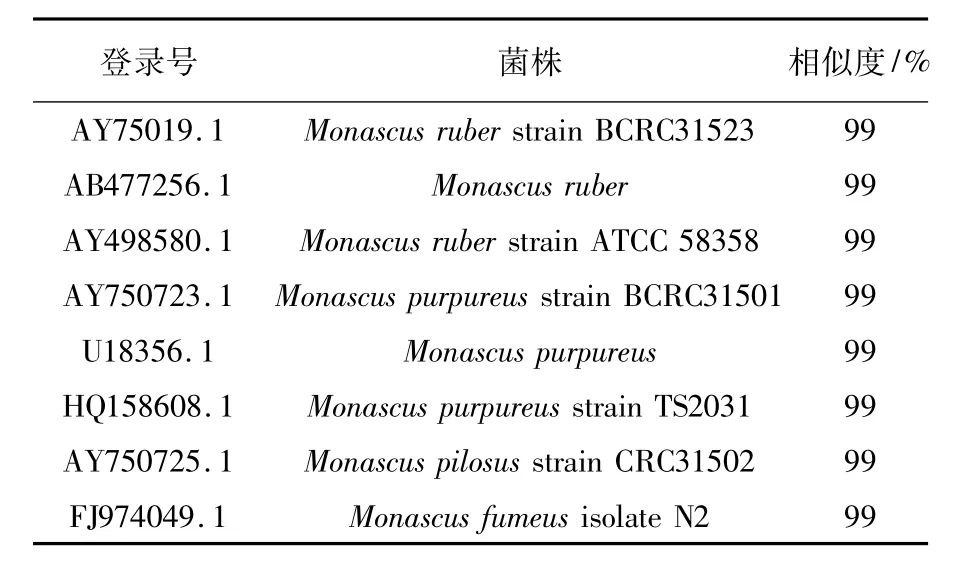
表3 菌株M-6的BLAST相似度比对结果Table 3 Results of sequence similarity alignment in BLAST for the strain M-6
结合形态特征和生理生化特征,最终将高产多糖菌株M-6鉴定为红色红曲霉(Monascus rubber)。
3 讨论
从红腐乳和红曲米中分离得到56株红曲霉菌株,通过摇瓶发酵、乙醇沉淀法最终筛选出1株产量为4.73 g/L的高产多糖菌株M-6,依据李钟庆等[8]的红曲菌属分类检索表及郭红珍等[9]有关红曲霉菌株分类鉴定的描述,初步鉴定高产菌株M-6为红色红曲霉。氮、碳是构成微生物细胞最重要的元素,利用氮源、碳源和明胶水解的能力是微生物生理上的一个重要特征,在微生物分类上占有重要地位[10]。因此,本实验对高产多糖菌株M-6的部分生理生化特征进行了研究,结果表明其最适碳源为麦芽糖,最适氮源为酵母粉,并且不能使明胶水解,故可排除其为紫色红曲霉的可能性。由于红曲菌的培养特征如菌落颜色、形态、大小等特性也都会发生一定的变化,给分类带来了很大的不确定因素[11],为了进一步确认高产菌株M-6的分类地位,利用ITS序列分析,并在GeneBank中进行Blast比对,最终确定高产菌株M-6为红色红曲霉(Monascus rubber)。
真菌多糖在免疫功能的调节、癌症的诊断与治疗、抗衰老及解除机体疲劳等方面都有着重要的作用,且得到大量国内外科学实验结果证实[12]。随着科研人员对真菌多糖功效的更深层次了解,真菌多糖将被应用于更多领域,尤其是制药及保健品行业。利用浙江省红曲资源分离筛选新功能的红曲霉菌株,生产多糖功能性食品配料,也是一种新的尝试,有利于微生物功能性食品和药物资源的开发利用,具有一定的理论意义和现实意义。
[1] Bohn J A,BeMiller J N.(1→3)-β-D-Glucans as biological response modifiers[J].Carbohyd Polymers,1995,28(1):328.
[2] Chen Zhen,Guo Qinglong,Gao Xiangdong,et al.Tumor inhibitory effect of YCP(a marine fugal polysaccharide)(I)[J].Chin J Nat Med,2005,3(6):396-400.
[3] 王舒宁.真菌多糖免疫调节作用的研究进展[J].福建畜牧兽医,2009,31(3):14-16.
[4] Kohama Y,Matsumoto S,Mimura T,et al.Isolation and identification of hypotensive principles in red-mold rice[J].Chem Pharm Bull,1987,35(6):2484-2489.
[5] 赵振锋,方惠英,诸葛健.红曲霉发酵产胞外多糖工艺的优化[J].无锡轻工大学学报,2002,2(3):289-295.
[6] 李霞姣,夏永军,王铁军,等.红曲多糖液态发酵工艺条件的优化[J].生物加工过程,2009,7(2):13-17.
[7] LI Zhongqing,GUO Fang.A further studies on the species of Monsacus[J].Mycosystema,2004,23(1):1-6.
[8] 蒋冬花,后家衡,李杰,等.红腐乳中高产γ-氨基丁酸红曲霉菌株的筛选[J].浙江师范大学学报(自然科学版),2007,30(4):447-452.
[9] 郭红珍.山西老陈醋大曲红曲霉分离鉴定及生物学特性研究[D].山西农业大学硕士论文,2004.
[10] 邢旺兴,程荣珍,宓鹤鸣,等.几种常见红曲霉的生理学特性研究[J].药学实践杂志,2001,19(4):231-233.
[11] 叶砚,蒋冬花,缪存影.红曲米和红腐乳中红曲菌种的分类与鉴定[J].工业微生物,2009,39(6):38-44.
[12] 朱建华,杨晓泉.真菌多糖研究进展、结构、特性及制备方法[J].中国食品添加剂,2005,6:75-79.
