双壳类分子生物标志物对海水重金属的响应评述*
2011-01-10孟范平赵顺顺付海防
孟范平,高 鹰,赵顺顺,付海防,肖 静
(中国海洋大学海洋环境与生态教育部重点实验室,山东青岛266100)
海洋双壳类动物是一类分布广泛、主要营固着、附着、埋栖和匍匐生活的滤食性生物,对重金属有很强的富集作用,自1980年代以来,在全球贻贝监测计划[1]、美国贻贝监测计划[2]、中国贻贝监测计划中均被作为指示生物应用于海水重金属污染监测。由于重金属在微量或痕量水平上即能产生毒性作用,而现有的化学分析技术灵敏度尚不足以检出其存在,因此单独测定双壳类体内重金属的蓄积量并不能客观指示重金属的生物效应;相反,环境中微量或痕量水平的污染物却能引起生物细胞出现可被检测的生理性改变,这些细胞被称为细胞生物标志物(cell biomarkers),而介入该生理性变化的分子则被称为分子生物标志物(molecular biomarkers,MBM s)[3]。MBM s可以通过分子水平上的变化,直接反映外来污染物与细胞靶分子的相互作用及其后果,具有较高的灵敏性和特异性,因而适于环境污染的早期预警[4]。
近20年来,国内外学者在海水重金属对双壳类动物MBM s的影响方面进行了大量研究,目的是筛选敏感、特异、容易测定的MBM s以满足海水重金属灵敏监测的需要。鳃、消化腺(或内脏)是双壳类动物积累重金属的重要器官,因此常被选为研究MBM s对重金属响应特征的组织材料。室内暴露培养期间,为保证双壳类动物生长所需的适宜环境条件,供试海水温度一般在17~25℃之间;p H值一般在7.8~8.6;盐度多在30~35。根据国内外在室内受控条件以及现场调查分析的研究结果,本文对双壳类中金属硫蛋白(MTs)、热激蛋白(HSP70)、抗氧化防御系统等MBM s对海水重金属的响应特征进行了综述,并结合我国在该领域研究中存在的问题提出了今后应重点研究的方向。
1 金属硫蛋白(metallothioneins,MTs)
1.1 双壳类MTs的结构与功能
MTs是生物体内普遍存在的一类低分子量(6000~7000D)、富含半胱氨酸(Cys),约占MTs总氨基酸数量的30%)、热稳定性高、可被金属诱导的非酶蛋白。MTs通过Cys上的巯基(-SH)与金属离子结合,使其具有双重功能[5]:①与必需的金属(Cu2+、Zn2+等)结合,在生物体内合成金属酶,可以调节这些金属离子在细胞内浓度,维持生物细胞内反应进程的动态平衡;②与非必需的有毒重金属(Pb2+、Cd2+等)结合,减少细胞与这些重金属离子的非特异性结合,从而避免有害重金属对生物体的毒害。双壳类动物体内通常含有多种类型的MTs异构体,包括MT-10、MT-20等,其结构、性质和生理功能有所不同。有学者提出[6-7],MT-20是1种诱导蛋白,主要由Cd2+诱导表达,对非必需金属元素具有解毒功能;而MT-10则是生物体内普遍存在的1种基础蛋白,包括Cd2+在内的多种金属离子均可诱导其产生,主要参与生物体内必需金属元素的调节。
1.2 双壳类MTs对海水重金属的响应特征
1970年代末,就有学者提出水生生物MTs可作为重金属暴露和毒性效应早期预警的生物标志物[8]。目前较为认可的金属离子诱导MTs的机理是金属效应因子(metal responsive element-binding transcription factors,MRTFs)机制,即:生物体内的金属响应单元——金属转录因子(MTF-1)受到金属离子激活,发生变构,进入细胞核,可对效应基因进行调控,促发MT基因表达[9]。
有关重金属诱导双壳类MTs的大量研究结果(见表1)显示:双壳类MTs诱导水平与重金属浓度之间存在相关性,可以反映海水重金属污染水平;当重金属浓度较低时,双壳类MTs含量随着暴露时间延长而增加;重金属浓度较高时,MTs含量仅在较短时间内上升,而后呈下降趋势[10]。Yong等[11]将太平洋牡蛎(Crassostrea gigas)在含Cd2+(0.01~0.1 m g/L)海水中暴露11d后发现,消化腺、鳃的MT m RNA表达量随剂量增加而上升,高浓度Cd2+暴露后,消化腺和鳃MT m RNA表达量分别比对照组增加128倍和139倍。此外,Amiard[12]等研究发现,重金属V能诱导贻贝(My tilus sp.)MTs产生,且MTs的合成水平与总V、可溶态V含量之间均存在显著正相关关系,可作为海洋V污染的有效生物标志物。
重金属对双壳类MTs的诱导程度因器官或组织而异(见表1)。同鳃、外套膜等组织相比,消化腺MTs更容易被诱导,其含量随着重金属浓度升高而显著增加,而鳃和外套膜的MTs含量变化不显著甚至出现降低趋势。这可能与组织结构、功能不同有关:鳃和外套膜是生物体接触和吸收毒物的器官,但不是主要的累积部位;消化腺是机体的解毒器官,容易蓄积重金属而诱导更多的MTs合成[13]。因此,通常认为消化腺较适于作为监测重金属的MTs来源。然而,有些学者对太平洋牡蛎[17-18]、文蛤(Ruditapes decussates)[19]等研究发现,消化腺MTs含量大于鳃,但消化腺MTs本底值较高,其相对增量小于鳃,因而认为鳃更适于作为MTs监测重金属的组织材料。
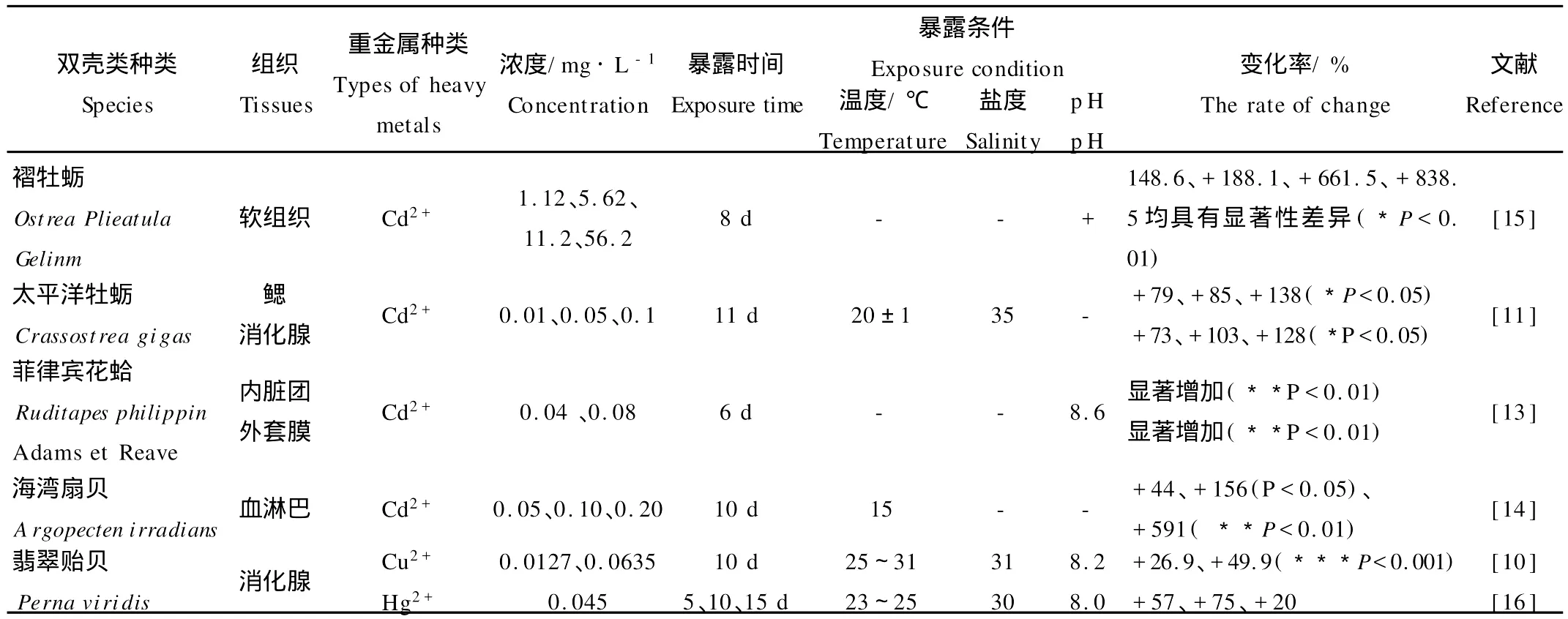
表1 暴露于重金属的海洋双壳类MTs响应特征Table 1 Response of MTs in several bivalves exposed to heavy metals in seawater
污染海域现场测定的重金属对双壳类MTs的诱导水平与室内急性暴露实验的结果有显著差异。室内暴露实验中,虽然生物体内重金属蓄积量有显著增加,但对MTs的诱导量却不及污染海域[21-22]。法国生态毒理研究中心的Geffard[20]等比较了这两种暴露方式下金属离子(Cd2+、Cu2+、Zn2+)对贻贝(M.edulis)MTs的诱导量:在室内急性暴露实验条件下,以鳃为例,Cd2+含量比对照组增加242倍,而MTs的诱导量仅增加3倍;相反,在重金属污染海域,贻贝对3种金属离子的蓄积量均较低,却能显著诱导MTs的合成,例如,消化腺Cd2+累积量仅增加1倍,而MTs的诱导量却增加0.4倍。Geffard等[17-18,20-23]进一步研究提出,室内重金属暴露对紫贻贝(M.galloprovincialis)鳃MTs的诱导最强,而污染海域则以消化腺MTs的诱导量最高;太平洋牡蛎MTs诱导的组织差异性与紫贻贝正好相反。Fernandez等[23]对西班牙地中海沿岸16个站位的紫贻贝测定结果表明,鳃中的MTs含量与任何重金属不相关,可能是因为鳃对重金属的积累能力远小于消化腺,不足以诱导和积累明显的MTs。因此,以MTs作为海水重金属的生物标志物时,不仅要选用适宜的双壳类种类和组织部位,还应充分考虑现场暴露与室内暴露对MTs诱导的差异性。
2 热激蛋白70(HSP70)
2.1 HSP70的结构与功能
热激蛋白(HSPs)是生物体内一组由热逆境激活HSPs基因而高效表达的常见蛋白质[24]。这些蛋白质在进化上高度保守,按其分子量可分为HSP27、HSP60、HSP70、HSP90和HSP100等种类。HSP70是热激蛋白家族中最保守的一员,分子量约70kD,分子结构主要由1个N端高度保守的44kD A TP酶功能域(A TP binding domain)和1个28kD的C端区域组成[25],其中,N-末端的A TP酶功能域可用于结合A TP。在正常细胞内HSP70的水平较低,而在应激状态下升高较为明显。高温处理可以在短时间内诱导HSP70合成,有利于修复、阻止细胞蛋白的逆境伤害和减少蛋白凝结。例如,在A TP存在条件下,HSP70可以使变性的RNA聚合酶重新获得活性,使热失活的荧光素酶活性恢复80%。
2.2 双壳类HSP70对海水重金属的响应特征
与MTs相似,生物体中的HSP70合成也会受到重金属诱导,诱导机制也非常相近[26]:进入生物体的重金属离子激活热激转录因子(HSF),HSF释放到细胞质中,形成三聚体,迁移到细胞核内,与位于HSP70基因启动子区域的热激单元(HSE)结合,激活HSP70基因的表达和转录过程。这种诱导效应在重金属的浓度接近于环境背景值甚至更低水平时即能发生,使HSP70具备了作为环境重金属污染预警指标的潜力[27-29]。研究表明,海水中的重金属在较短时间内即能诱导双壳类动物HSP70大量表达,但暴露时间过长,生物体HSP70含量呈现下降趋势。克罗地亚里耶卡大学的Micovic等[30]研究发现,将紫贻贝在Cd2+浓度为100~500μg/L的18℃海水中暴露24 h,消化腺中HSP70含量显著增加,且与Cd2+浓度成线性关系(r=0.987 5)。意大利博洛尼亚大学Franzellitti等[31]的研究中,在温度16℃、盐度34的海水中,紫贻贝暴露于150μg/L(0.75μmol/L)的Hg2+,初期消化腺中HSP70的合成受到显著诱导,并在暴露24 h时达到最大值,而后HSP70含量逐渐下降。
重金属的种类及其化学形态可能影响其对海洋双壳类动物HSP70的诱导。例如,Franzellitti等[32]发现,紫贻贝在Cr6+浓度为1、10 ng/L的海水(温度16℃、盐度34)中暴露培养1周,消化腺中HSP70含量显著低于对照组。在同样温度和盐度的海水中[31],0.75μM的CH3Hg+并未像Hg2+那样诱导HSP70合成,而是明显抑制了紫贻贝消化腺中HSP70的表达。由此认为,双壳类动物对于不同种类和形态的污染物可产生不同的细胞保护性响应。
虽然室内受控条件下的研究大多认为双壳类动物的HSP70对海水中微量重金属能够迅速响应(诱导或抑制),但是,现场条件下将其作为生物标志物的研究却少得多。由于生物细胞内的HSP70对于低温、高温以及p H、盐度、溶解氧的变化也会产生响应,使得HSP70对海水重金属的指示效果受到较多干扰。其中,温度变化对暴露于重金属的双壳类HSP70响应的影响受到较多关注。适宜温度(紫贻贝18℃[32]、美洲牡蛎(Crassostrea virginica)12℃[33])的海水不会影响到重金属对双壳类HSP70的诱导效果。当环境温度比生物适宜生长温度提高或降低5~10℃以上时,则可明显诱导双壳类HSP70的合成[34-35]。相对而言,低温下HSP70的诱导更适于作为重金属暴露的生物标志物。因此,利用双壳类HSP70作为海水重金属的生物标志物时,应尽可能保持各监测站位的温度一致。
3 抗氧化防御系统(Antioxidant defense system)
抗氧化防御系统是生物体内重要的活性氧清除系统。当暴露于可产生氧化还原循环的污染物(重金属等)时,机体内将产生超氧阴离子(O-2·)、羟基(·OH)、单线态氧(1O2)和过氧化氢(H2O2)等活性氧。在重金属暴露初期或浓度较低时,生物体内的抗氧化防御系统受到激活,能有效清除活性氧,防止其造成的氧化损伤,但是,当体内污染物含量随暴露时间延长而积累到一定程度时,活性氧产生速度超出抗氧化防御系统的清除能力,就会对机体造成氧化胁迫,引起脂质过氧化、DNA链断裂、碱基核糖基氧化、酶蛋白胶联以至细胞死亡或癌变[36]。在有关海水重金属对双壳类动物抗氧化防御系统影响的研究中,涉及较多的抗氧化剂包括:超氧化物歧化酶(SOD)、过氧化氢酶(CA T)、谷胱甘肽(GSH)、谷胱甘肽过氧化酶(GPx)、谷胱甘肽转硫酶(GST)、谷胱甘肽还原酶(GR)等。
3.1 SOD和CA T对海水重金属的响应特征
SOD主要存在于细胞质内以及线粒体内外膜之间,是机体内O-2·的天然消除剂,能催化O-2·发生歧化反应生成H2O2和O2[37]。大多数有关海水重金属对双壳类SOD活性影响的研究(见表2)发现,低浓度或短时间的重金属暴露均能诱导双壳类SOD的活性,但是随着暴露时间延长或者浓度增加,这种诱导幅度逐渐变小,甚至出现抑制[38-44,48],呈现“抛物线型”的剂量-效应关系[38]。例如,近江牡蛎(Crassostrea ribularis)分别在含高、中、低浓度的Cd2+(0.1、0.5、1.5 m g/L)、Cu2+(0.1、0.5、1.5 mg/L)、Pb2+(0.2、1.0、3.0 mg/L)、Zn2+(0.2、1.0、3.0 mg/L)的海水中暴露6 d,无论是消化腺还是鳃,SOD活性均表现为“低扬高抑”变化趋势[39,41]。有学者认为[38-39],低浓度污染物对SOD活性的诱导作用可认为是生物体对污染的应激反应,以增强机体消除活性氧自由基的能力;高浓度污染物对SOD活性的抑制作用则意味着污染逆境对生物体的作用已超过机体的适应能力,其所导致的酶活性降低是中毒反应的前兆。个别研究则发现,重金属暴露后期,经历“低扬高抑”的SOD会再被激活[45]。过低浓度的重金属时一般不会引起SOD活性明显变化。例如,将栉孔扇贝(Ch lam ys farreri)分别在Hg2+、Cu2+浓度为0.05μg/L和3μg/L的海水中培养96 h,消化腺的SOD活性与对照组无显著差异[49]。利用0.2 mg/L的Zn2+培养近江牡蛎6 d,未观察到消化腺SOD活性的明显变化。
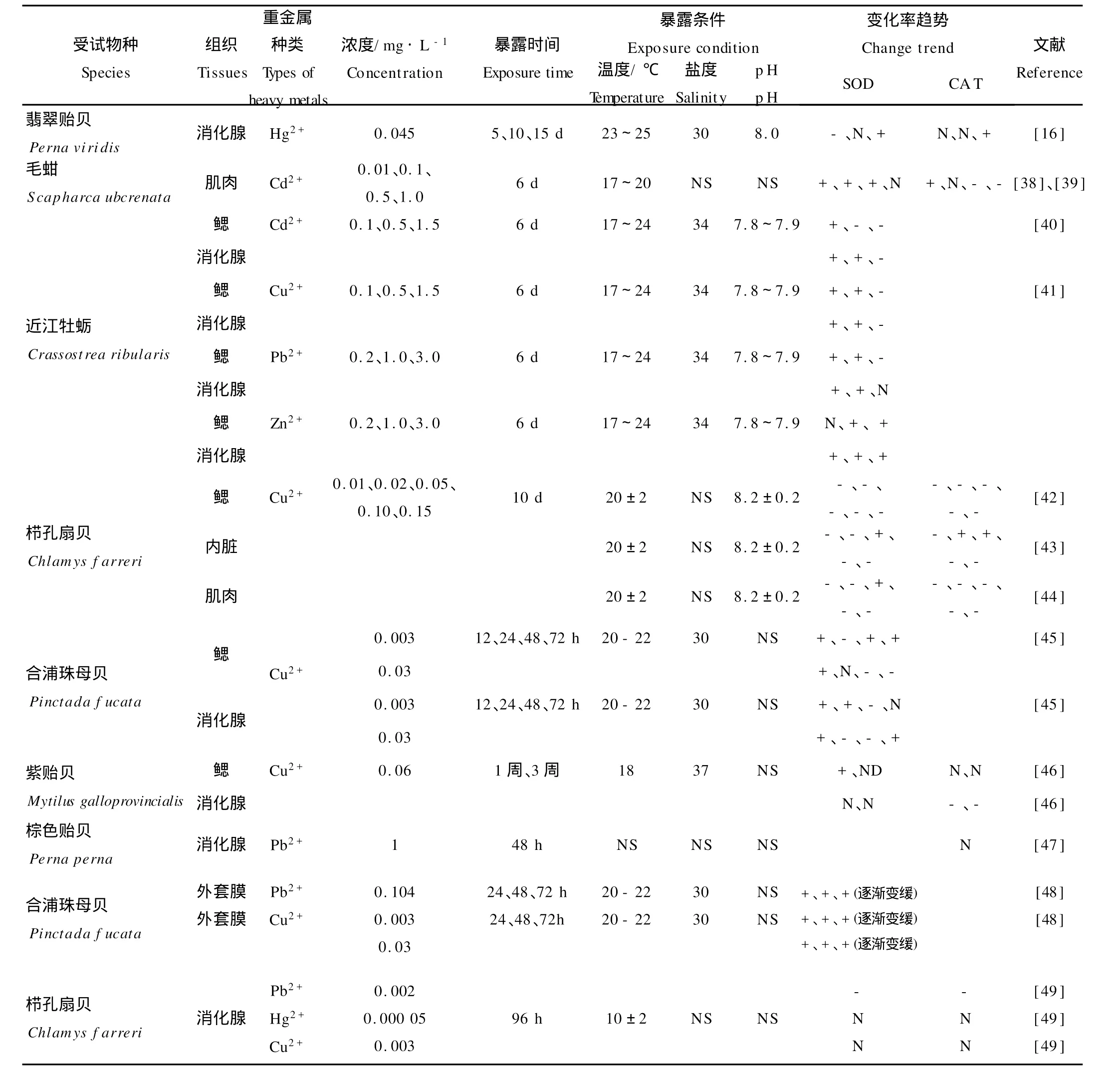
表2 暴露于海水重金属后双壳类SOD和CA T的响应Table 2 Responses of SOD and CA T in several bivalves exposed to heavy metals in seawater
CA T是一类末端氧化酶,主要功能是将体内的H2O2分解成O2和H2O,减轻H2O2对细胞的氧化损伤。与SOD不同,较低浓度的重金属诱导双壳类CA T活性的情况十分少见,只有赵元凤等报道0.01 mg/L的Cd2+培养毛蚶(Scapharca ubcrenata)6 d后,肌肉中CA T活性比对照增加49%[39]。部分研究发现,随着海水重金属浓度的增加或暴露时间延长,双壳类CA T活性受到较大抑制[39,42-44,46,49]。例如,将毛蚶在含Cd2+海水中培养6 d,当Cd2+浓度依次为0.1、0.5、1.0 m g/L时,肌肉CA T活性受到明显抑制[37]。也有部分学者的研究表明,重金属不能引起CA T活性的明显变化:栉孔扇贝分别在Hg2+、Cu2+浓度为0.05和3μg/L的海水中培养96 h,消化腺CA T活性基本没有变化[49];翡翠贻贝(P.viridis)在含Hg2+0.045 mg/L的海水中暴露10 d,消化腺CA T活性与对照无差异,直至15 d才观察到活性显著升高[16]。这可能是因为重金属浓度过低或者受试动物CAT的敏感性不高。虽然许多学者认为CAT是1种对氧化逆境敏感性优于SOD的生物标志物[50],但是综合表2的文献结论,双壳类动物CAT对重金属的敏感性不及SOD。
2种抗氧化酶对重金属的响应程度因重金属的种类、双壳类动物组织器官的不同而存在明显差异。江天久等[40-41]将近江牡蛎分别在含有低浓度重金属的海水中暴露6 d,以鳃SOD、消化腺SOD的诱导倍数作为敏感性评价指标,4种重金属对2种组织中SOD的诱导能力由大到小的顺序为:Cd2+>Cu2+>Pb2+>Zn2+,表明近江牡蛎SOD对Cd2+最为敏感。
3.2 GSH及其相关酶类对海水重金属的响应特征
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸构成的三肽,分为氧化型(GSSG)和还原型(GSH)2种。GSH是通过捕获氧自由基防止细胞膜发生类脂过氧化的最重要抗氧化剂之一[46]。其功能是作为GPx和GST的底物,以清除机体内的活性氧自由基(·OH、H2O2和1O2等)和脂质过氧化物。其中,GPx通过催化GSH与H2O2或有机过氧化物(ROOH+2GSH→ROH+H2O+GSSG)反应,有效阻止自由基引起的氧化损伤;GST是位于细胞浆中防御外源性化合物的解毒酶,能催化GSH分子通过-SH、-N H2、-COOH以及肽键与重金属离子结合,自身被氧化为GSSG[46],表现为生物体内GSH含量以及GSH/GSSG比值降低。为了维持细胞正常代谢功能所需的适宜GSH/GSSG比例,细胞中的GR利用NADPH作为电子供体,催化GSSG的二硫键还原,重新生成GSH,以保持细胞的氧化还原特征。
双壳类动物的GSH及其相关酶类能够对海水重金属产生一定程度的响应(见表3),其中,GPx是较为敏感的抗氧化指标,Cu2+[42-44,49]、Pb2+[49]、Hg2+[49]的暴露一般会抑制双壳类鳃和消化腺中GPx活性。Zn是生物生长的1种必需微量元素,低浓度Zn2+(10 μmol/L,约为96 h LC50的1/10)暴露48 h,能够明显增加棕色贻贝(Perna perna)鳃的GPx活性,但是当Zn2+浓度增加到30μmol/L、100μmol/L时,同样时间的暴露不再能够诱导GPx活性,表明高浓度Zn2+在机体内产生了较多的自由基,无法进行有效防御[51]。双壳类外套膜的GPx对金属离子较不敏感:合浦珠母贝(Pinctada fucata)经过0.03 mg/L的Cu2+暴露72 h[45],消化腺和鳃中GPx活性显著低于对照组,而外套膜GPx活性则无明显变化。
重金属的暴露大多会造成双壳类动物GSH含量降低和GSSG增加[46-47,52],这种变化比GST、CA T等抗氧化酶的响应迅速。例如,当棕色贻贝分别暴露于含Cd2+(0.2 mg/L)和Cu2+(0.04 mg/L)的海水时,GSH含量在12和24 h已显著低于对照,而CA T活性在暴露120 h后才显著上升[52]。Dafre等[47]的研究同样发现,经过1 mg/L的Pb2+暴露48 h,棕色贻贝消化腺的GSH含量降低、GSSG含量增加,而GST、CA T活性与对照组则没有显著差异。GSH虽能对重金属快速响应,但是细胞自身趋于保持还原态GSH水平恒定的机制,使得暴露后期双壳类动物GSH含量有所恢复甚至明显增加[16,51-52],掩盖了暴露初期GSH对重金属的响应,降低了其对重金属的敏感性,限制了其在重金属生物监测的应用。
GR将GSSG再生为GSH,有利于保持细胞内的-SH水平,因此,逆境条件下GR的诱导十分重要。然而,从室内双壳类动物的重金属暴露研究看,只有Verlecar等[16]发现翡翠贻贝在0.045 m g/L Hg2+暴露5和15 d后,消化腺GR活性明显增加,相应地,GSH含量在暴露期间保持不变甚至上升。较多的研究发现,海水重金属(Cu2+、Zn2+等)能够抑制紫贻贝消化腺[46]和棕色贻贝鳃[51]的GR活性。随着重金属暴露后GR活性的下降,GSH含量也不总是表现为同步降低,甚至会有明显上升。这可能是因为重金属通过诱导速控酶谷胺酸半胱氨酸连接酶(Glutamate cysteine ligase,GLC)促进了GSH合成[51]。
GST虽然也能催化GSH与重金属污染物之间的反应,但是,许多室内研究表明,棕色贻贝[47,51]、紫贻贝[46]、栉孔扇贝[49]等双壳类动物消化腺和鳃中的GST对重金属的短期暴露(48 h)和长期暴露(1~3周)没有产生任何明显响应。只有极个别研究发现[16],0.045 mg/L的Hg2+能够诱导翡翠贻贝消化腺的GST活性,且需在暴露10 d后才能检测到。
环境条件(温度、盐度、溶解氧、p H)和生物因子(动物年龄、个体大小或发育阶段、饥饿、病害等)的变化,都可能影响到生物体对重金属的敏感性[53]。在污染海域现场,这些因子的变化同样也会影响到双壳类动物抗氧化防御系统对重金属的响应程度,并与室内受控条件下的研究结果存在一定差异。西班牙Colexio大学的Vidal-Linan等[54]对西班牙加利西亚沿海5个站位(其中3个位于重金属污染严重的河口内,2个位于远离污染的河口外部)的紫贻贝进行采样分析发现,贻贝组织中的GST活性与Cu(p<0.01,r2=0.76)、Zn(p<0.05,r2=0.40)含量显著相关,然而,GPx、CAT与贻贝中重金属含量的相关性不显著。另外一项研究对西班牙地中海沿岸16个站位紫贻贝鳃组织的生物标志物和重金属含量进行测定,Pearson统计分析表明[23],GPx、GR和GST相互间表现为正相关性,且均与Hg、Pb、Cd含量呈显著正相关关系,GR还与Zn含量显著正相关,而SOD、CAT活性与Hg含量呈现显著的负相关关系;同时还发现,As含量与各标志物之间均不存在显著相关性,原因可能是贻贝等海洋动物主要吸收积累非毒性的有机态砷(特别是砷甜菜碱)而非生物毒性大的无机态砷[23],因而不能造成氧化逆境或过氧化损伤。西班牙科多巴大学的Rodriguez-Ortega等[55]对西班牙南部沿海地区7个站位的(Chamaelea gallina)软组织中生物标志物水平和9种重金属含量进行测定,并利用多元回归法辨析与重金属相关和无关的标志物种类。很多重金属(Cr、Pb、Zn等)对生物标志物表现出抑制效应,即呈显著负相关关系,包括:As与GST、GSH和GPx,Cr与CAT,Zn与GSH,Pb与CAT、GSH;呈现显著正相关的仅有Cr与GST、GR,Zn与GR;而SOD则与任何重金属之间无显著相关性。
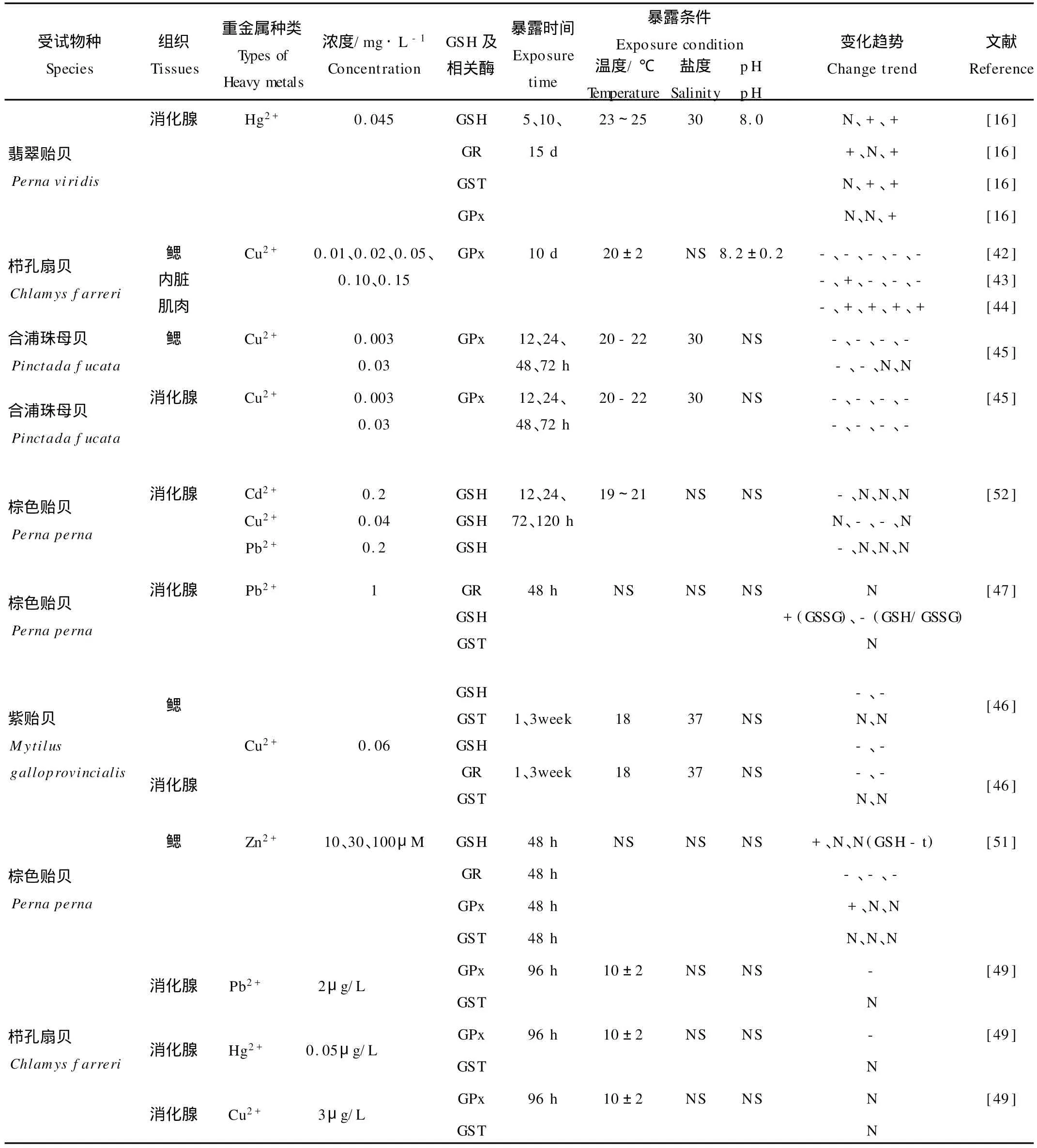
表3 暴露于海水重金属后双壳类GSH、GPx、GR、GST的响应Table 3 Responses of GSH,GPx,GR and GST in several bivalves exposed to heavy metals in seawater
4 展望
国内外已有的研究表明,MTs是重金属的特异性MBM s,而HSP70以及SOD、CA T、GSH等均属于非特异性MBM s。室内暴露实验和海域现场调查的结果证实,双壳类动物中的这些MBM s对海水中mg/L甚至μg/L数量级的重金属能够产生显著响应,并存在一定的相关性,因而使其应用于海水重金属微污染的灵敏监测成为可能。欧洲国际海洋勘察委员会(ICES)[56]已将这些MBM s作为海洋生态健康评价中指示重金属污染的指标。国外研究机构(如美国国家海洋和气象局NOAA[2]、ICES[56]等)近十年来致力于利用双壳类生物标志物评价海洋环境生态风险技术研究,主要进行多种暴露途径、多种化合物综合影响的野外现场试验,通过将清洁区双壳类生物以笼养方式移植到污染海域,实现“原位”指示污染状况,并通过建立适宜的双壳类生物标志物体系和计算生物标志物响应指数(BRI),实现海洋生态环境质量的等级划分和综合评价。
相对而言,国内起步相对较晚,尚处于实验室受控条件下单一暴露途径的基础研究阶段,在重金属的MBM s种类上,主要集中在双壳类的抗氧化防御系统和MTs,而有关双壳类HSP70对海水重金属暴露的响应研究较少;在宏观上,尚未很好地同野外实际状况相结合;在微观上,未能深入研究污染物的致毒机理。为了将双壳类动物的MBM s更快更好地应用于我国海域重金属污染监测和评价,还需要在以下几方面进行广泛而深入的研究。
(1)MBM s种类的选择。在海洋重金属的生物监测中,特异性MBM s和非特异性MBM s各有其重要作用,均应受到重视。大多数MBM s是非特异性的,一般比较容易测定,也能够对存在于环境中的复杂混合物产生响应,并提供指示环境扰动而不是因果关系的信息,以满足污染现状概况评价的需要;MTs则适于重金属存在的情况。在某一海域的污染监测中,可首先采用经济、快速的非特异性MBM s,确定受人为活动干扰大的位点,而后进一步采用成本高、费时的MTs确定是否受到重金属的污染。
(2)MBM s分析方法的规范化。每种MBM s可能有多种测定方法,为保证海洋重金属生物监测的经济、快速,应选择操作简便、容易测定、不需要复杂仪器设备的分析方法。对于选定的MBM s,应进行质量保证和质量控制(QA/QC),以确保测定结果的重现性和同一样品在不同实验室的可重复性,包括:不同实验室所使用的生物标志物的内部校正;标准的操作方法(SOPs)的建立等。
(3)MBM s供体的标准化。双壳类MBM s对重金属暴露的响应受到生物种类、性别、发育阶段、组织器官种类等生物学因子的影响。应以国内各海域分布广泛的双壳类动物作为研究材料,在室内受控条件下,系统研究双壳类的种类、性别、发育阶段、组织器官种类对重金属暴露后MBM s响应的影响,通过分析比较,确定作为提取MBM s的双壳类应具备的生物特征,在区域或国家范围内,规范统一由此保证生物标志物供体的标准化。
(4)非生物因子对MBM s响应的干扰。调查海域的环境因子(p H、温度、盐度、溶解氧等)不象室内实验那样可以恒定控制,其波动将影响双壳类动物生长及其对重金属的吸收积累,进而干扰MBM s对重金属的响应程度[53],降低MBM s指示海水重金属污染水平的准确性。为此,应通过室内系统研究,辨析这些因子的不同水平对MBM s响应的影响方向和大小,在此基础上,确定干扰较大的环境因子,以便对现场应用MBM s进行监测时的采样季节和站位选择提供指导,使不同站位的采样条件尽可能一致,降低非生物因子对MBM s指示重金属污染程度的影响。
(5)深入研究海水背景下重金属与双壳类MBM s之间的作用机理,有助于合理解析重金属胁迫后各种MBM s的变化规律,以便客观地评价重金属的海洋生态风险性。
[1] IMW.International Mussel Watch Project:initial implementation phase,final report[R].Silver Sp ring,MD:US Department of Commerce,National Oceanic and Atmospheric Administration,Office of Ocean Resources Conservation and Assessment,National Ocean Service,1995.
[2] Kimbrough K L,Lauenstein G G,Christensen J D,et al.An assessment of two decades of contaminant monitoring in the Nation’s Coastal Zone[R].Silver Spring,MD:NOAA/National Centers for Coastal Ocean Science,(NOAA Technical Memorandum NOSNCCOS,74),2008.
[3] Gutierrez J C,Martin-Gonzalez A,Diaz S,et al.Ciliates as a potential source of cellular and molecular biomarkers/biosenso rs fo r heavy metal pollution[J].European Journal of Protistology,2003,39:461-467
[4] 周驰,李纯厚.生物大分子标记物检测在环境监测中的应用[J].中国水产科学,2007,14(5):864-871.
[5] Nordberg M.Metallothioneins:historical review and state of know ledge[J].Talanta,1998,46:243-254.
[6] Lemoine S,Bigot Y,Sellos D,et al.Metallothionein is of ormsin Mytilusedulis(Mollusca,Bivalvia):complementary DNA characterization and quantification of exp ression in different organs after exposure to cadmium,zinc,and copper[J].Marine Biotechnology,2000,2:195-203.
[7] Laura V,M yriam G,Elena G,et al.Molecular characterization and function analysis of MT-10 and MT-20 metallothionein is oforms from Mytilus galloprovincialis[J].Archives of Biochemistry and Biophysics,2007,465(1):247-253.
[8] Domouhtsdou G P,Dailianis S,Kaloyianni M,et al.Lysosomal membrane stability and metallothionein content in Mytilus galloprovincialis(L.),as biomarkers:combination with trace metal concentrations[J].Marine Pollutution Bulletin,2004,48:572-586.
[9] Li Y,Kimura T,Laity J H,et al.The zinc-sensingmechanism of mouse MTF-1 involves linker peptides between the zinc fingers[J].Molecular and Cellular Biology,2006,26(15):5580-5587.
[10] 李春娣,颜文,龙爱民,等.Cu暴露条件下翡翠贻贝消化腺内金属和类金属硫蛋白的变化[J].环境科学,2007,28(8):1788-1795.
[11] Yong K C,Pil G J,Cheol Y C.Cadmium affects the expression of heat shock protein 90 and metallothione in mRNA in the Pacific oyster,Crassostrea gigas[J].Comparative Biochemistry and Physiology C:Pharmacology Toxicology and Endocrinology,2008,147(3):286-292.
[12] Amiard JC,Journel R,Bacheley H.Influence of field and experimental exposure of mussels(Mytilus sp.)to nickel and vanadium on metallothionein concentration[J].Comparative Biochemistry and Physiology C:Pharmacology Toxicology and Endocrinology,2008,147(3):378-385.
[13] 柯翎,骆庭伟,林志超.利用菲律宾花蛤的金属硫蛋白作为镉污染的检测指标[J].漳州师范学院学报:自然科学版,2004,17(1):60-64.
[14] Ling L W,Lin SS,Duo JN,et al.Alteration of metallothionein m RNA in bay scallop Argopectenirra dians under cadmium exposure and bacteria challenge[J].Comparative Biochemistry and Physiology C:Pharmacology Toxicology and Endocrinology,2009,149:50-57.
[15] 任育红,吴江涛,杨加华,等.镉诱导牡蛎金属硫蛋白的初步研究[J].中国海洋药物,2002(6):29-31.
[16] Verlecar X N,Jena K B,Chainy GB N.Modulation of antioxidant defences in digestive gland of Perna viridis(L.),on mercury exposures[J].Chemosphere,2008,71:1977-1985.
[17] Geffard A,Am iard T C,Amiard J C,et al.Temporal variations of metallothionein and metal concentrations in the digestive gland of oysters Crassostrea gigas from A clean and a metal-rich sites[J].Biomarkers,2001,6(2):91-107.
[18] Geffard A,Amiard J C,Amiard T C.U se of metallothionein in gills from oysters(Crassostrea gigas)as a biomarker:seasonal and intersite fluctuations[J].Biomarkers,2002,7(2):123-137.
[19] Bebianno M J,Serafim M A,Simes D.Metallothioneins in the clam Ruditapes decussatus:an overview[J].Analusis,2000,28:386-390.
[20] Geffard A,Geret F,Amiard J C,et al.A remussels a satisfying material for metal biomonitoring involving metallothionein as a biomarker[C].∥Brighton,United Kingdom:Proceedingsof the Third SETAC.Wo rld Congress on Global Environmental Issues in the 21st Century:Problems,Causes and Solutions,2000,5:21-25.
[21] Geffard A,Amiard T C,Amiard JC.Do seasonal changes interfere with metallothionein induction by metals in mussels M ytilus edulis[J]?Ecotoxicology and Environment Safety,2005,61(2):209-220.
[22] Geret F,Geffard A,Amiard J C,et al.Field and laboratory assessment of metallothionein as a biomarker of metal exposure in oysters[C].∥Brighton,United Kingdom:Proceedings of the Third SETAC,World Congress,Global Environmental Issues in the 21st Century:Problem s,Causes and Solutions.2000,5:21-25.
[23] Fernandez B,Camoillo J A,Martinez-Gomez C,et al.Antioxidant responses in gills of mussel(M ytilus galloprovincialis,)as biomarkers of environmental stress along the Spanish Mediterranean coast[J].Aquatic Toxicology,2010,99:186-197.
[24] Feder M E,Hofmann G E.Heat shock p roteins,molecular chaperones and the stress response:evolutionary and ecological physiology[J].Annual Review of Physiology,1999,61:243-282.
[25] 曲凌云.三种热休克蛋白HSP70在逆境因子下的和相关基因的克隆[D].青岛:中国科学院海洋研究所,2004.
[26] Ait-Aissa S,Porcher J M,A rrigo A,et al.Activation of the hsp70 p romoter by environmental inorganic and organic chemicals:relationships with cytotoxicity and lipophilicity[J].Toxicology,2000,145:147-157.
[27] 杨秉芬,孙启鸿,曹诚.热激蛋白70研究进展[J].生物技术通讯,2009,20(5):716-718.
[28] Lee SM,Lee S B,Park C H,et al.Exp ression of heat shock p rotein and hemoglobin genes in Chironomus tentans larvae exposed tovarious environmental pollutants:Apotential biomarker of fresh water monitoring[J].Chemosphere,2006,65:1074-1081.
[29] Song L S,Wu L T,NiD J,et al.The cDNA cloning and mRNA exp ression of heat shock protein 70 gene in the haemocytesof bay scallop responding to bacteria challenge and naphthalin stress[J].Fish&Shellfish Immunology,2006,21:335-345.
[31] Franzellitti S,Fabbri E.Cytop rotective response in the Mediterranean mussel exposed to Hg2+and CH3Hg+[J].Biochemical and Biophysical Research Communications,2006,351:719-725.
[32] Franzellitti S,Fabbri E.Differential HSP70 gene exp ression in the Mediterranean mussel exposed to various stresso rs[J].Biochemical and Biophysical Research Communications,2005,336:1157-1163.
[33] Ivanina A V,Taylor C,Sokolova IM.Effects of elevated temperature and cadmium exposure on stress protein response in eastern oysters Crassostrea virginica(Gmelin)[J].Aquatic Toxicology,2009,91:245-254.
[34] Brun N T,Bricelj V M,MacRae T H,et al.Heat shock p rotein responses in thermally stressed bay scallops,Agropecten irradians,and sea scallops,Placopecten magellanicus[J].Journal of Experimental Marine Biology and Ecology,2008,358:151-162.
[35] Lindquist S.The heat shock response[J].Annu Rev Biochem,1986,55:1151-1159.
[36] Valavanidis A,V lahogianni T,Dassenakis M,et al.Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants[J].Ecotoxicology and Environment Safety,2006,64:178-189.
[37] Manduzio H,Monsinjon T,Rocher B,et al.Characterization of an inducible isoform of the Cu/Zn superoxide dismutase in the mussel M ytilus edulis[J].Aquatic Toxicology,2003,6(64):73-83.
[38] 赵元凤,吕景才,李丹彤,等.海洋污染对毛蚶超氧化物歧化酶影响的研究[J].海洋学报,2003,25(3):77-82.
[39] 赵元凤,吕景才,宋晓阳.海洋污染对毛蚶过氧化氢酶影响研究[J].环境科学学报,2002,22(4):534-536.
[40] 江天久,曾淼.重金属Cd2+胁迫对近江牡蛎超氧化物歧化酶活性的影响[J].热带海洋学报,2006,25(6):63-67.
[41] 江天久,牛涛.重金属Cu2+、Pb2+和Zn2+胁迫对近江牡蛎(Crassostrea rivularis)SOD活性影响研究[J].生态环境,2006,15(2):289-294.
[42] 王凡,赵元凤.Cu2+对栉孔扇贝鳃组织抗氧化酶的影响[J].湖北农业科学,2007,46(1):117-119.
[43] 王凡,赵元凤.铜污染对扇贝内脏团抗氧化酶活性的影响[J].水产科学,2008,27(12):622-624.
[44] 王凡,李法松.铜污染对扇贝肌肉抗氧化酶活性的影响[J].安徽农业科学,2006,34(23):6109-6112.
[45] Jing G,Li Y,Xie L P,et al.Metal accumulation and enzyme activities in gillsand digestive gland of pearloyster(Pinctada fucata)exposed to copper[J].Comparative Biochemistry and Physiology C:Pharmacology Toxicology and Endocrinology,2006,144:184-190.
[46] Regoli F,Principato G.Glutathione,glutathione-dependent and antioxidant enzymes in mussel,M ytilus galloprovincialis,exposed to metals under field and laboratory conditions:implications for the use of biochemical biomarkers[J].Aquatic Toxicology,1995,31:143-164.
[47] Dafre A L,Medeiros ID,M uller IC,et al.Antioxidant enzymes and thiol/disulfide status in the digestive gland of the brow nmussel Perna perna exposed to lead and paraquat[J].Chemico-Biological Interactions,2004,149:97-105.
[48] Jing G,Li Y,Xie L P,et al.Different effectsof Pb2+and Cu2+on immune and antioxidant enzyme activities in the mantle of Pinctada fucata[J].Environmental Toxicology and Pharmacology,2007,24:122-128.
[49] Zhang Y,Song J J,Yuan H M,et al.Biomarker responses in the bivalve(Chlam ys farreri)to exposureof the environmentally relevant concentrations of lead,mercury,copper[J].Environmental Toxicology and Pharmacology,2010,30:19-25.
[50] Regoli F,Gorbi S,Frenzilli G,et al.Oxidative stress in ecotoxicology:from the analysis of individual antioxidants to a more integrated app roach[J].Marine Environment Research,2002,54:419-423.
[51] Franco J L,Trivella D B B,Trevisan R,et al.Antioxidant status and stress proteins in the gills of the brownmussel Perna perna exposed to zinc[J].Chemico-Biological Interactions,2006,160:232-240.
[52] Almeida E A,Miyamoto S,Bainy A C D.Protective effect of phospholipid hydroperoxide glutathione peroxidase(PHGPx)against lipid peroxidation in mussels Perna perna exposed to different metals[J].Marine Pollutution Bulletin,2004,49:386-392.
[53] Holmstrup M,Bindesbol A-M,Oostingh GJ,et al.Interactions between effectsof environmental chemicals and natural stressors:A review[J].Science of the Total Environment,2010,408:3746-3762.
[54] Vidal-Linan L,Bellas J,Campillo J A,et al.Integrated use of antioxidant enzymes in mussels,Mytilus galloprovincialis,for monitoring pollution in highly productive coastal areas Galicia(NW Spain)[J].Chemosphere,2010,78:265-272.
[55] Rodriguez-Ortega M J,Rodriguez-A riza A,Gomez-A riza J L,et al.M ultivariate discriminant analysis distinguishes metal-from non metal-related biomarker responses in the clam Chamaelea gallina[J].Marine Pollution Bulletin,2009,58:64-71
[56] Galloway T S,Hagger J A,Lowe D,et al.Can biomarkers measure the environmental health of estuaries?[R].Helsinki:ICESCM 2007/1:01.
