饲料中添加枯草芽孢杆菌和壳寡糖对大黄鱼幼鱼血清免疫指标的影响*
2011-01-10徐后国艾庆辉麦康森刘付志国
徐后国,艾庆辉,麦康森,徐 玮,刘付志国
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
枯草芽孢杆菌是我国农业部正式批准使用的益生菌,具有菌种单一、不产生耐药性、无毒性等特点,作为益生菌亦具有耐酸、耐盐、耐高温及耐挤压等特性,适合在饲料中添加使用。枯草芽胞杆菌在动物肠道内代谢、增殖,可以调节肠道菌群、提高机体消化能力、增强免疫力和抗病力[1-5]。甲壳素是广泛分布于节肢动物外壳、菌类及藻类细胞中的1种类纤维素天然高分子物质。壳聚糖为甲壳素脱乙酰化处理后的产物,是1种碱性多糖,生物兼容性好,且具有生物降解,无毒等特性。壳寡糖是壳聚糖降解以后聚合度为2~10的产物,其水溶性好,容易被吸收利用,且生物活性比壳聚糖更强。甲壳素或壳聚糖提高水产动物免疫力和抗病力的功能已得到广泛的证实[6-12]。壳寡糖抗氧化[13-14]、调节免疫反应[15-18]、促进肠道菌群增殖[19]等作用虽然已被大量研究证实,然而,其在水产养殖中的应用研究却几乎没有。
大黄鱼属鲈形目,石首鱼科,黄鱼属,是我国重要的海水养殖鱼类。随着大黄鱼高密度集约化养殖的逐渐展开,大黄鱼的病害情况也日益严重,而鉴于传统药物对食品安全和环境的危害,开发高效安全的新型免疫增强剂成为当务之急。本实验的目的是通过生长实验探求枯草芽胞杆菌和壳寡糖对大黄鱼幼鱼非特定性免疫力的影响,为大黄鱼高效环保配合饲料的开发奠定基础。
1 材料与方法
1.1 实验饲料制作
以鱼粉(粗蛋白,69.7%;粗脂肪,7.1%)、豆粕(粗蛋白,53.3%;粗脂肪,1.9%)为蛋白源,鱼油、大豆油和卵磷脂为脂肪源,小麦粉为糖源,并添加维生素混合物(mg or g/kg diet:维生素B1,25 mg;核黄素,45 mg;维生素B6,20 mg;维生素B12,0.1 mg;维生素K3,10 mg;肌醇,800 mg;维生素B3,60 mg;烟酸,200 mg;叶酸,20 mg;生物素1.20 mg;维生素A,32 mg;维生素D3,5 mg;维生素E,120 mg;维生素C,2 000 mg;氯化胆碱,2 500 mg;乙氧基喹啉,150 mg;小麦粉,18.52 g)、无机盐混合物(mg or g/kg diet:氟化钠,2 mg;碘化钾,0.8 mg;1%氯化钴,50 mg;硫酸铜,10 mg;硫酸铁,80 mg;硫酸锌,50 mg;硫酸锰,60 mg;硫酸镁,1 200 m g;磷酸二氢钙,3 000 mg;氯化钠,100 mg;沸石粉,15.45 g)、诱食剂(甘氨酸+甜菜碱)、防霉剂(50%丙酸钙+50%富马酸)配制成基础饲料(见表1)。
采用2×3双因素设计,分别在基础饲料中添加0(B0)(对照)、0.1%(B1)和0.2%(B2)的芽孢杆菌制剂(主要成分枯草芽孢杆菌1×1010cfu/g,青岛玛斯特生物技术有限公司),每个芽孢杆菌水平添加0.0%(C0)(对照)、0.3%(C1)和0.6%(C2)的壳寡糖(脱乙酰度95%,分子量2000,纯度95.48%,中国海洋大学海洋生命学院),配制出9种等氮等能的实验饲料:C0B0,C0B1,C0B2,C1B0,C1B1,C1B2,C2B0,C2B1和C2B2。在饲料制作过程中,所有原料粉碎后过320μm筛网,各原料按配比定量后混合均匀,然后加入适量的水揉匀,经F(Ⅱ)-26型双螺杆挤条机(华南理工大学,广州)加工制成硬颗粒饲料(1.5 mm×2.0 mm,2.5 mm×3.0 mm),55℃烘干至饲料水分含量为10%左右,用塑料袋包装,保存于-15℃冰柜中备用。经测定枯草芽孢杆菌制粒损失率为2/3,则最终枯草芽孢杆菌的添加梯度为:0.0、0.5×107和1.0×107cfu/g。

表1 实验饲料配方及营养成分组成Table 1 Formulation and p roximate composition of the experimental diets(%dry matter)
1.2 实验鱼的来源、驯化与养殖管理
实验在浙江省宁波市象山县西沪港进行。大黄鱼选用象山海湾育苗场当年繁育的同一批鱼苗。在开始正式实验前,幼鱼放于海水大网箱(3.0 m×3.0 m×3.0 m)中暂养2周,并以实验基础饲料(Diet 1)饱食投喂,使之逐渐适应实验饲料和养殖环境。
实验开始时,实验鱼饥饿24 h,然后称质量,并挑选出规格一致(平均初始体质量为(7.82±0.68)g)的大黄鱼进行分组实验。实验在27个浮式海水网箱(1.0 m×1.0 m×1.5 m)中进行,放养密度为60尾/箱。每一网箱为一组,每种饲料随机投喂3组实验鱼。每天饱食投喂2次(05··00和17··00)。养殖周期70 d。每天记录投饲量,如有死鱼记录数量并称质量。实验期间海水水温为22.5~31.5℃,盐度为28~33,溶解氧含量在6 mg·L-1左右。
1.3 样品收集
70 d生长实验结束后,对实验鱼饥饿24 h,分别从每网箱抽取5尾鱼,以无菌注射器自尾静脉取血,室温沉降2 h,然后4℃沉降4~6 h,分离血清并保存于-70℃冰箱。
1.4 免疫学指标的测定
1.4.1 血清溶菌酶活力 血清中溶菌酶活力通过浊度比色法测定[20]。反应底物为用磷酸缓冲溶液(0.05 mol·L-1、p H=6.1)配制的0.2 m g·m L-1微壁溶球菌(Sigma)悬液。100μL血清与1 900μL菌悬液混合,在530 nm波长下,分别在0.5和4.5 min测定吸光值(OD)。活力单位定义为每分钟吸光值减少0.001所需的血清量。
1.4.2 血清替代途径补体活力 血清中替代途径补体活力参考Yano[21]的方法测定。将100μL兔血红细胞(RaRBc)悬液(每毫升缓冲溶液含有2×108个细胞)加到250μL用缓冲溶液系列稀释的鱼血清中。不断摇动,26℃反应90 min。反应结束时加入3.15mL冷的生理盐水,然后离心5 min(3 000 r/min)。血清的溶血程度通过用分光光度计在414 nm测定上清液的吸光值。活力单位定义为使RaRBC发生50%溶解的血清量。
1.4.3 血清SOD活力 血清SOD活性使用南京建成试剂盒测定。基本原理是:通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子(O-2),O-2氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见光分光光度计测其吸光值。当被测样品中含SOD时,则对超氧阴离子有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光值低于对照管的吸光值,通过测定O-2被抑制的多少来确定SOD值的大小。血清中SOD酶活力单位定义为:每毫升反应液中SOD抑制率达到50%时所对应的SOD量为1个SOD酶活单位(U)。
1.4.4 血清CA T活力 血清CA T活性使用南京建成试剂盒测定。基本原理是:过氧化氢酶分解H2O2的反应可以通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生1种淡黄色的络合物,在405 nm处测定其生成量,可计算出CA T的活力。每毫升血清每秒钟分解1μmol H2O2的量为1个活力单位(U)。
1.5 计算及统计方法
采用SPSS 11.5 for Window s对所得数据进行方差分析,若差异达到显著,则进行Tukey多重比较,显著性水平为P<0.05。
2 实验结果
2.1 饲料中添加枯草芽孢杆菌和壳寡糖对血清溶菌酶活力的影响(见表2)
在每1个枯草芽孢杆菌添加水平,饲料中添加壳寡糖显著提高了大黄鱼幼鱼的血清溶菌酶活力(P<0.05),而血清溶菌酶活力在添加壳寡糖的两处理间没有显著性差异(P>0.05)。在每个壳寡糖水平,饲料中枯草芽孢杆菌的添加提高了大黄鱼血清溶菌酶活力,但是血清溶菌酶活力在各枯草芽孢杆菌的添加水平差异不显著(P>0.05)。血清溶菌酶活力在添加0.6%壳寡糖+0.5×107cfu/g枯草芽孢杆菌的处理组达到最大值。枯草芽孢杆菌和壳寡糖对溶菌酶活力的影响没有显著的交互作用(P>0.05)。
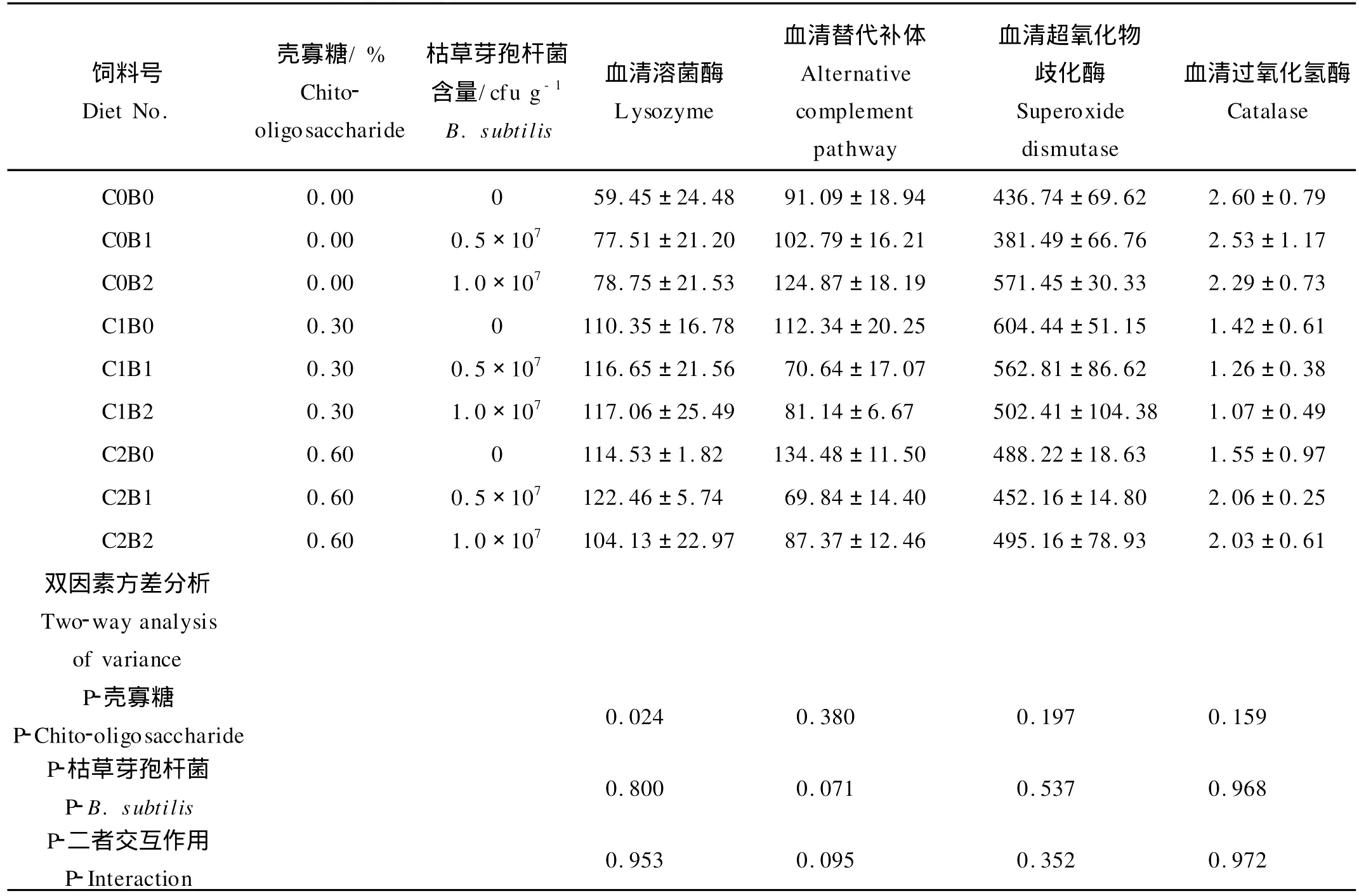
表2 饲料中添加枯草芽孢杆菌和壳寡糖对大黄鱼幼鱼血清免疫指标的影响Table 2 Effects of dietary supplementation with Bacillus subtilis and chito-oligosaccharide on serum immunological parameters of juvenile large yellow croaker(Pseudosciaena crocea)fed experimental diets for 70days(Means±S.E.M.)/m l-1
2.2 饲料中添加枯草芽孢杆菌和壳寡糖对血清替代途径补体活力的影响(见表2)
大黄鱼幼鱼的血清替代途径补体活力在各处理组间均没有显著性差异(P>0.05)。壳寡糖和枯草芽孢杆菌对血清替代途径补体活力的影响也没有显著的交互作用(P>0.05)。
2.3 饲料中添加枯草芽孢杆菌和壳寡糖对血清超氧化物歧化酶(SOD)的影响(见表2)
在每个枯草芽孢杆菌水平,饲料中添加壳寡糖提高了大黄鱼血清SOD活力,但是SOD活力在添加壳寡糖的处理组和未添加壳寡糖的处理组间没有显著性差异(P>0.05)。在每个壳寡糖水平,饲料中枯草芽孢杆菌的添加水平没有对大黄鱼血清SOD活力造成显著性影响。大黄鱼血清SOD值在添加0.3%壳寡糖+0枯草芽孢杆菌的处理组达到最大值。壳寡糖和枯草芽孢杆菌对血清SOD活力的影响没有显著的交互作用(P>0.05)。
2.4 饲料中添加枯草芽孢杆菌和壳寡糖对血清过氧化氢酶(CA T)的影响(见表2)
大黄鱼幼鱼的CA T活力在各处理组间均没有显著性差异(P>0.05)。壳寡糖和枯草芽孢杆菌对血清CA T活力的影响也没有显著的交互作用(P>0.05)。
3 讨论
3.1 枯草芽孢杆菌的益生作用
枯草芽抱杆菌在动物肠道内能大量消耗氧气,形成肠道厌氧环境,扶持和促进双岐杆菌、乳酸菌等有益菌的增殖,同时,枯草芽孢杆菌还具有刺激动物免疫系统提高免疫力等作用。枯草芽孢杆菌提高动物免疫机能的功能已经在金头鲷[22]、鲤[3,5]、罗非鱼[4]及甲壳动物[23-24]上进行的大量研究中得到证实。Kumar等[5]研究表明,饲料中添加1.5×107/g枯草芽孢杆菌能显著提高鲤的巨噬细胞呼吸爆发能力,促进非特异性免疫力的提高。A ly等[4]在罗非鱼的研究中也证实饲料中添加107/g枯草芽孢杆菌显著提高了罗非鱼血液嗜中性粒细胞黏附力及血浆溶菌酶活力。
然而,本实验结果却表明,饲料中添加枯草芽孢杆菌并未对大黄鱼幼鱼血清免疫指标产生显著性影响。分析其原因,枯草芽孢杆菌没有对大黄鱼免疫反应产生显著性影响可能是因为壳寡糖的添加不但没有对枯草芽孢杆菌的益生作用产生促进,反而对枯草芽孢杆菌发挥益生作用产生了抑制。因为壳寡(聚)糖具有广谱的抗菌活性,其分子中带有的游离氨基容极易结合氢离子而使壳寡(聚)糖分子带正电荷,它可以吸附在菌体表面形成1层高分子膜阻止营养物质向细菌细胞内的运输[25],或者吸附细菌表面带阴离子的物质或鞭毛荚膜等结构物质而干扰细菌的正常代谢,小分子量的壳寡糖分子甚至可以渗透进入到细菌体内吸附阴离子物质,干扰细胞代谢。
3.2 壳寡糖的益生作用
本实验中,饲料中壳寡糖的添加显著提高了大黄鱼血清溶菌酶水平,表明壳寡糖对海水鱼的非特异性免疫力具有一定的提高作用。目前,关于甲壳素或壳聚糖对水产动物免疫力的影响已经进行了大量的研究[7-12,26],证明甲壳素或壳聚糖能提高水产动物的呼吸爆发活性和溶菌酶活性,提高机体免疫力。Han等[16]也发现饲料中添加0.1%~0.3%的壳寡糖能促进猪淋巴细胞的增殖及抗体生成。同时,一些体外实验及浸泡实验同样证明了壳寡(聚)糖的免疫促进功能[6,8,15,27]。
本实验中,饲料中壳寡糖的添加未对大黄鱼血清的血清替代途径补体活力、超氧化物歧化酶活力及过氧化氢酶活力产生显著性影响,这可能是由于不同的免疫指标对同一种免疫刺激物质会产生不同的反应或产生反应的时间不同,也可能与实验用壳寡糖的聚合度、脱乙酰度、添加量及试验鱼的种类有关。
3.3 枯草芽孢杆菌与壳寡糖的交互作用
壳寡糖的益生元作用已经得到证明,Lee等[19]的实验证明,聚合度在2~8的壳寡糖可以有效促进双歧杆菌和乳酸菌的增殖。同时添加枯草芽孢杆菌和壳寡糖用于动物饲料的实验还未有过报道。华雪铭等[28]研究发现同时在饲料中添加壳聚糖和益生菌对暗纹东方魨的生长无显著影响。本实验中,也并未观察到枯草芽孢杆菌与壳寡糖的交互作用,其原因可能如上所述,壳寡糖具有抗菌活性,由于壳寡(聚)糖分子带正电荷,分子中带有的游离氨基可以与细胞表面带阴离子的物质或鞭毛荚膜等结构物质发生吸附,阻碍细菌正常代谢,或者结合氢离子在细菌表面形成1层高分子膜,阻止营养物质向细菌细胞内的运输,小分子的壳寡糖还可以通过渗透进入细胞内部与细胞内部带阴离子的物质发生吸附,干扰细菌细胞的正常代谢。所以,本实验饲料中壳寡糖的添加可能会极大地抑制枯草芽孢杆菌作用的发挥。No等[29]在研究不同分子量壳寡(聚)糖对豆腐产品中腐生细菌的抑制作用时也发现不同分子量的壳寡(聚)糖对豆腐产品腐生细菌中的一些芽孢杆菌产生了不同程度的抑制作用。而本实验中,饲料中添加的壳寡糖对枯草芽孢杆菌的抑制作用可能过于严重,以致毁灭性地大黄鱼幼鱼血清免疫指标的影响大黄鱼幼鱼血清免疫指标的影响。
[1] Rengpipat S,Phianphak W,Piyatiratitivorakul S,et al.Effects of a probiotic bacterium on black tiger shrimp Penaeus monodon survival and grow th[J].Aquaculture,1998,167:301-313.
[2] Vaseeharan B,Ramasamy P.Control of pathogenic Vibrio spp.by Bacillus subtilis BT23,a possible probiotic treatment for black tiger shrimp Penaeus monodon[J].Lett Appl Microbiol,2003,36:83-87.
[3] Nayak S K,Swain P,Mukherjee S C.Effect of dietary supplementation of probiotic and vitamin Con the immune response of Indian major carp,Labeorohita(Ham.)[J].Fish Shellfish Immunol,2007,23:892-896.
[4] Aly SM,Ahmed Y A,Ghareeb A A,et al.Studies on Bacillus subtilis and Lactobacillus acidophilus,as potential probiotics,on the immune response and resistance of Tilapia nilotica(Oreochrom is niloticus)to chalenge infections[J].Fish Shellfish Immunol,2008,25:128-136.
[5] Kumar R,Mukherjee SC,Ranjan R,et al.Enhanced innate immune parameters in Labeorohita(Ham.)following oral administration of Bacillussubtilis[J].Fish Shellfish Immunol,2008,24:168-172.
[6] Anderson D P,Siwicki A K.Duration of p rotection against Aeromonas salmonicida in brook trout immunostimulated with glucan or chitosan by injection or immersion[J].Pro Fish Cult,1994,56:258-261.
[7] Kolman H,Siwicki A K,Kolman R.The effect of natural immunodulators applied is immersion on non-specific immune responses in Russian sturgeon(Acipenser gueldenstadeti Brand t)[J].Arch RybPol,1998,6(2):391-410.
[8] Esteban M A,Mulero V,Cuesta A,et al.Effects of injecting chitin particles on the innate immune response of gilthead seabream(Sparus aurata L.)[J].Fish Shelf Immunol,2000,10:543-555.
[9] Esteban M A,Mulero V,Cuesta A,et al.Immunomodulatory effects of dietary intake of chitin on gilthead seabream(Sparus aurata L.)innate immune system[J].Fish Shellfish Immunol,2001,11:303-315.
[10] Wang S H,Chen JC.The protective effect of chitin and chitosan against Vibrio alginolyticus in white shrimp Litopenaeus vannamei[J].Fish Shellfish Immunol,2005,19:191-204.
[11] Gopalakannan A,A rul V.Immunomodulatory effects of dietary intake of chitin,chitosan and levamisoleon the immune system of Cyprinus carpio and control of Aeromonas hydrophila infection in ponds[J].Aquaculture,2006,255:179-187.
[12] Cha S H,Lee J S,Song CB,et al.Effects of chitosan-coated diet on improving water quality and innate immunity in the olive flounder,Paralichthys olivaceus[J].Aquaculture,2008,278(1-4):110-118.
[13] Sun T,Yao Q,Zhou D,et al.Antioxidant activity of N-carboxy methyl chitosan oligosaccharides[J].Bioorg Med Chem Lett,2008,18(21):5774-5776.
[14] Anraku M,Fujii T,Furutani N,et al.Antioxidant effects of a dietary supplement:Reduction of indices of oxidative stress in normal subjects by water-soluble chitosan[J].Food Chem Toxicol,2009,47(1):104-109.
[15] Wu G J,Tsai GJ.Chitooligosaccharides in combination with interferon-gamma increase nitric oxide production via nuclear factor-kappa Bactivation in murine RAW 264.7 macrophages[J].Food Chem Toxicol,2007,45(2):250-258.
[16] Han K N,Yang Y X,Hahn T W,et al.Effects of chito-oligosaccharides supplementation on performance,nutrient digestibility,pork quality and immune response in growing-finishing pigs[J].J Anim Feed Sci,2007,16:607-620.
[17] Li X J,Piao X S,Kim SW,et al.Effects of chito-oligosaccharide supplementation on performance,nutrient digestibility,and serum composition in broiler chickens[J].Poul Sci,2007,86:1107-1114.
[18] Chen Y J,Kim IH,Cho J H,et al.Effects of chitooligo saccharide supplementation on grow th performance,nutrient digestibility,blood characteristics and immune responses after lipopolysaccharide challenge in weanling pigs[J].Liv Sci,2009,124(1):255-260.
[19] Lee H W,Park Y S,Jung J S,et al.Chitosan oligosaccharides,dp 2-8,have p rebiotic effect on the Bifidobacterium bifidium and Lactobacillus sp[J].Anaerobe,2002,8(6):319-324.
[20] Ellis A E.Lysozyme assays[M].∥Techniques in Fish Immunology.Fair Haven,N J:SOS Publications,1990:101-103.
[21] Yano,T.Assays of Hemolytic Complement Activity.∥:Techniques in Fish Immunology[M].N J:SOS Publications,Fair Haven,1992,131-141.
[22] Salinas I,Cuesta A,Esteban M A,et al.Dietary administration of Lactobacillus delbrueckii and Bacillus subtilis,single or combined,on gilthead seabream cellular innate immune responses[J].Fish Shellfish Immunol,2005,19:67-77.
[23] 谢佳磊,肖丹,殷蝶,等.枯草芽孢杆菌对克氏原螯虾免疫机能的影响[J].淡水渔业,2007,37(6):24-28.
[24] 朱学芝,郑石轩,潘庆军,等.芽孢杆菌对凡纳滨对虾免疫和生化指标的影响[J].饲料研究,2007(4):56-59.
[25] Helander IM,Nurmiaho-Lassila E-L,Ahvenainen R,et al.Chitosan disrupts the barrier properties of the outer membrane of Gram-negative bacteria[J].Int J Food Microbiol,2001,71(2-3):35-244.
[26] Kono M,Matsui T,Shimizu C.Effects of chitin,chitosan and cellulose as diet supplements on the grow th of cultured fish[J].Nippon Suisan Gakkaishi,1987,53:125-129.
[27] Cuesta A,Esteban M A,Meseguer J.In vitro effect of chitin particles on the innate cellular immune system of gilthead seabream(Sparus aurata L.)[J].Fish Shellfish Immunol,2003,15:1-11.
[28] 华雪铭,周洪琪,张宇峰,等.饲料中添加壳聚糖和益生茵对暗纹东方纯幼鱼生长及部分消化酶活性的影响[J].水生生物学报,2007,29(3):299-305.
[29] No H K,Park N Y,Lee S H,et al.Antibacterial activities of chitosans and chitosan oligomers with different molecular weights on spoilage bacteria isolated from tofu[J].J Food Sci,2002,67(4):1511-1514.
