Aβ斑块显像剂:11C-PIB的合成及标记
2011-01-09张锦明王武尚张晓军田嘉禾
张锦明,王武尚,张晓军,郭 喆,田嘉禾
1.中国人民解放军总医院核医学科,北京 100853;
2.西北核技术研究所,陕西西安 710024
Aβ斑块显像剂:11C-PIB的合成及标记
张锦明1,王武尚2,张晓军1,郭 喆1,田嘉禾1
1.中国人民解放军总医院核医学科,北京 100853;
2.西北核技术研究所,陕西西安 710024
11C标记2-(4′-N-11C-甲胺基苯)-6-羟基苯并噻唑(6-OH-BTA-1)是目前较理想的Aβ斑块显像剂,本研究合成了6-OH-BTA-1的前体:6-羟基-2-(4′-氨基苯基)苯并噻唑,并用11C标记。在常温下,无需保护羟基条件下,标记效率为52.6%(校正,n=35),产品放射化学纯度大于99%,比活度为18.0 TBq/mmol。80℃加热2 min,有副反应发生。采用弱酸性流动相,半制备 HPLC分离后产品的放射化学纯度达99%。
Aβ斑块显像剂;阿尔茨海默病(AD);11C-PIB
阿尔茨海默病(Alzheimer’s,AD)病理学特征包括神经元丧失、神经元纤维缠结(NFT)、老年斑(Aβ斑块)和神经元内颗粒空泡变性。病理学检测Aβ斑块的染色剂有:刚果红(Congo red,CR)、硫磺素-T(thioflavin-T)、硫磺素-S、金黄胺G(chrysamine G,CG)和 X-34等,这些试剂在体外与Aβ有很高的亲和能力。如果用放射性核素标记上述试剂或类似物,并能有效突破血脑屏障(BBB)进入大脑,就可以采用 SPECT或PET技术,进行AD患者脑内老年斑分布及定量的在体、可视化检测,可以提高AD的早期诊断率和鉴别准确率,而且可以对AD病人分期、针对Aβ为靶点的治疗和药物的研究等提供有效的评价方法。文献报道了多种在体显示AD患者脑内 Aβ-淀粉样蛋白沉积显像剂,如18F标记的甲氧萘普酸(FDDNP)类[1]、123I标记 IMPY、11C标记的苯二烯[2-3]和18F-AV45[4]等。其中2-(4′-N-11C-甲胺基苯)-6-羟基苯并噻唑(N-11CH3-6-OH-BTA-1,习惯称11C-PIB)是一类较理想的Aβ显像剂,其脂溶性适中,lgP=1.2,与Aβ1-40聚集物有很高的亲和常数(Ki=4.3 nmol/L),在正常小鼠脑内清除很快,2 min/30 min脑摄取比达到12[5]。本工作拟在文献基础上合成前体6-OH-BTA-0,并研究不同制备和分离条件对11C-PIB标记率及放化纯度的影响。
1 试剂和仪器
2-氨基-6-甲氧基苯并噻唑、对硝基苯甲醛,纯度均大于98%,美国Alfa Aesar公司;柱层析硅胶,青岛海洋化工集团公司;1 mol/L LiAlH4/THF和 PIB标准品,德国 ABX公司;57%HI,美国Sigma公司;其它试剂均为国产分析纯。
Necolet-170SX傅立叶红外仪,美国Necolet公司;Avance 500 MHz核磁共振仪,美国Bruker公司;TrisGC2000质谱仪,美国 Finnigan公司;Perkin-Elmer 240-C型元素分析仪,美国 PE公司;XT4显微熔点测定仪,北京泰克仪器有限公司,温度未校正。Sumitomo HM-20S回旋加速器,日本驻友公司;C-11碘代甲烷合成器和多功能碳-氟一体机,北京派特生物技术有限公司;高效 HPLC分析仪,美国 Waters公司,配515泵、2487紫外检测器、BioScan流动放射性检测器。
2 实验方法
2.1 6-羟基-2-(4′-氨基苯基)苯并噻唑的合成
以2-氨基-6-甲氧基苯并噻唑为起始原料,根据文献[6-7]合成了中间体5-甲氧基-2-氨基苯硫酚。然后依照文献[8]合成6-甲氧基-2-(4′-硝基苯基)苯并噻唑,将硝基还原成氨基,得6-甲氧基-2-(4′-氨基苯基)苯并噻唑(6-MeO-BTA-0),再去甲基化后得到目标化合物。合成路线示于图1。

图1 6-OH-BTA-0的合成线路图及其11C标记Fig.1 Scheme for synthesis of 6-OH-BTA-0 and its11C-labeling to produce11C-PIB
2.1.1 5-甲氧基-2-氨基苯硫酚(1)的合成 反应瓶中加入2.7 g(15.0 mmol)2-氨基-6-甲氧基苯并噻唑、16.2 g KOH、32 mL水,加热回流12 h。反应液冷却至室温,加入15 mL水,过滤除去不溶物。搅拌下向滤液中加入36%乙酸至微酸性,置于冰箱冷却。抽滤,水洗沉淀(10 mL×3)。50℃下干燥,得黄色粗产物5-甲氧基-2-氨基苯硫酚1.7 g。
2.1.2 6-甲氧基-2-(4′-硝基苯基)苯并噻唑 (2)的合成 反应瓶中加入5-甲氧基-2-氨基苯硫酚1.7 g、对硝基苯甲醛1.7 g(11.2 mmol)和15 mL DMSO。搅拌,加热至近沸,反应1 h。冷却至室温,加入25 mL水,搅拌,抽滤,水洗沉淀(15 mL×3)。沉淀于110℃下干燥,乙酸乙酯重结晶1次 ,得黄色 6-甲氧基-2-(4′-硝基苯基)苯并噻唑2.0 g。
2.1.3 6-甲氧基-2-(4′-氨基苯基)苯并噻唑 (3)的合成 反应瓶中加入6-甲氧基-2-(4′-硝基苯基)苯并噻唑 2.0 g(7.1 mmol)、SnCl2·2H2O 4.0 g(17.7 mmol)和60 mL无水乙醇。搅拌下加热回流5 h。反应液冷却至室温,旋蒸除去无水乙醇,用200 mL乙酸乙酯溶解残余物,溶液转入分液漏斗中,用1 mol/L NaOH洗涤(150 mL×3),水洗至中性。旋蒸除去溶剂,用硅胶柱层析分离(V(正己烷)∶V(乙酸乙酯)=60∶40),得淡黄色6-MeO-BTA-0 1.5 g,总产率 40%,熔点 192~193℃。
2.1.4 6-羟基-2-(4′-氨基苯基)苯并噻唑(4)的合成 反应瓶中加入6-甲氧基-2-(4′-氨基苯基)苯并噻唑0.71 g和200 mL二氯甲烷,冰浴冷却,滴加28.4 mL 1 mol/L BBr3的二氯甲烷溶液,升温至室温,搅拌反应过夜,冰浴冷却,加入100 mL水,用1 mol/L NaOH中和,用200 mL乙酸乙酯分2次萃取,合并有机相,水洗(50 mL×3),无水硫酸钠干燥,旋蒸除去溶剂,用硅胶柱层析分离(V(正己烷)∶V(乙酸乙酯)=50∶50),得淡黄色6-OH-BTA-0 0.6 g,产率83%。
2.2 碳-11碘代甲烷的生产及三氟甲基磺酰基(Triflate)的在线转换
用Sumitomo HM-20S回旋加速器,40μA 20 MeV质子轰击含1%氧的天然氮气靶,通过14N(pα,)11C核反应生成11C-CO2。[11C]-CH3I由单管、液相法由碳-11碘代甲烷仪自动化合成[9],即生成的11C-CO2由液氮捕获后,由氮气以30 mL/min速率载带入0.2 mL 1 mol/L氢化锂铝/THF中,然后加热除 THF,加入0.2 mL 57%的氢碘酸,生成的11C-CH3I由氮气载带,通入Triflate转化炉,11C-CH3I在线转化成11C-CH3-Triflate[10]。
2.3 11C-PIB(5)的标记及纯化
1.0mg的6-OH-BTA-0前体,用0.2 mL丙酮溶解,安装于多功能碳-氟一体机。将上述制备的11C-CH3-Triflate通入该溶液,常温下反应。当碳-氟一体机上放射性计数达到最大、不再增加时,80℃加热2 min或不加热直接用2 mL 55%的乙腈溶液稀释后自动进入半制备的 HPLC纯化,流动相为φ=55%的乙腈水溶液,流速为6 mL/min,半制备柱为 GraceAlltimaC-18 HPLC柱(10 mm×250 mm),收集6~7 min时的放射性峰,再用60 mL水混和,混和液过 C-18柱,用10 mL水清洗该柱,最后用1.0 mL无水乙醇将产品从C-2柱上洗脱,加入9 mL水。
2.4 11C-PIB质量控制
采用 HPLC分析产品的放化纯度,分析柱为Grace Alltima C-18,5μm,3.9 mm ×150 mm,流动相为φ=50%MeCN水溶液,流速为1 mL/min。产品的保留时间为6.8 min。
将德国ABX公司的PIB标准品配成不同浓度,HPLC进相同体积样,测量6.8 min处的紫外吸收峰,以紫外吸收峰面积对 PIB浓度作图得标定直线,从相同体积样品在6.8 min处的紫外吸收峰面积计算样品中12C-PIB的浓度,再根据放射化学浓度,计算产品11C-PIB的比活度。
3 结果和讨论
(1)本研究所合成的前体是未保护羟基的6-OH-BTA-0,最终产品的红外光谱图:3 458.4、3 284.8、1 315.5、602.8、1 465.9、1 437.0 cm-1。1H NMR(500 MHz,acetone-d6,δ):7.796 48~7.813 73(d,J=8.63 Hz,3H),7.534 65~7.539 49(d,J=2.42 Hz,1H),7.061 85~7.084 52(m,1H),6.781 63~6.798 67(d,J=8.52 Hz,2H),3.889 71(s,3H),2.975 42(s,2H)。MS(EI)m/z:256.07(M+),257.07(M++1)。元素分析的计算值 C、65.60%,H、4.719%,N、10.93%;实验值 C、65.72%,H、4.885%,N、10.97%。
合成化合物1时,由于中和强碱,生成了大量的乙酸钠,需在第二步中用大量水洗的方法除去。同时化合物1不稳定,合成当天将之转化成产品2。产品3还原后,溶液中含有的乙醇对乙酸乙酯的萃取不利,使乙酸乙酯与水成混合相,因此必须采用蒸发法将之除去,以保证乙酸乙酯萃取成功。
(2)在常温、中性条件下、无需保护羟基,11CCH3-Triflate很容易与前体发生反应,标记效率为52.6%(校正,n=35),而且100%是在苯胺上C—N甲基化(图2(a)),半制备 HPLC的放射性曲线表明,tR=2.5 min处为未反应的放射性,5.8 min处为标记物,收集该峰,经固相萃取得到最终产品。
前体中通入11C-CH3-Triflate,并在80℃加热2min。从图2(b)可以发现,加热后的标记率没有上升,同时发现在约11.3 min处多了一个峰,收集该峰,HPLC分析表明该峰为6-11C-甲氧基-2-(4′-氨基苯基)苯并噻唑(标准物为合成物质3),即在6位羟基上发生了C—O甲基化,该比例约占10%左右。

图2 半制备 HPLC分离的放射性曲线Fig.2 Radioactivity profiles of semiprep HPLC with different reaction temperature
11C-PIB的标记方法很多,一种方法是采用11C-CH3I,在碱性条件下标记,但此时的前体6位羟基需保护,以防止生成甲氧基(6-MeO-BTA-0);然后再脱保护;该方法标记时间长,步骤多,标记率低[11]。其后采用 6-OH-BTA-0作前体,采用11C-CH3-Triflate在无保护条件下甲基化,标记的方法有LOOP法、反应管法(溶剂分别是甲乙酮和丙酮)[11-13],LOOP法无需加热,反应管法采用80℃加热1 min方法,标记效率最高到44%,未观察到副反应的发生[14]。但本研究进一步研究发现,加热时间短(1 min内),基本观察不到副反应,但延长加热时间后明显有副反应。
(3)半制备 HPLC采用流动相为φ=55%乙腈水溶液-φ=0.2%冰乙酸,最终产品 HPLC分析表明,产品放射化学纯度大于99%,比活度为18.0 TBq/mmol(图3(a))。但半制备 HPLC流动相为φ=55%乙腈水溶液,最终产品的放射化学纯度在95%~98%(图3(b)),能明显观察到2个小的杂质峰。可见不同p H的半制备 HPLC流动相,最终产品的放射化学纯度有一定区别,弱酸性的流动相有助于将杂质除去。因为反相C-18柱的分离条件与p H关系很大,弱酸性的流动相提高了半制备反相C-18柱的分离能力。
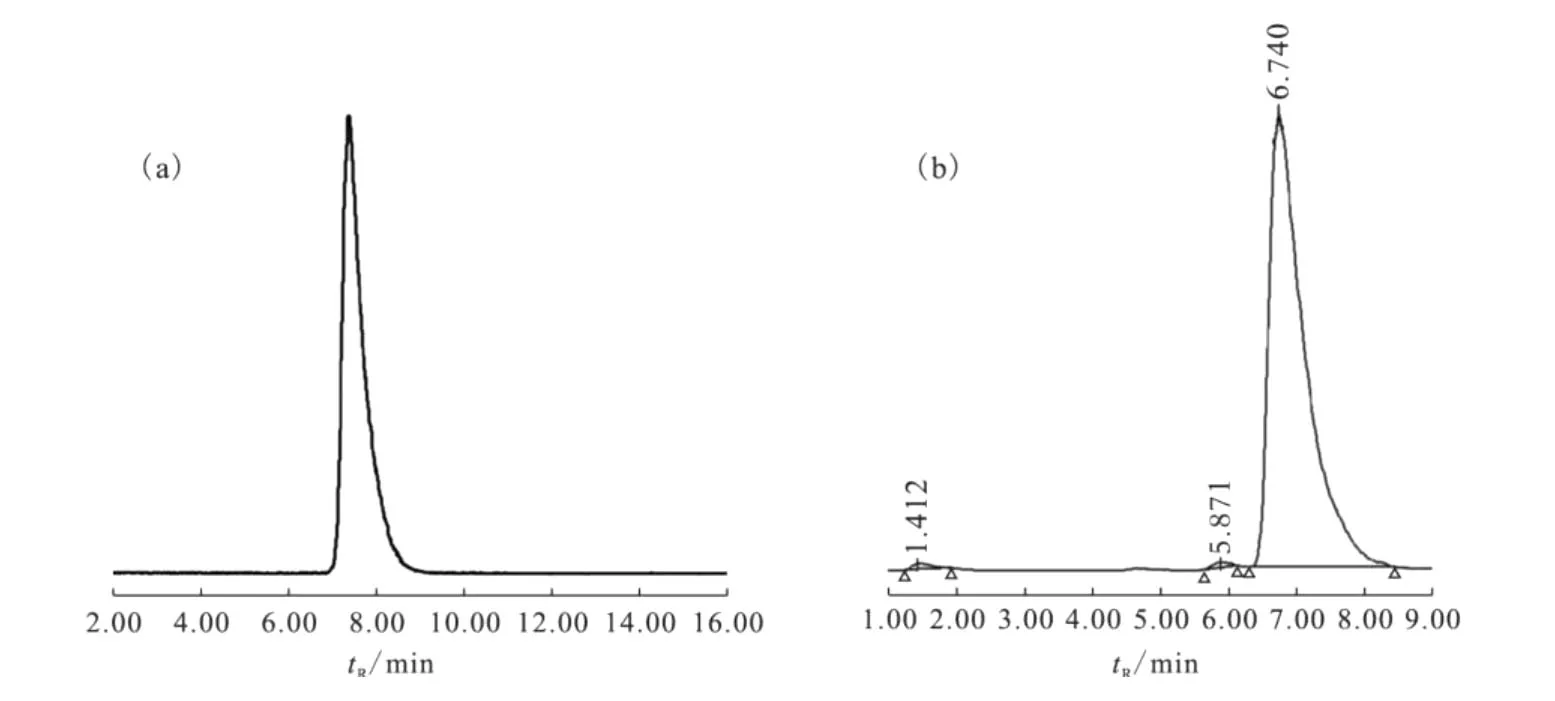
图3 产品11C-PIB的 HPLC质控图Fig.3 Analytical HPLC profiles of11C-PIB after semiprep HPLC
文献上半制备 HPLC的流动相变化不大,主要是乙腈与水的混合液;为调节pH,有采用0.1 mol/L碳酸氢铵[11,14],也有采用 0.2%三乙胺乙酸盐[13],这些流动相制备的产品放射化学纯度在95%~98%[11-13],有时甚至低于95%,为不合格产品。采用弱酸性半制备流动相,则明显将杂质除去,提高了产品的放射化学纯度。
4 结 论
11C-PIB是较理想的 Aβ斑块显像剂,适于AD患者的诊断与疗效评价。本研究合成了未保护羟基的前体:6-羟基-2-(4′-氨基苯基)苯并噻唑,并用11C-CH3-Triflate在常温中性条件下标记,标记效率为52.6%(校正,n=35),比活度为18.0 TBq/mmol。采用弱酸性半制备流动相,产品的放射化学纯度大于99%。
[1]Barrio J R,Satyamurthy N,Huang S C,et al.Dissecting Molecular Mechanism in the Living Brain of Dementia Patients[J].ACC Chem Res,2009,42:842-850.
[2]Kung M P,Zhuang Z P,Hou C,et al.Development and Evaluation of Iodinated Tracers Targeting Amyloid Plaques for SPECT[J].J Mol Neurosci,2004,24:49-53.
[3]Ono M,Wilson A,Nobrega J,et al.11C-Labeled Stilbene Derivatives as Aβ-Aggregate-Specific PET Imaging Agents for Alzheimer’s Disease[J].Nucl Med Biol,2003,30:565-571.
[4]Choi S K,Golding G,Zhuang Z P,et al.Preclinical Properties of18F-AV-45:A PET Agent for Aβ Plaques in the Brain[J].J Nucl Med,2009,50:1 887-1 894.
[5]Mathis C A,Klunk W E,Price J C,et al.Imaging Technology for Neurodegenerative Disease:Progress Toward Detection of Specific Pathologies[J].Arch Neurol,2005,62:196-200.
[6]Mital R L,Jain S K.Synthesis of Some 5-Substituted 2-Aminobenzenethiols and Their Conversion Into Phenothiazines via Smiles Rearrangement[J].J Chem Soc(C),1969:2 148-2 150.
[7]Lin A J,Kasina S.Synthesis of 3-Substituted 7-(3,3-Dimethyl-1-Triazeno)-10-Methyl-Phenothiazines as Potential Antitumor Agents[J].J Heterocyclic Chem,1981,18:759-761.
[8]Zhuang Z-P,Kung M-P,Hou C,et al.Radioiodinated Styrylbenzenes and Thioflavins as Probes for Amyloid Aggregates[J].J Med Chem,2001,44:1 905-1 914.
[9]张锦明,田嘉禾,王武尚,等.单管法自动化合成11C-碘代甲烷[J].中华核医学杂志,2004:243-244.
[10]张锦明,田嘉禾,王武尚,等.在线制备11C-Triflate-CH3[J].同位素,2006,19:124-128.
[11]Wilson A A,Garcia A,Chestakova A,et al.A Rapid One-Step Radiosynthesis of the b-Amyloid ImagingradiotracerN-Methyl-[11C]-2-(4′-Methyl Aminophenyl)-6-Hydroxy Benzothiazole([11C]-6-OH-BTA-1)[J].J Labeled Compd Radiopharm,2004,47:679-682.
[12]Cheung M K,Ho C L.A Simple,Versatile,Low-Cost and Remotely Operated Apparatus for[11C]Acetate,[11C]Choline,[11C]Methionine and[11C]PIB Synthesis[J].Appl Radiat Isot,2009,67:581-589.
[13]Solbach C,Uebele M,Rcischl G,et al.Efficient Radiosynthesis of Carbon-11 Labelled Uncharged Thioflavin T Derivativesusing[11C]Methyl Triflate forβ-Amyloid Imaging in Alzheimer’s Disease With PET[J].Appl Radiat Isot,2005,62:591-595.
[14]张锦明,郭 喆,田嘉禾,等.Aβ斑块显像剂:2-(4′-N-11C-甲基胺苯)-6-羟基苯并噻唑的研究[J].中华核医学杂志,2008,28:397-400.
Synthesis and Carbon Labeling of11C-PIB for Aβ-Amyloid Imaging
ZHAN GJin-ming1,WANG Wu-shang2,ZHANG Xiao-jun1,GUO Zhe1,TIAN Jia-he1
1.Department of Nuclear Medicine,The PLA General Hospital,Beijing 100853,China;
2.Northwest Institute of Nuclear Technology,Xi’an 710024,China
Assessing the deposition of Aβ-amyloid in the living brain is important for diagnosis and treatment ofAlzheimer’s disease(AD).2-(4′-N-11C-methyl-aminophenyl)-6-hydroxybenzothiazole(11C-PIB)was used as a ideal labeled probe imaging Aβ-amyloid for AD.The precursor of11C-PIB,2-(4′-aminophenyl)-6-hydroxybenzothiazole,was synthesized.11C-PIB was labeled with11C-CH3-Triflate(Trifluoromethanesulfonate)under unprotect 6-hydroxyl precursor at room temperature.The labeling yield,radiochemistry purity and specific activity are 52.6%(corrected,n=35),99%and 18.0 TBq/mmoL respectively.The by-reaction occurrs when the reaction is heated 80℃for 2 min.The radiochemistry purity can be improved to 99%by semi-HPLC weak acid mobile phase.
Aβ-amyloid imaging agent;AD;11C-PIB
R817.4
A
0253-9950(2011)03-0188-05
2010-06-04;
2010-12-07
国家自然科学基金资助项目(30670586);核能开发科技资助项目(2009-1228)
张锦明(1965—),男,江苏南通人,博士,研究员,核医学专业
