荧光假单胞菌RB5产嗜铁素的发酵条件
2011-01-09伊艳杰周广舟李瑞芳陈晓娣
伊艳杰,周广舟,时 玉,李瑞芳,陈晓娣
(河南工业大学 生物工程学院,河南 郑州 450001)
荧光假单胞菌RB5产嗜铁素的发酵条件
伊艳杰,周广舟,时 玉,李瑞芳,陈晓娣
(河南工业大学 生物工程学院,河南 郑州 450001)
荧光假单胞菌RB5是从土壤中分离得到的一株对禾谷丝核菌有拮抗作用的细菌.通过CAS法检测分析,发现RB5菌株能产生嗜铁素.为明确荧光假单胞菌RB5产嗜铁素的发酵条件,采用摇瓶培养发酵,利用特异光谱吸收法,研究了不同培养条件对RB5菌株嗜铁素产量的影响.最终得出RB5产嗜铁素的最佳发酵条件:起始pH 7.0,接种量2%,瓶装量90 mL/250 mL,发酵时间48 h,Fe3+质量浓度为0.8 mg/L.抑菌试验表明,优化发酵条件后的RB5发酵液(OD400值2.35)有很显著的抑菌效果,抑制率达65.28%.
荧光假单胞菌;嗜铁素;发酵条件;抑菌效果
0 前言
荧光假单胞菌(Pseudomonas fluorescens)广泛存在于土壤中,是植物根际的优势细菌种群,此类细菌的多数株系具有拮抗或促生作用[1].研究表明,荧光假单胞菌可产生嗜铁素(siderophore)等多种有抗菌作用的次生代谢产物[2].嗜铁素,又名铁载体,是一类由微生物在低铁条件下合成的小相对分子质量的、能特异地螯合Fe3+的一种螯合因子[3].目前,嗜铁素已被逐渐应用到植物病原菌的防治中.大量研究结果认为,嗜铁素主要是通过对铁离子的竞争影响病原菌的生长.荧光假单胞菌产生的嗜铁素络合根周围铁离子,使病菌得不到足够的铁营养,生长发育受到抑制,对植物体的危害减轻,因而植物生长发育得到改善.在小麦全蚀病、亚麻枯萎病的生物防治中,都是通过这一机制起作用[4].Ran等[5]通过平板拮抗活性测定表明,假单胞杆菌分泌的嗜铁素是控制桉树灰霉病的重要因子[5].因此,嗜铁素被认为是一种有开发和利用价值的新型生物活性物质.
探索嗜铁素产生的最佳发酵条件,将有利于提高生防菌的效价,提高防效.此外,还可为嗜铁素的进一步分离、纯化及理化性质的研究奠定基础,同时也为其后续的开发应用提供技术支持[6].梁建根等[6]采用摇瓶发酵法,通过CAS检测分析,对影响恶臭假单胞菌株HZ-2嗜铁素分泌的几种发酵因子进行了研究.余贤美等[7]研究了不同培养条件对枯草芽孢杆菌Bs-15嗜铁素产量的影响,得出了可获得较高产量嗜铁素的最佳发酵条件.王伟等[8]在摇瓶发酵条件下,研究了荧光假单胞菌SE-6在各种培养条件下的铁载体分泌量,确定了适合铁载体分泌的最佳培养条件:起始pH 6.5,装瓶量20mL/500mL,接种量2%,最佳培养时间为46 h左右,Fe3+质量浓度为0.8mg/L.在此条件下,铁载体在发酵液中含量最高,为大规模的发酵提供了有价值的数据.基于前人的研究,本试验选取影响发酵条件的几个主要因素进行研究,首次将不同处理得出的最佳发酵影响因素综合起来进行发酵,探讨嗜铁素的产量和荧光假单胞菌抑菌活性的关系.
本试验所用的荧光假单胞菌RB5是作者从土壤中分离得到的,对小麦纹枯病的致病菌——禾谷丝核菌(Rhizoctonia cerealis)及其他多种植物病原菌均有较强的抑制作用.开展对荧光假单胞菌RB5产嗜铁素发酵条件的研究,将为该细菌的进一步利用和微生物杀菌剂的开发奠定理论基础.
1 材料与方法
1.1 菌种
产嗜铁素细菌:荧光假单胞菌RB5(本实验室分离保存菌种).
小麦纹枯病菌:禾谷丝核菌(本实验室保存菌种).
1.2 试剂和仪器
铬天青(CAS):天津市瑞金特化学品有限公司;8-羟基喹啉:天津市科密欧化学试剂开发中心;UV—1100型紫外可见分光光度计:重庆奥特光学仪器;THZ—321恒温振荡摇床:上海精宏实验设备有限公司;DHP—9082电热恒温培养箱:上海圣欣科学仪器有限公司.
1.3 培养基
1.3.1 CAS检测培养基
1 mmol/L CAS,4 mmol/L HDTMA,0.1 mmol/L FeCl3,0.1 mol/L磷酸盐缓冲液,pH6.8.
1.3.2 液体种子培养基(1 L)
Kings'B培养基:甘油15mL,蛋白胨20 g,K2HPO40.3 g,MgSO4·7H2O 1.5 g,pH7.0.
1.3.3 固体种子培养基(1 L)
在Kings'B培养基基础上加20 g琼脂.
1.3.4 发酵标准培养基(1 L)
甘油1.5 g,水解酪蛋白1.0 g,硫酸镁2.5 g,磷酸氢二钾2.5 g,8-羟基喹啉,pH 7.0.
1.3.5 PDA培养基(1 L)
马铃薯(去皮)200 g,葡萄糖 15 g,琼脂 15 g,自然pH.
上述培养基均在121℃灭菌20 min,备用.
1.4 培养方法
1.4.1 嗜铁素检测
采用Schwyn等[9]的研究方法,并结合赵翔等[10]改进的方法进行嗜铁素检测.将荧光假单胞菌RB5接种在铬天青(CAS)蓝色平板上,28℃培养2 d,观察菌落周围颜色变化.
1.4.2 RB5菌株的种子培养
将荧光假单胞菌RB5在Kings'B平板上28℃活化24 h.活化后,用接种环挑取单菌落,接入5mL液体培养基中,28℃,150 r/min的摇床中培养24 h.再接种到固体种子培养基中,在28℃下培养24 h.将培养好的一级种子用接种环挑取一环,接入50mL(250 mL摇瓶)液体培养基中,28℃,150 r/min的摇床中培养24 h,获得二级种子.
1.4.3 RB5产嗜铁素的发酵条件优化
发酵培养基先用1 g 8-羟基喹啉处理除去痕量铁,参考王伟等[8]的方法,分别改变以下发酵影响条件.
1.4.3.1 起始pH
将除铁后的发酵培养基的起始pH分别设6.0、6.5、7.0、8.0、9.0共 5个处理.按 2%的接种量将二级种子接于50 mL(250 mL摇瓶)发酵培养基中,置于温度为28℃,转速为180 r/min的摇床中培养.每个处理设3个重复,取平均值.
1.4.3.2 接种量
接种量设 0.5%、1.0%、1.5%、2.0%、3.0%5个处理.其他培养条件和检测方法同1.4.3.1.
1.4.3.3 装瓶量
装瓶量设 30 mL/250 mL、50 mL/250mL、70 mL/250mL、90mL/250mL、120mL/250mL 5个处理.培养条件和检测方法同1.4.3.1.
1.4.3.4 发酵时间
发酵时间设 6 h、12 h、24 h、36 h、48 h、60 h共6个处理.其他培养条件和检测方法同1.4.3.1.
1.4.3.5 Fe3+
在除铁后的发酵培养基中加入适量的FeCl3,使铁离子质量浓度分别为 0.0 mg/L、0.4 mg/L、0.8 mg/L、1.0mg/L、1.2mg/L、1.6mg/L.其他培养条件和检测方法同1.4.3.1.
1.4.4 嗜铁素含量的测定
多项研究表明,400 nm处的光吸收值可以作为检测荧光假单胞菌嗜铁素产量的方法,并且嗜铁素的量与吸光值大小成正比[11-12].因此,本试验以OD400的大小来衡量嗜铁素的产量.将发酵液于4 000 r/min离心15 min,取上清液,用紫外分光光度计法在400 nm处检测嗜铁素含量.吸光度越大,表明嗜铁素含量越高.
1.4.5 发酵液对禾谷丝核菌的抑制试验
将以上不同处理得出的最佳发酵影响因素综合起来再进行发酵,发酵液离心后取上清液,利用菌丝生长速率抑制法[12]测定发酵液对禾谷丝核菌的抑制能力.以不加发酵液的培养基为对照,25℃下培养5~7 d后,当对照组培养基的菌落直径为培养皿直径的80%时,用十字交叉法测量菌饼直径.菌饼扩展直径(mm)为菌饼的平均直径(mm)与接种菌饼直径(6 mm)之差,用下述公式计算抑制率:
抑制率=(对照组菌饼扩展直径-处理组菌饼扩展直径)/对照组菌饼扩展直径.
1.4.6 统计分析
运用DPS软件对测定数据进行处理与分析,方差分析采用Duncan新复极差法检测.
2 结果与分析
2.1 嗜铁素的检测
CAS蓝色平板含有铬天青、铁离子和溴化十六碳烷基三甲铵(HTDMA)组成的复合物而呈蓝色,当蓝色检测平板中的铁离子被微生物分泌的铁载体夺走时,即可在微生物生长的菌落周围形成橘黄色晕圈[7].荧光假单胞菌RB5在铬天青(CAS)蓝色平板上培养48 h后,与对照大肠杆菌(E.coli)相比,菌落周围形成橘黄色的晕圈.由此可以确定菌株RB5能够产生与铁离子有高亲和力的物质——嗜铁素.
2.2 起始pH对嗜铁素产量的影响
起始pH直接影响荧光假单胞菌的菌体生长,进而影响到嗜铁素的分泌量.将发酵培养基分别调到不同的起始pH值进行发酵,由图1可以看出,随着pH值增大,OD400先上升后下降,当起始pH为7.0的时候,嗜铁素的产量最高.表明过酸或过碱的pH环境均不利于嗜铁素的分泌.用DPS软件进行单因素方差分析,并用Duncan极差法进行检测,pH为7.0时与其他pH条件下的嗜铁素产量呈显著差异(P<0.05).

图1 起始pH对嗜铁素产量的影响
2.3 接种量对嗜铁素产量的影响
接种量的大小影响发酵的产量和发酵周期.接种量小的时候,延迟期变长,发酵时间延长;接种量变大时,菌体迅速生长,通风条件恶化,从而降低发酵单位.5个不同接种量处理对嗜铁素产量的影响见图2,可以看出以2%接种量为最佳.统计分析显示,P=0.000 1<0.01,组间差异极显著,说明接种量对嗜铁素含量有极大的影响.

图2 接种量对嗜铁素产量的影响
2.4 装瓶量对嗜铁素产量的影响
装瓶量的多少关系到发酵时的通气量,通气量是影响微生物菌体生长和代谢物生成的重要因素[13].在250mL的三角瓶中分别装30mL、50mL、70 mL、90mL、120mL的发酵液进行试验,结果如图3所示,在瓶装量为90 mL时,嗜铁素的产量最多,并且与其他瓶装量处理后的嗜铁素含量呈显著性差异(P<0.05).

图3 装液量对嗜铁素产量的影响
2.5 发酵时间对嗜铁素产量的影响
对发酵时间做不同的6个处理,由图4可看出,随着时间的延长,400 nm处的吸光值一直上升,在48 h达到最大值,之后慢慢下降,表明嗜铁素的分泌在48 h最多,说明48 h即为最佳的发酵时间.统计分析显示,发酵时间为48 h与发酵时间为36 h的嗜铁素含量相比,差异不显著(P>0.05);同发酵时间为 6 h、12 h、24 h、60 h的嗜铁素含量相比,差异显著(P<0.05).

图 4 发酵时间对嗜铁素产量的影响
2.6 Fe3+对嗜铁素产量的影响
嗜铁素的含量受Fe3+的影响,Fe3+的含量越多,合成越少,反之则越多,但Fe3+过少时,细胞生长受抑制,嗜铁素的合成反而减少.如图5所示,当Fe3+的质量浓度为0.8 mg/L时,嗜铁素的含量最高.统计分析显示,在P=0.05的水平上,Fe3+质量浓度为0.8mg/L与Fe3+质量浓度为1.2mg/L、1.6mg/L时的嗜铁素含量差异不显著,与Fe3+质量浓度为0.0 mg/L、0.4 mg/L时的嗜铁素含量相比,差异显著(P<0.05).

图5 Fe3+质量浓度对嗜铁素产量的影响
2.7 RB5发酵液对禾谷丝核菌生长的影响
荧光假单胞菌RB5发酵液(OD400值2.35)对禾谷丝核菌的生长影响见图6.与对照相比,禾谷丝核菌菌饼在含有发酵液的培养基中生长6 d后,受到了明显抑制.发酵液对病原菌的抑菌活性高达65.28%,表明嗜铁素产量的提高能够有效抑制禾谷丝核菌的生长.
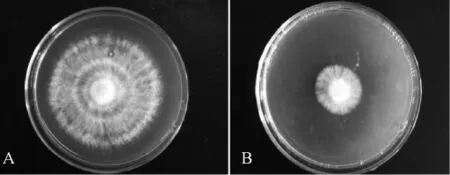
图6 发酵液对禾谷丝核菌生长的影响
3 结论
通过CAS法定性检测分析,发现荧光假单胞菌RB5在培养基中分泌争夺铁离子的代谢物,使菌落周围蓝色退去,形成橘黄色的晕圈.表明RB5确能产生嗜铁素.菌体的良好生长需要培养基各组分浓度和比例合适,碳源和氮源对菌体的生长或蛋白的表达影响较大,浓度太低会造成营养缺乏,限制菌体正常生长,进而影响代谢产物的产量[14].试验中所采用的发酵培养基是实验室经过优化培养条件后的培养基,菌体生长好、抑菌活性强,故本试验中未安排培养基、碳源和氮源等因素的优化.研究了起始pH、接种量、瓶装量、发酵时间、Fe3+质量浓度对嗜铁素产量的影响,结果表明:pH7.0最适合于RB5分泌嗜铁素,处于荧光假单胞菌的最适生长pH值范围;2%的接种量对嗜铁素产生有利;最佳装瓶量为90 mL/250 mL,与王伟等[8]的研究结果稍有差别,可能是因为所用发酵培养基不同而致.48 h为嗜铁素产量最多的发酵时间,本实验室前期研究结果显示,荧光假单胞菌在这个时期的发酵液抗菌活性最强;0.8 mg/L的Fe3+能够使RB5嗜铁素产量最多,与王伟等[8]的研究结果相同.本研究得出的荧光假单胞菌RB5产嗜铁素的最佳发酵条件可为嗜铁素的分离纯化及其工业化生产提供理论依据,使其能更广泛地应用于微生物生物防治、医药等领域.
[1]李爱荣,安德荣.两株生防荧光假单胞杆菌的室内筛选试验[J].微生物学杂志,2003,23(4):11-13.
[2]Corbell N,Loper J E.A global regulator of secondarymetabolite production in Pseudomonas fluorescens Pf-5[J].The Journal of Bacteriology,1995,177(21):6230-6236.
[3]Shelly M P.Detection,isolation and characterization of siderophores[J].Methods in Enzymology,1994,235:329-344.
[4]杨合同,王少杰.荧光假单胞菌与植物病害生物防治[J].山东科学,1993,6(3):50-56.
[5]Ran L X,Xiang M L,Zhou B,et al.Siderophores are the main determinants of Fluorescent Pseudomonas strains in suppression of grey mould in eucalyptus urophylla[J].Acta Phytopathologica Sinica,2005,35(1):6-12.
[6]梁建根,施跃峰,竺利红,等.恶臭假单胞菌株HZ-2产嗜铁素的发酵条件研究[J].浙江农业学报,2008,20(4):266-269.
[7]余贤美,周广芳,辛力.枯草芽孢杆菌Bs-15产嗜铁素条件及其对甜椒的防病促生效应[J].农药学学报,2010,12(2):135-141.
[8]王伟,彭珺,张琳,等.荧光假单胞菌SE-6产铁载体的发酵条件[J].上海师范大学学报,2006,35(22):67-70.
[9]Schwyn B.,Neilands J B.Universal chemical assay for the determination of siderophores[J].Analytical Biochemistry,1987,160:47-56.
[10]赵翔,陈绍兴,沈萍,等.高产铁载体荧光假单胞菌的筛选鉴定及其铁载体特性研究[J].微生物学报,2006,46(5):691-695.
[11]Mannien M,Mattila-Sandbolm T.Methods for detection of Pseudomonas siderophores[J].Journal of Microbiol Methods,1994,19:223-224.
[12]王平,李慧,邱译萱,等.荧光假单胞菌株P13分泌铁载体抑制油菜茵核病菌[J].上海师范大学学报,2010,39(2):200-203.
[13]孙冬梅,林志伟.黄绿木霉发酵液对水稻纹枯病菌作用的研究[J].植物保护,2009,35(4):83-86.
[14]Lau J,Tran C,Licari P,et al.Development of a high cell density fedback bioprocess for the heterologous production of 6-deoxyery thronolide B in E.col[iJ].Journal of Biotechnology,2004,110:95-103.
FERMENTATION CONDITIONSOF SIDEROPHORE PRODUCED BY PSEUDOMONAS FLUORESCENS RB5
YIYan-jie,ZHOU Guang-zhou,SHIYu,LIRui-fang,CHEN Xiao-di
(School of Bioengineering, Henan University of Technology, Zhengzhou 450001,China)
Pseudomonas fluorescens RB5 antagonistic to Rhizoctonia cerealis was isolated from the soil.Through CAS detection,we found that strain RB5 could secrete siderophores.In order to study the optimum fermentation conditions of siderophore produced by Pseudomonas fluorescens RB5,we studied the influence of different culture conditions on the yield of siderophore from strain RB5 by using shaking flask fermentation and 400-nm specific spectral absorption assay.The results showed that the optimum culture conditions of siderophore were as follows:initial pH 7.0,inoculation amount 2%,culture time 48 hours,medium bottling amount 90 m L/250 m L,Fe3+mass concentration 0.8 mg/L.The inhibition experiment indicated that strain RB5 fermentation broth (OD4002.35)had a strong inhibition effect on Rhizoctonia cerealis and the inhibition rate was up to 65.28%.
Pseudomonas fluorescens; siderophore; fermentation conditions; inhibition effect
TQ920.1
B
CNKI:41-1378/N.20111220.1501.007
1673-2383(2011)06-0032-04
http://www.cnki.net/kcms/detail/41.1378.N.20111220.1501.007.html
网络出版时间:2011-12-20 03:01:44PM
2011-07-05
河南省教育厅自然科学基金(2010A210003);河南工业大学高层次人才科研基金(2010BS016)
伊艳杰(1978-),女,河南许昌人,副教授,博士,研究方向为微生物防治.
