半夏生物碱对人肝癌细胞Bel-7402增殖的影响
2011-01-09王晓昆广州军区武汉总医院医学实验科武汉市430070
陈 芳,杨 李,王晓昆,张 宜(广州军区武汉总医院医学实验科,武汉市 430070)
半夏为天南星科植物半夏Pinellia ternata(Thunb.)Breit.的干燥块茎,具有燥湿化痰、降逆止呕、消痞散结之功效。临床上可单独或与其他药物配伍用于治疗食管癌、肝癌等。近年来研究半夏对肝癌的保护作用发现,其作用主要是通过杀伤癌细胞、抑制细胞生长、诱导细胞凋亡、调节机体免疫功能来实现的[1,2]。半夏生物碱是半夏的主要有效成分之一,为进一步考察半夏生物碱抗肝癌的药理活性,笔者对半夏生物碱影响人肝癌细胞株Bel-7402增殖的作用与机制进行了初步研究。
1 仪器与材料
1.1 仪器
CK2-TR型倒置显微镜、BX-51型荧光显微镜(日本Olympus公司);RT2100C型酶标仪(美国Rayto公司);CA-1800型超净工作台(上海上净净化设备有限公司);5420型CO2培养箱(日本三洋公司)。
1.2 试药
半夏生物碱粉末(广州军区武汉总医院医学实验科);MTT(美国Amersco公司);胰蛋白酶、RPMI1640培养基(美国Gibco公司);胎牛血清(杭州四季青生物工程有限公司);细胞凋亡原位检测(TUNEL)试剂盒、免疫组化SABC试剂盒、B细胞淋巴瘤/白血病(Bcl-2)兔免疫球蛋白G(IgG)多抗、Bcl-2相关X蛋白(Bax)兔IgG单抗均购自武汉博士德生物工程有限公司。
1.3 细胞
人肝癌细胞系Bel-7402由武汉大学中国典型培养物保藏中心提供,以RPMI1640培养液于CO2培养箱中培养。
2 方法
2.1 溶液的制备与细胞的培养
将40 mg半夏生物碱粉末溶于含10%胎牛血清的1640培养基10 mL中,得终浓度为4 mg·mL-1的半夏生物碱贮备液,过滤后依次用细胞培养基稀释为400、200、100µg·mL-1的应用液,现配现用。MTT以PBS配成5 g·mL-1的浓度,经抽滤后分装入无菌微量离心管(EP规格:1 mL)中,封口,-20℃贮藏。胰蛋白酶以PBS配成0.25%的浓度,经抽滤后分装入无菌微量离心管(EP规格:1 mL)中,封口,-20℃贮藏。
将Bel-7402接种于含100 u·mL-1青霉素、100 u·mL-1链霉素和10%胎牛血清的RPMI1640培养基液中,细胞浓度为2×104个/mL,置于5%CO2、37℃的培养箱中培养。细胞换液时间为2~3 d,3~5 d传代,0.25%胰蛋白酶消化后以1∶2传代。
2.2 细胞增殖测定
试验分为5组,即空白对照、阴性对照和半夏生物碱高、中、低浓度组。采用MTT法,参考文献[3]方法略加改进。取对数生长期细胞用胰蛋白酶消化,将Bel-7402细胞以1×105个/mL浓度接种于96孔板,每孔100µL,24 h后更换培养液,半夏生物碱高、中、低浓度组分别加入400、200、100 µg·mL-1的半夏生物碱提取液,阴性对照组在细胞上加培养液,空白对照组只加培养液。每组设4个复孔,将培养板置37℃、5%CO2、饱和湿度下培养24 h后,每孔加入5 mg·mL-1MTT 25µL,继续孵育4 h形成甲结晶,小心吸弃上清液,加入二甲基亚砜(DMSO)125µL/孔,微量震荡器震荡5 min后,在酶联免疫检测仪上于490 nm波长处测定吸光度(OD)值,按下列公式计算细胞生长抑制率(重复3次):抑制率(%)=(阴性对照组OD值-用药组OD值)(/阴性对照组OD值-空白对照组OD值)。
2.3 TUNEL技术检测细胞凋亡
试验分为4组,即阴性对照和半夏生物碱高、中、低浓度组。24孔培养板每孔置入一块无菌玻片。取对数生长期Bel-7402细胞消化制备细胞悬液,调整细胞浓度为1×105个/mL,接种于24孔板内,1 mL/孔。置培养箱24 h后,半夏生物碱高、中、低浓度组加入半夏生物碱,终浓度分别为400、200、100µg·mL-1,阴性对照组在细胞上加培养液。以上各组均平行6孔,继续培养48 h后,取出爬满细胞的玻片,PBS漂洗2遍,经4%多聚甲醛固定30 min,PBS洗涤后自然风干,-20℃贮藏。
取上述细胞爬片,以渗透液(0.1%TritonX-100+0.1%枸橼酸钠)浸润于冰上,反应2 min后滴加50µL新鲜配置的TUNEL混合反应液(含45µL TdT反应缓冲液、5µL荧光素标记的dUTP),37℃水浴共孵60 min。以上各步骤间均以PBS(pH7.4)冲洗3次。中性树胶封片。对照试验:以50µL标记液代替TUNEL混合反应液作阴性对照;阳性对照玻片经DNaseI缓冲液预处理10 min后,按TUNEL染色步骤进行。
荧光显微镜下在450~500 nm波长范围激发荧光,以细胞核内出现较强荧光者计为TUNEL阳性细胞。每张玻片随机观察10个高倍视野(400×),计数阳性细胞占全部癌细胞的比例作为凋亡率(%)。
2.4 SABC染色法检测Bcl-2和Bax蛋白表达
试验分为5组,即阴性对照、阳性对照和半夏生物碱高、中、低浓度组。半夏生物碱高、中、低浓度组加入半夏生物碱,终浓度分别为400、200、100 µg·mL-1。取“2.3”项下细胞爬片作下列处理:(1)纯丙酮室温固定15 min,蒸馏水冲洗2次;(2)纯甲醇加H2O2至0.5%,室温浸泡30 min以灭活内源性过氧化物酶,蒸馏水冲洗3次;(3)滴加正常山羊血清封闭液,室温20 min后甩去多余液体;(4)分别滴加Bax单抗与Bcl-2多抗,37℃保持40 min;(5)滴加生物素化羊抗鼠IgG,37℃保持20 min,以0.1 mol·L-1PBS洗2 min×3次;(6)滴加SABC,37 ℃保持20 min,以0.1 mol·L-1PBS洗5 min×4次;(7)DAB显色,蒸馏水洗涤;(8)苏木素轻度复染,酒精脱水,二甲苯透明,中性树胶封片。以PBS代替Bax单抗和Bcl-2多抗作阴性对照;用已知乳腺癌阳性切片作为阳性对照。
结果判断以胞浆和(或)胞膜被染成棕褐色判为Bcl-2和Bax阳性细胞。显微镜下每张切片随机选5个高倍视野(400×),不少于500个肿瘤细胞,计数阳性细胞占全部肿瘤细胞的比例作为Bcl-2和Bax阳性细胞率。
2.5 统计学方法
试验数据以x±s 表示,采用方差分析,利用统计软件SPSS 15.0分析。P<0.05为差异有统计学意义。
3 结果
3.1 半夏生物碱对Bel-7402细胞增殖的影响
作用24 h后,高、中、低浓度半夏生物碱(400、200、100 µg·mL-1)对Bel-7402细胞增殖均有显著抑制作用,其抑制作用随药物浓度增高而有加强趋势,最高抑制率可达36.98%,且呈量效关系。半夏生物碱对Bel-7402细胞增殖的影响见表1(空白对照组略去)。
3.2 半夏生物碱对Bel-7402细胞凋亡的影响
荧光显微镜下,凋亡细胞核呈较强荧光,部分细胞核破裂,呈大小不等、形态不规则的碎片,或呈梅花状细胞核。半夏生物碱高、中、低浓度组均能有效诱导Bel-7402细胞凋亡,且呈显著的量效关系。半夏生物碱对Bel-7402细胞凋亡的影响见表2。
表1 半夏生物碱对Bel-7402细胞增殖的影响(±s)Tab 1 Effects of alkaloids of P.ternata on Bel-7402 cell proliferatio(n±s)

表1 半夏生物碱对Bel-7402细胞增殖的影响(±s)Tab 1 Effects of alkaloids of P.ternata on Bel-7402 cell proliferatio(n±s)
与阴性对照组比较:*P<0.05,**P<0.01vs.negative control group:*P<0.05,**P<0.01
组别阴性对照组半夏生物碱高浓度组半夏生物碱中浓度组半夏生物碱低浓度组-36.98 15.20 12.97-400 200 100 4 4 4 4 0.78±0.02 0.49±0.07**0.66±0.04*0.68±0.05*细胞增殖抑制率/%浓度/μg·mL-1n OD值
表2 半夏生物碱对Bel-7402细胞凋亡的影响(±s)Tab 2 Effects of alkaloids of P.ternata on apoptosis rate of Bel-7402 ce(ll±s)
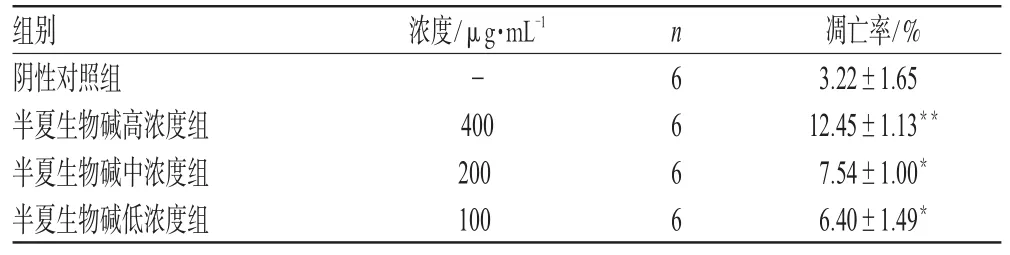
表2 半夏生物碱对Bel-7402细胞凋亡的影响(±s)Tab 2 Effects of alkaloids of P.ternata on apoptosis rate of Bel-7402 ce(ll±s)
与阴性对照组比较:*P<0.05,**P<0.01vs.negative control group:*P<0.05,**P<0.01
组别阴性对照组半夏生物碱高浓度组半夏生物碱中浓度组半夏生物碱低浓度组凋亡率/%3.22±1.65 12.45±1.13**7.54±1.00*6.40±1.49*浓度/μg·mL-1-400 200 100 n 6 6 6 6
3.3 半夏生物碱对Bax、Bcl-2表达的影响
Bcl-2、Bax蛋白主要定位于细胞浆,亦可见于胞膜,染色阳性信号呈棕褐色。半夏生物碱高、中、低浓度组Bcl-2、Bax表达显色与阴性对照组比较,有显著性差异(P<0.01或P<0.05)。半夏生物碱对Bax、Bcl-2表达的影响见表3(阳性对照组略去)。
表3 半夏生物碱对Bax、Bcl-2表达的影响(±s)Tab 3 Effect of alkaloids of P.ternata on Bax and Bcl-2 protein expression(±s)
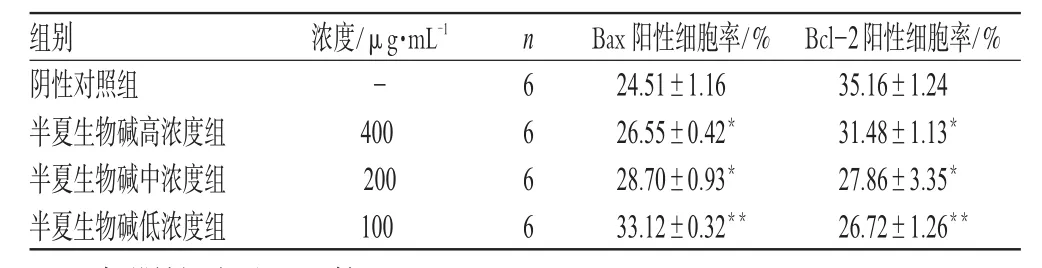
表3 半夏生物碱对Bax、Bcl-2表达的影响(±s)Tab 3 Effect of alkaloids of P.ternata on Bax and Bcl-2 protein expression(±s)
与阴性对照组比较:*P<0.05,**P<0.01vs.negative control group:*P<0.05,**P<0.01
组别阴性对照组半夏生物碱高浓度组半夏生物碱中浓度组半夏生物碱低浓度组35.16±1.24 31.48±1.13*27.86±3.35*26.72±1.26**-400 200 100 6 6 6 6 24.51±1.16 26.55±0.42*28.70±0.93*33.12±0.32**Bcl-2阳性细胞率/%浓度/μg·mL-1n Bax阳性细胞率/%
4 讨论
肝癌的发病率较高,其治疗仍是临床亟待解决的问题。从植物中筛选有效的活性物质治疗肝癌是目前中药发展方向之一。近年来,相关研究表明半夏具有确切的抗癌作用,对食道癌、胃癌、上颌癌、舌癌、皮肤癌、恶性淋巴癌有一定疗效[4,5]。体外培养肿瘤细胞试验也表明,半夏提取物对动物试验性肿瘤S180、宫颈癌-14、肝癌、子宫颈癌Hela细胞、JTC-26细胞等体外试验均具有一定抑制作用[6,7]。本文中,笔者通过MTT法、TUNEL技术和SABC方法来进一步研究半夏生物碱对肝癌细胞Bel-7402的抑制作用。
文献报道,半夏提取物对肝癌细胞、直肠癌细胞等生长具有抑制作用[8]。本研究发现400、200、100 µg·mL-1浓度的半夏生物碱对Bel-7402有明显的抑制作用,抑制率与阴性对照组比较有显著性差异,且随着半夏生物碱浓度的增加,抑制作用逐渐增强;TUNEL染色法发现半夏生物碱高、中、低浓度组均能有效诱导Bel-7402细胞凋亡,呈显著的量效关系,提示半夏生物碱对Bel-7402的抑制作用是通过诱导细胞发生凋亡这一途径产生的。
细胞凋亡是受多种基因调控的主动过程,其中Bax和Bcl-2发挥了重要作用[9]。Bcl-2与Bax位于线粒体、核膜和内质网膜,两基因有40%的同源性。Bcl-2是哺乳动物细胞凋亡最重要的调控基因之一,在细胞凋亡过程中处于调控机制的终末部分,对维持细胞生理性分化发育和细胞数量的动态平衡,以及在肿瘤发生、发展和治疗中发挥重要作用。目前发现Bcl-2基因家族中至少15个成员,促凋亡成员包括促凋亡基因Bax、Bcl-xs、Bad、Bak、Bik、Bid等,抗凋亡成员包括抗凋亡基因Bcl-2、Bcl-xl、Bcl-w、Al、MCL-l等。Bax 、Bcl-2可彼此形成异源二聚体或与自身形成同源二聚体,其抑制或促进凋亡主要取决于两者的比例[10,11]。近年来研究提示,调节细胞凋亡不仅取决于自身的表达高低,而且还与Bcl-2/Bax的比值有关。Bcl-2/Bax是影响细胞凋亡的关键,其比值增加则抑制细胞凋亡,反之则促进细胞凋亡[12]。本研究结果表明,400、200、100µg·mL-1浓度的半夏生物碱对肝癌细胞Bel-7402的Bax、Bcl-2表达显色与阴性对照组比较,Bcl-2表达下降而Bax表达升高,其Bax、Bcl-2基因表达水平有显著性的差异,提示半夏生物碱诱导Bel-7402细胞凋亡作用可能是通过调控凋亡基因Bax、Bcl-2表达来实现的,但关于其中更深入的作用机制尚需进一步研究。
[1] 陈 坚.中药治疗肝癌的试验研究进展[J].中西医结合肝病杂志,2000,10(3):55.
[2] 崔映宇,谢 衡,王金发.马尾松树皮提取物对外诱导人肝癌细胞凋亡的一过性检测分析[J].中国组织化学与细胞化学杂志,2005,14(1):80.
[3] 王树庆,王 彬.As2O3对人胃癌细胞SGC-7901抑制作用研究[J].中国药房,2010,21(1):26.
[4] 钱伯文.抗癌中药的临床效用[M].上海:上海翻译出版公司,1987:10.
[5] 常敏毅.抗癌本草[M].长沙:湖南科学技术出版社,1987:105.
[6] 毛子成,彭正松.半夏研究进展[J].江西科学,2002,20(1):42.
[7] 杨今祥.抗癌中草药制剂[M].北京:人民卫生出版社,1991:88.
[8] 郑国灿.半夏提取液的抗肿瘤性研究[J].四川中医,2004,22(9):9.
[9] Steller H.Mechanisms and genes of celluar suicide[J].Science,1995,267(5 203):1 445.
[10]Vaux DL,Cory S,Admas JM.Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells[J].Nature,1988,335(6 192):440.
[11] Reed JC.Bcl-2 and the regulation of programmed cell death[J].J Cell Biol,1994,124(2):1.
[12] Huang Q,Bu S,Yu Y,et al.Diazoxide prevents diabetes through inhibiting pancreatic beta cells from apoptosis via Bcl-2/Baxrate and p38-beta mitogen-activated protein kinase[J].Endocrinology,2007,148(1):81.
