关于苏教版“化学反应速率”几个问题的思考
2011-01-08田长明
田长明
(苏州市吴中区教育局教研室 江苏 苏州 215128)
关于苏教版“化学反应速率”几个问题的思考
田长明
(苏州市吴中区教育局教研室 江苏 苏州 215128)
新教材在使用的过程中不断地修改与完善,教师在使用教材的过程中也在不断反思与提高,苏教版“化学反应速率”一节有几个问题值得思考。
速率;固态;测量;浓度
“我思,故我在!”思考是人生前行的力量,教师是新课程的实施者,思考应该成为一种习惯。新教材的使用已经有相当长的一段时间了,在使用的过程中进行着不断地修改和完善。教师同新教材一同成长,对教材中某些知识与内容的认识也在不断地加深与提高,对有些问题也有了自己的看法,笔者就对苏教版“化学反应速率”一节内容的几个问题进行了一些思考。
一、概念的界定
问题1:⑴化学反应速率的表示方法是否只有一种?
⑵为什么通常用单位时间内反应物浓度(物质的量浓度)的减小或生成物浓度的增加来表示化学反应速率?
化学反应速率的表示方法是否只有一种?笔者查阅了人教版和鲁科版的《化学反应原理》(选修),它们对化学反应概念的描述如下:
人教版:化学反应速率用单位时间内反应物或生成物的物质的量的变化来表示。在容积不变的反应器中,通常用单位内反应物浓度的减少或生成物浓度的增加来表示。对于化学反应来说,当体系为气态或溶液时,可用单位时间内反应物或生成物的浓度(常用物质的量浓度)变化来表示这个反应的速率。
鲁科版:对于反应体系体积不变的化学反应aA+bB=dD+eE,可以用单位时间内某反应物浓度(或质量、物质的量等)的减少或某生成物浓度(或质量、物质的量等)的增加来表示化学反应速率。
通过对三种版本的比较,我们可以看出化学反应速率的表示方法不止一种,可以用单位时间内某反应物浓度(或质量、物质的量等)的减少或某生成物浓度(或质量、物质的量等)的增加来表示,那我们为什么通常用单位时间内反应物浓度(物质的量浓度)的减小或生成物浓度的增加来表示化学反应速率呢?笔者在网上看到众说纷纭,但归根结蒂只有两种:
说法1:因为物质的量浓度的变化能引起平衡移动,所以就用物质的量浓度表示 。
说法2:很多反应在溶液中进行,在混合体系中的测物质的物质的量浓度更容易。
笔者比较认同说法2,由于反应都在一定的容器或一定体积的溶液中进行,反应物或生成物的减少或增加可以通过容器或溶液中物质浓度的减少、增加来表示,而用物理或化学的方法测反应物或生成物物质的量浓度显得更容易些。
二、知识的延伸
问题2:固态物质有无化学反应速率,如果有该如何表示?
固态物质有无化学反应速率?有以下4种观点:
观点1:没有。因为它没有物质量浓度。
观点2:可以。但它只能用单位时间内物质的量改变量表示,无法用浓度改变来表示。
观点3:因为接触面积的问题,所以很难计算准确的反应速度。
观点4:在一定温度下,固体和纯液体物质单位体积里的物质的量保持不变,即物质的量浓度为常数,因此它们的化学反应速率也被视为常数,所以不能用它们表示速率。
事实上固体物质在反应中肯定有化学反应速率,因为固体或纯液体在反应过程中因无浓度变化,所以无法用单位时间内浓度的变化这种表示方法来表示化学反应速率,但可以用单位时间内物质的量或质量的减少来衡量反应速率。
三、方法的细化
问题3:反应过程中反应物或生成物浓度测定的常用方法究竟有哪些?
苏教版中对化学反应速率的测定只做了这样简单的叙述:“要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质(反应物或生成物)的相关性质,在进行适当的转换和计算。”然后例举了量气法和比色的方法。
要测定不同反应时刻反应物或生成物浓度的方法究竟有哪些?据南京大学物理化学教研室编写的《物理化学》(第四版)中有关测定反应物(或生成物)在不同反应时刻的浓度的方法可知:有化学方法和物理方法。
化学方法:在某一时刻取出一部分物质,并设法迅速使反应停止(用骤冷、冲稀、加阻化剂、或除去催化剂等方法),然后进行化学分析,这样可直接得到不同时刻某物质浓度的数值,但实验操作则往往较繁。
物理方法:在反应过程中对某一种物质与物质浓度有关的物理量进行连续监测,获得一些原位反应的数据,通常利用的物理性质和方法有测定压力、体积、旋光度、折射率、吸收光谱、电导、电动势、介电常数、粘度、导热率或进行比色等,对于不同的反应可选用不同的方法和仪器,如色谱、质谱、色—质联用、红外及磁共振谱等。由于物理方法不是直接测量浓度的,所以首先需要知道浓度与这些物理量之间的依赖关系,当然最好选用与浓度呈线性关系的一些物理量。
在鲁科版《化学反应原理》(选修)第56页的“拓展视野”中介绍了几种具体测量化学反应速率的物理方法,除了量气法外还有:
⑴比色法:由于物质对特定波长的光的吸收性能不同,因此可以通过吸光度来测定参与反应的某一物质的浓度。例如,在丙酮的溴化反应过程中:CH3COCH3+Br2→CH3COCH2Br+HBr,有色反应物Br2吸收波长为450nm的光波,因此可用分光光度计测量溶液对该波长光度的吸光度,据此计算化学反应速率。
⑵电导法:根据离子导电能力的差异,通过导电率的变化测定反应物中离子浓度变化,进而计算化学反应速率。例如,在乙酸乙酯皂化反应中:CH3COOC2H5+OH-→CH3COO-+C2H5OH。由于OH-离子的电导远大于CH3COO-的电导,可以利用电导仪测量出溶液电导的变化,据此求得OH-的浓度的变化,进而求得化学反应速率。
另外对于一些反应时间很短(在秒以下)的快速反应,必须采用某些特殊的装置才能进行测量,否则在反应物尚未完全混合之前,以混合的部分反应已经开始甚至可能已经完成或接近尾声,这给准确记录时间带来了困难或根本无法计算反应时间,对这种快速反应常采用快速流动法进行测量,在流动法中反应物迅速混合并在长管式反应器的一端以一定速度输入,产物在反应器的另一端流出,用物理方法测定反应管不同位置上反应物的浓度,也可获得绘制浓度随时间变化曲线的必要数据。
四、问题的质疑
问题4:增大反应物浓度,化学反应速率一定能加快吗?
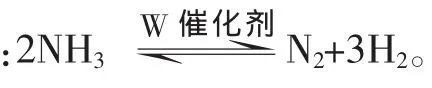
因此,实际教学中我们教师要做到从“教教材”转向“用教材教”。具体说就是让自己的教学设计和教学行为基于教材但又不为教材所束缚,使教学源于教材但又高于教材,使教材成为教学活动的真正“跳板”,成为学生学习和创新活动的有力凭借。 这就要求我们教师一是要先解读教材,获取自己所需要的资源,这是“用”的基础;另一是要将教材中所获的“资源”经过适度转化,整合并优化于教学活动之中,这是“用”的灵魂。
[1]傅献彩等.物理化学[M].北京:高等教育出版社,1990
1008-0546(2011)07-0058-02
G632.41
B
10.3969/j.issn.1008-0546.2011.07.027
