乳品中肠球菌LAMP快速检测方法的建立及应用
2011-01-08姜侃张东雷金燕飞陈小珍
姜侃,张东雷,金燕飞,陈小珍
(浙江省质量技术监督检测研究院,杭州 310013)
乳品中肠球菌LAMP快速检测方法的建立及应用
姜侃,张东雷,金燕飞,陈小珍
(浙江省质量技术监督检测研究院,杭州 310013)
应用环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP),针对肠球菌16sRNA中高度保守的序列分析设计特异性引物,建立乳品中肠球菌特异性快速检测方法。结果表明,所设计的引物具有良好特异性,10株肠球菌均能扩增出特异性片段,而14株非肠球菌均未扩增出相应片段,无假阴性或假阳性情况出现。同时,该方法可在14 h内完成检测,且阳性LAMP反应所需目标菌DNA浓度仅为10 fg/μL。应用本方法对164份婴幼儿配方乳粉的检测结果显示,共在37个批次中检出肠球菌,检出率为22.6%,污染量在0.36~110 g-1(最近似值)间。该方法为肠球菌的快速检测提供了一种重要的技术手段。
肠球菌;LAMP;快速检测;乳品
0 引言
肠球菌(Enterococcus)属链球菌科,是人类和动物肠道的正常菌群,既往认为其对人类无害,但近年研究和临床病例已证实了肠球菌的致病性。肠球菌可引起食物中毒,常见中毒食品有乳及乳制品、肉制品等。目前肠球菌的检测主要以传统平板分离鉴定方法为主,检测周期较长。目前,一种新颖的环介导等温扩增技术(Loop–MediatedIsothermalAmplification, LAMP)已逐步应用于致病菌、病毒、转基因食品等的检测[1-3]。该技术利用4种不同的特异性引物识别靶DNA上6个特定区域,并利用一种具有链置换活性的DNA聚合酶(BstDNA),在恒温条件下快速、高效、特异地扩增核酸[4]。本研究针对肠球菌16sRNA中高度保守序列分析设计特异性引物设计引物组,建立了肠球菌LAMP快速检测方法,并应用至乳品检测。
1 实验
1.1 菌株
粪肠球菌(Enterococcus faecalis),菌种号CICC 10396和CICC 23536;屎肠球菌(Enterococcus faecium),菌种号CICC 10396和EF-1;耐久肠球菌(Enterococcus durans),菌种号CICC 22577;盲肠肠球菌(Enterococcus cecorum),菌种号CICC 21607;海氏肠球菌(Enterococcus hirae),菌种号CICC 21606;鸟肠球菌(Enterococcus avium),菌种号ATCC 49462;酪黄肠球菌(Enterococcus casselifavus),菌种号ATCC 49604;鸡肠球菌(Enterococcus gallinarum),菌种号ATCC 49608;产气荚膜梭菌(Clostridium perfringens),菌种号ATCC 13124;金黄色葡萄球菌(Staphylococcus aureus),菌种号ATCC 6538;鼠伤寒沙门氏菌(Salmonella typhimurium),菌种号CMCC 50115;福氏志贺氏菌(Shigella flexneri),菌种号ATCC 12022;痢疾志贺氏菌(Shigella dysenteriae),菌种号ATCC 51252;宋内志贺氏菌(Shigella sonnei),菌种号ATCC 25931;单增李斯特菌(Listeria monocytogenes),菌种号ATCC 19114;英诺克李斯特菌(Listeria innocua),菌种号ATCC 33090;副溶血弧菌(Vibrio parahaemolyticus),菌种号VP-1;溶血性链球菌(Streptococcus hemolyticus),菌种号CMCC 32210;铜绿假单胞菌(Pseudomonas aeruginosa),菌种号ATCC 15442;大肠埃希氏菌(Escherichia coli),菌种号ATCC 25922;蜡样芽孢杆菌(Bacillus cereus),菌种号BC-1;阪崎肠杆菌(Enterobacter sakazakii),菌种号ATCC 51329。
1.2 试剂与仪器
细菌基因组DNA抽提试剂盒,BstDNA聚合酶,10×Buffer,MgCl2、dNTP,甜菜碱,SYBR GreenⅠ,DNA Marker DL2000,Premix Ex Taq PCR预混液,琼脂糖,电泳仪,自动凝胶电泳成像系统,PCR仪,恒温水浴器。
1.3 引物
肠球菌引物设计以GenBank HQ259726.1为基础,并参考GenBank AB470333.1、GenBank FJ845008.1、GenBankHQ293088.1、GenBankGU904689.1、Gen-BankFJ844983.1、GenbankNR_037082.1、GenBank HM446253.1等16sRNA基因序列,具体引物序列如表1所示。表1中,引物序列均经BLAST验证。所有引物均由Invitrogen公司合成。将各引物配制成浓度为50 μmol/L的溶液,备用。

表1 肠球菌LAMP检测引物组
1.4 菌种纯化
肠球菌接种于肠球菌肉汤,36℃培养24 h;产气荚膜梭菌接种疱肉肉汤培养基,36℃厌氧培养24 h;溶血性链球菌和单增李斯特菌接种于脑心浸液肉汤,副溶血弧菌接种于3%氯化钠缓冲蛋白胨水培养液,其余菌种接种于营养肉汤,36℃培养24 h。培养液提取细菌DNA。
1.5 细菌DNA提取
细菌DNA提取采用细菌组DNA抽提试剂盒,操作步骤严格按照说明书。
1.6 LAMP反应
LAMP反应体系为25 μL,组分如表2所示。将反应液置于恒温水浴锅中,61℃反应60 min。

表2 LAMP反应体系组成
1.7 PCR方法的建立
PCR引物采用CPa-F3和CPa-B3,反应体系如表3所示。目的片段长度为205 bp。反应条件:95℃(5 min),95℃(30 s),55℃(30 s),72℃(30 s),30个循环,72℃(5 min),4℃保存。

表3 PCR反应体系组成
1.8 LAMP特异性验证
应用10株肠球菌和14株非肠球菌,提取其基因组DNA进行LAMP检测,分别应用电泳(琼脂糖凝胶电泳,电泳条件为0.5×TBE、2.0%琼脂糖凝胶、150 V电压条件下电泳30 min)、离心(6 000 r/min以上离心5 min)或加荧光显色剂(加入SYBR GreenⅠ)后观察扩增结果,验证该方法检测肠球菌的种属特异性。
1.9 LAMP和PCR方法的灵敏度比较
以粪肠球菌标准菌株CICC 10396为参考菌株,对本文中LAMP检测方法和PCR检测方法分别进行灵敏度测定,并对二者灵敏度进行比较。具体操作步骤为:将肠球菌标准菌株DNA提取液进行10倍梯度稀释,使DNA质量浓度约为10 ng/μL,1 ng/μL,100 pg/μL,10 pg/μL,1 pg/μL,100 fg/μL,10 fg/μL,1 fg/μL,0.1 fg/μL;应用以上DNA模板分别进行LAMP检测和PCR检测,电泳观察结果,判断并比较二者的检测灵敏度。
1.10 模拟样品的比对试验
1.10.1 模拟样品的制备
食品基质分别采用液体乳和乳粉。将粪肠球菌标准菌株CICC 10396接种于肠球菌肉汤培养液,36℃培养24 h。肠球菌培养液均匀混合于液体和固体模拟样品,使样品中的污染量达到103mL-1,作为模拟阳性样品。另将金黄色葡萄球菌、沙门氏菌和志贺氏菌培养液均匀混合于其它样品中,作为模拟阴性样品。
1.10.2 模拟样品的检测
将模拟样品分别以两种方法检测。第一种方法中,将25 g模拟样品加入225 mL肠球菌肉汤培养液中,36℃培养12 h后,应用试剂盒提取培养液中细菌DNA,采用LAMP方法进行检测;第二种方法中,将模拟样品按照行业标准[5]的方法进行定性检测,并对两组组检测结果进行比对。
1.11 真实样品的定性和定量检测
1.11.1 定性检测
应用LAMP方法,对164批次婴幼儿配方乳粉进行肠球菌检测,具体检测方法为:将25 g样品加入225 mL肠球菌肉汤培养液中,36℃培养12 h后,应用试剂盒提取培养液中细菌DNA,采用LAMP方法进行检测。同时将这164批次样品按照行业标准[5]的方法进行定性检测,并对二者检测结果进行比较。
1.11.2 定量检测
对1.11.1中检出肠球菌的样品,采用最近似值测定法进行定量检测。样品的前处理及接种按照行业标准进行,选择的培养液为肠球菌肉汤。对于36℃培养24 h后呈黑色的培养管,提取培养液中细菌DNA,采用LAMP方法进行确证,并参考行业标准附录B给出最近似值。
2 结果
2.1 LAMP扩增
用该方法对10株肠球菌基因组DNA进行LAMP扩增。扩增产物电泳检测结果如图1所示,10株肠球菌均有明亮阶梯状目的条带;扩增产物离心结果如图2所示,肠球菌扩增产物均呈现明显沉淀;扩增产物荧光显色结果如图3所示,肠球菌扩增产物均呈现强荧光。同时,检测结果显示,14株非肠球菌菌株DNA均未扩增出相应产物,说明本方法具良好特异性。

图1 肠球菌及非肠球菌LAMP反应产物电泳结果
图1中,1和16泳道为DNA marker;2~6和17~21泳道为10株肠球菌LAMP扩增结果;7~15和22~26泳道为非肠球菌LAMP扩增结果,依次为产气荚膜梭菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、福氏志贺氏菌、痢疾志贺氏菌、宋内志贺氏菌、单增李斯特菌、英诺克李斯特菌、副溶血弧菌、溶血性链球菌、铜绿假单胞菌、大肠埃希氏菌、蜡样芽孢杆菌和阪崎肠杆菌。
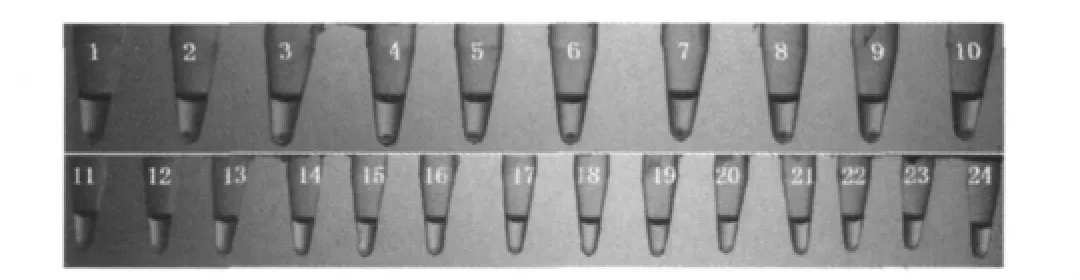
图2 肠球菌和非肠球菌LAMP反应产物离心后结果
图2中,1~10号管为肠球菌标准菌株;11~24号反应管依次分别为依次为产气荚膜梭菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、福氏志贺氏菌、痢疾志贺氏菌、宋内志贺氏菌、单增李斯特菌、英诺克李斯特菌、副溶血弧菌、溶血性链球菌、铜绿假单胞菌、大肠埃希氏菌、蜡样芽孢杆菌和阪崎肠杆菌。

图3 肠球菌和非肠球菌LAMP产物荧光染色结果
图3中,1~6号管为肠球菌标准菌株;7~16号管依次为金黄色葡萄球菌、鼠伤寒沙门氏菌、福氏志贺氏菌、痢疾志贺氏菌、宋内志贺氏菌、单增李斯特菌、溶血性链球菌、铜绿假单胞菌、大肠埃希氏菌和阪崎肠杆菌。
2.2 灵敏度实验
以不同的肠球菌标准菌株DNA模板质量浓度对LAMP方法和普通PCR方法的检测灵敏度进行测试。其中LAMP方法检测时,当DNA模板质量浓度降至10 fg/μL时仍可见较为明亮的梯状扩增产物,故LAMP法灵敏度达到10 fg/μL;PCR法检测时,当DNA模板质量浓度降至10 pg/μL时仍可见较为明亮的目的扩增片段,故PCR法检测灵敏度约为10 pg/μL。在本实验中,LAMP检测方法的灵敏度较普通PCR方法高3个数量级,体现出更好的检测灵敏度。

图4 肠球菌LAMP检测灵敏度
图4中,1泳道为DNA marker,11泳道为空白对照;2~10泳道分别为10 ng/μL,1 ng/μL,100 pg/μL,10 pg/ μL,1 pg/μL,100 fg/μL,10 fg/μL,1 fg/μL,0.1 fg/μL模板DNA质量浓度的LAMP反应产物。
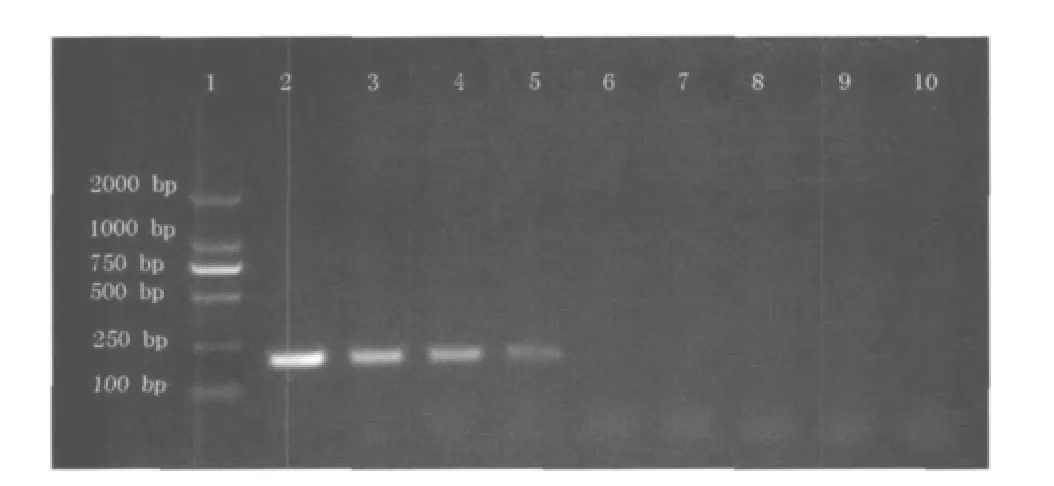
图5 肠球菌PCR检测灵敏度测试
图5中,1泳道为DNA marker;1~10泳道分别为10 ng/μL,1 ng/μL,100 pg/μL,10 pg/μL,1 pg/μL, 100 fg/μL,10 fg/μL,1 fg/μL,0.1 fg/μL模板DNA质量浓度的LAMP反应产物。
2.3 模拟样品检测比对实验
对模拟样品LAMP检测结果与预期完全一致,且与国家标准方法的检测结果完全吻合,无假阳性或假阴性结果出现,说明该方法具有良好的特异性和实用性。同时,LAMP检测方法检测周期仅为14 h,较国家标准分析方法3 d的检测周期有明显改善。
2.4 真实样品检测比对实验
应用LAMP方法对164批次婴幼儿配方乳粉进行肠球菌定量检测,在37批次样品中检出肠球菌,检出率为22.6%,与行业标准方法的检测结果一致,污染量(最近似值)在0.36~110g-1间(表4)。
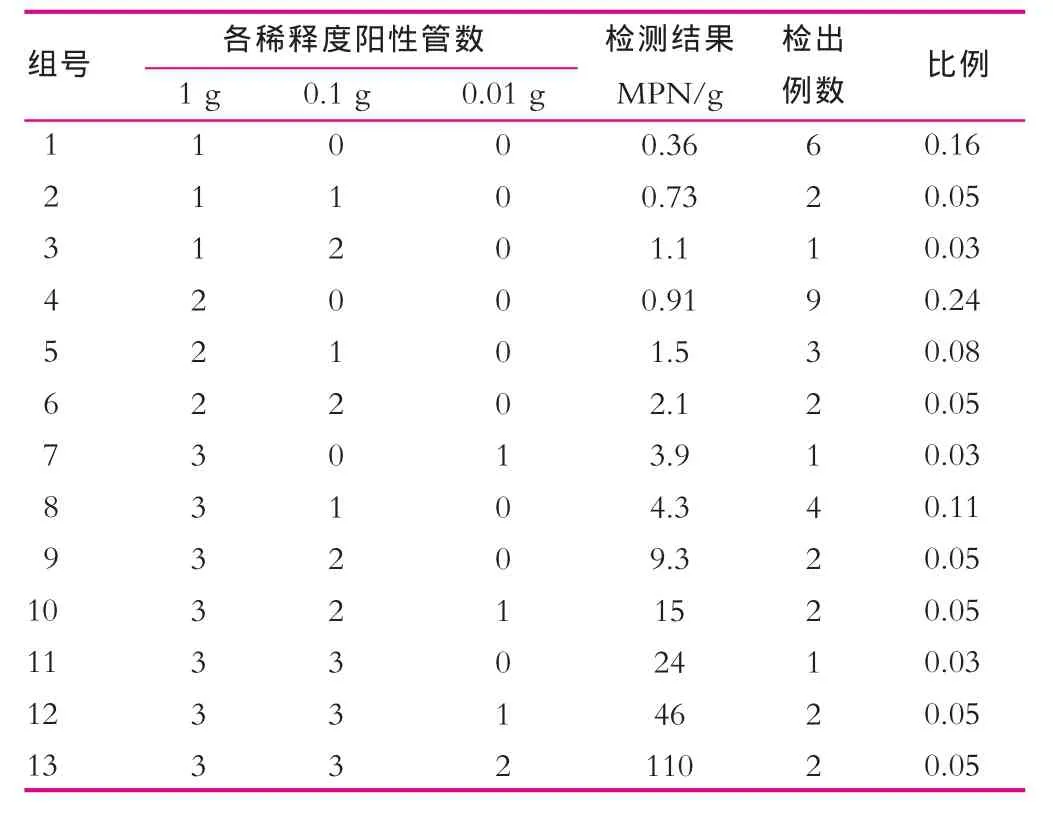
表4 婴幼儿配方乳粉肠球菌定量检测结果
3 讨论
肠球菌是人类和动物肠道正常菌群的一部分,但研究和临床病例已证实了肠球菌的致病性,由肠球菌引起的食物中毒事件屡有发生[6-8],当食入每克含菌量达105以上的污染食品时,即可引起食物中毒,而针对婴幼儿等特殊人群时,引起食物中毒的污染量可能更低。卫生学家认为,肠球菌类似于大肠菌群的生态活动,但对外环境抵抗力更强,作为监测水质卫生,环境卫生质量的污染指标更具有卫生学意义。长期以来,食品中肠球菌的检测主要采用平板培养分离鉴定法,但该方法检测周期长达3 d,且检测过程较为复杂,无法及时提供检测数据。近年来,有关肠球菌的检测技术及分型研究已进入分子水平[9,10],这为肠球菌所致食物中毒的防控提供重要技术指导。
PCR方法尽管操作起来比较简单易行,但是操作过程必须有高精密度的温度循环装置,从而使得这种方法不能在实地现场广泛应用。LAMP技术无需高精密度温控设备,可在恒定温条件下,1 h内扩增出109靶序列拷贝,扩增产物是一系列反向重复的靶序列构成的茎环结构和多环花椰菜样结构的DNA片段的混合物,可通过电泳观察是否显现阶梯式图谱,或离心观察是否出现沉淀,或加入荧光显色剂观察是否呈现荧光来判断检测结果。LAMP技术以其特异性强、等温灵敏、操作简单、产物易检测等优点,在诸如致病菌、病毒、霉菌、转基因成分等食品安全检测领域得到了日益广泛的应用。
本研究结果表明,所建LAMP检测方法特异性强,稳定性好,目标菌DNA的检出限达到10 fg/μL,较PCR方法灵敏度提高1 000倍。在对164份婴幼儿配方乳粉肠球菌的检测结果显示,其中37批次被肠球菌污染,证实了肠球菌在乳品中污染的存在。因此,对于污染率较高的样本,如食物中毒样本可以无需增菌而通过直接制备菌悬液提取DNA的方式获得模板,本LAMP检测方法的灵敏度完全能够满足检测要求;对于污染程度较低的样品,可通过使用肠球菌肉汤培养液对样品在36℃条件下增菌10~12 h,细菌浓度即可满足LAMP检测要求。同时,LAMP检测结果观察方式简便多样,检测设备要求不高,具有广阔应用前景,特别适用于基层单位及食品安全突发事件的现场检测,有利于从源头控制食品安全事件的发生。
[1]YAMAZAKI W,SETO K,TAGUCHI M,et al.Sensitive and Rapid Detection of Cholera Toxin-Producing Vibrio Cholerae Using a Loop-Mediated Isothermal Amplification[J].BMC Microbiol,2008,8: 94.
[2]HARA-KUDO Y,NEMOTO J,OHTSUKA K,et al.Sensitive and Rapid Detection of Verotoxin-Producing Escherichia Coli Using Loop-Mediated Isothermal Amplification[J].J Med Microbiol,2007, 56:398?406.
[3]WANG D G,LIU F,HUO G C H,et al.Development and Evaluation of a Loop-Mediated Isothermal Amplification Method for Detecting Escherichia Coli O157 in Raw Milk[J].J.Rapid Methods Autom Microbiol,2009,17:55-66.
[4]NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-Mediated Isothermal Amplification of DNA[J].Nucleic Acids Res.,2000, 28:63.
[5]中华人民共和国出入境检验检疫行业标准《食品和水中肠球菌检验方法》(SN/T 1933-2007)[S].北京:中国标准出版社,2007.
[6]单文清,戴志芳,何艳,等.一起粪肠球菌食物中毒的调查[J].实验与检验医学,2008,26:212.
[7]姚国兴.一起由肠球菌引起的食物中毒[J].职业与健康,2006,22: 269.
[8]杨东霞,何全安,李新庆.一起由鸡肠球菌引起367名学生食物中毒事故的调查分析[J].河南预防医学杂志,2005,16:108-109.
[9]王亚宾,陈丽颖,胡慧,等.猪源粪肠球菌和屎肠球菌多重PCR快速鉴定方法的建立[J].动物医学进展,2010,31:127-131.
[10]任月,袁杰利,卢行安,等.肠球菌TaqMan实时荧光定量PCR检测方法的建立及初步应用[J].中国微生态学杂志,2007,19:413-416.
Establishment of LAMP rapid detection method for Enterococcus in dairy products
JIANG Kan,ZHANG Dong-lei,JIN Yan-fei,CHEN Xiao-zhen
(Zhejiang Test Academy of Quality and Technical Supervision,Hangzhou 310013,China)
LAMP(Loop-mediated isothermal amplification,LAMP)rapid detection method for Enterococcus in dairy products was established,with the LAMP primers designed based on the 16sRNA sequence.The results of the study indicated that the method had perfect specificity,as 10 strains of Enterococcus were able to amplify specific fragments,while 14 strains of non-Enterococcus were not,and no false positive or false negative results occurred.The test could be done within 14 hours,and the concentration of target bacteria DNA for positive LAMP reaction was only 10 fg/μL of sample DNA.The established method was applied to the test of 164 Infant formula milk powders,and 37 had positive result,with the amount of pollution between 0.36~110 MPN/g.The established method provides a good choice for rapid detection of Enterococcus.
Enterococcus;LAMP;rapid detection;dairy
TS252.7
B
1001-2230(2011)05-0050-04
2011-03-15
浙江省科技厅优先主题重点社会发展项目(No.2009C13013);浙江省质量技术监督系统科研项目(No.20090209)。
姜侃(1978-),男,工程师,研究方向为免疫学与微生物学。
张东雷
