乳酸双歧杆菌喷雾干燥工艺研究
2011-01-08付博马齐王卫卫
付博,马齐,王卫卫
(1.陕西省科学院酶工程研究所,西安 710600;2.西北大学生命科学学院,西安 710069)
乳酸双歧杆菌喷雾干燥工艺研究
付博1,马齐1,王卫卫2
(1.陕西省科学院酶工程研究所,西安 710600;2.西北大学生命科学学院,西安 710069)
为有效保证乳酸双歧杆菌在生产、消费及贮藏过程中的菌体活性,利用喷雾干燥法制备双歧杆菌微胶囊,深入研究了喷雾干燥过程中的工艺参数。通过壁材选择及相关工艺参数的正交分析,结果表明:喷雾干燥过程中的最佳壁材质量浓度为100 g/L,包括β-环糊精与阿拉伯树胶粉,且质量比为4∶6,芯材质量浓度60 g/L,包括海藻糖20 g/L,甘露醇20 g/L,菌泥25 g/L和抗坏血酸0.01 g/L。最佳工艺参数为进风温度(108±2)℃,排风温度(61±3)℃,塔壁温度(50±3)℃及雾化器转速17 000 r/min。在此工艺条件下菌粉的活菌数为3.4×109g-1,存活率72.12%,包埋率75.88%。
乳酸双歧杆菌,喷雾干燥,工艺
0 引言
双歧杆菌(Bifidobacterium)是普遍存在于人体和哺乳动物肠内的重要生理性细菌之一,并逐渐应用于功能性食品、保健品及医疗免疫产品的开发和使用[1-2]。但是,双歧杆菌营养要求苛刻、对氧气和酸度比较敏感,其活菌制剂的保藏期短[3]。目前,国内外多利用微胶囊技术来解决这一难题[4,5]。
微胶囊技术主要包括:挤压法、乳化法、喷雾干燥法和空气悬浮法等[5]。其中喷雾干燥法成本低、适用性广、工艺简单,更适宜在食品工业中推广应用[6],本次研究主要利用了β-环糊精和阿拉伯树胶粉作为喷雾干燥过程中的包埋壁材,选择适宜组分作为包埋芯材,并对进风温度、排风温度、塔壁温度和进样流速等工艺参数进行研究,最终确定了双歧杆菌活菌率较高的喷雾干燥最佳操作工艺流程。
1 实验
1.1 材料与试剂
乳酸双歧杆菌(Bifidobacterium lactis)。活化菌种用改良TPY液体培养基[3]。发酵及活菌计数培养基[7-8]。
β-环糊精、海藻糖、甘露醇、阿拉伯树胶粉(均为食品级)。
1.2 仪器与设备
QPG-1喷雾干燥机,喷雾干燥中试设备(水分蒸发量为40 kg/h)。
1.3 方法
1.3.1 菌种活化与菌泥制备
将乳酸双歧杆菌菌粉接种改良的TPY培养液,37℃培养14 h。活化2代,转接发酵培养液,接种量5%,发酵时间20 h。取发酵液,4 000 r/min,离心5 min,弃上清液得菌泥[9]。
1.3.2 壁材的选择[1,10,11]
选用明胶/蔗糖、阿拉伯树胶粉/麦芽糊精、β-环糊精/明胶、β-环糊精/阿拉伯树胶粉4种组合壁材,设计质量比分别为1︰9,2︰8,3︰7,4︰6;壁材质量浓度为60,90,120 g/L;利用QPG-1喷雾干燥机,进风温度140±3℃,芯材质量浓度60 g/L进行喷雾干燥[3]。观察喷雾菌粉的物理状态,并采用双层平板菌落计数法测活菌数[12],筛选最佳包埋壁材。
1.3.3 壁材和芯材及不同条件对菌体存活率的影响
以壁材质量浓度、芯材质量浓度、处理温度和处理时间为实验因素,设计L9(34)正交实验,结果如表1所示。确定喷雾干燥过程中壁材质量浓度和芯材质量浓度的最佳组合,检验在热处理过程中4种试验因素对菌体的存活率影响能力。
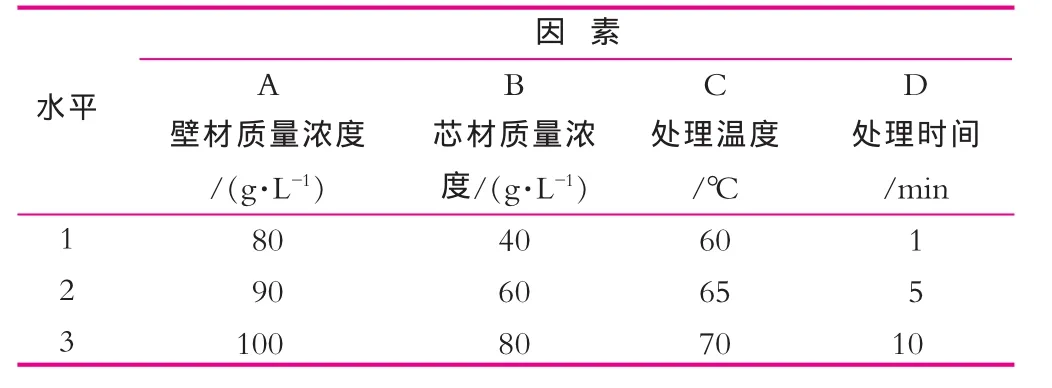
表1 正交试验因素和水平表
1.3.4 喷雾干燥工艺参数的确定
梯度设置进风温度、调节控制排风温度、在最佳包埋壁材和芯材条件下利用我所自行研制的喷雾干燥中试设备进行试验。双层平板菌落计数法对喷雾干燥后的菌粉进行活菌计数,根据活菌数的多少确定最佳工艺参数。
1.3.5 产品质量检测
喷雾干燥后菌粉的存活率及包埋率的测定[13-15]:取喷雾干燥后的微胶囊样品各1 g,分别置于99 mL的缓冲液(pH=4.0)和肠溶液(pH=6.8),37℃恒温水浴振荡,处理45 min,活菌计数分别为微胶囊表面的活菌数和产品中的活菌数。
喷雾干燥后菌粉的水分质量分数测定,方法参照GB/T 5009.3-2003。将喷雾干燥后的菌粉置于4℃储藏30 d、60 d、90 d,检测喷雾干燥菌粉的活菌数变化。

2 结果与分析
2.1 最佳壁材的确定
QPG-1喷雾干燥机在进行喷雾操作过程中,要求加样液体密度大于1。因此,在对包埋壁材进行选择时,首先对明胶/蔗糖、阿拉伯树胶粉/麦芽糊精、β-环糊精/明胶、β-环糊精/阿拉伯树胶粉4种组合壁材的质量浓度和配比进行了筛选,结果如表2所示。
由表2可以看出,当组合壁材的质量浓度为60 g/L时,4组液体密度均小于1,没有达到操作要求,故排除。当组合壁材的质量浓度为90 g/L时,除明胶/蔗糖(1︰9)外,密度均大于1,达到操作要求。当组合壁材的质量浓度为120 g/L时,β-环糊精随着添加量的增加而饱和度降低,有少量析出,故排除该质量浓度下的③和④组。
在喷雾干燥过程中,对加样液体的一般要求是“高浓度、低黏度”[1],同时考虑到小型喷雾干燥机的工作性能,最终择优选择了8组壁材在进风温度(140± 3)℃,芯材质量浓度60 g/L[3]条件下,利用QPG-1喷雾干燥机,进行了喷雾干燥,并对收集的纯菌粉进行活菌计数,结果如表3所示。
由表3可以看出,当壁材为明胶/蔗糖时,干燥后的菌粉粘壁现象比较严重,粉体易结块且堵塞喷嘴,极大的降低了产品中的活菌数,不适于推广使用。而其他壁材保护双歧杆菌得到的菌粉,粉粒较细,基本没有粘壁和堵塞喷嘴的现象。最终根据活菌数的多少,确定最佳壁材组合为β-环糊精/阿拉伯树胶粉,配比为4︰6。经重复试验结果一致,稳定性较好。
2.2 正交试验
喷雾干燥过程对双歧杆菌的存活率有很大的影响,一方面要通过包埋克服热风和氧气对菌体的损伤,另一方面还要尽量提高工作效率,减少操作时间。为了节约生产成本,在进行大规模喷雾干燥之前,首先利用水浴法对壁材质量浓度、芯材质量浓度、处理温度和处理时间进行了3水平4因素的正交实验,并利用双层平板菌落计数法测定活菌数,进而对菌体存活率进行了计算,结果如表4所示。
可见,壁材质量浓度、芯材质量浓度、处理温度和处理时间对双歧杆菌的存活率影响存在明显差异,影响能力依次为处理时间>处理温度>芯材质量浓度>壁材质量浓度,最优处理组合为A3B2C1D1。虽然喷雾干燥过程中的干燥时间仅有5~35 s左右[15],但是对双歧杆菌存活率影响最为显著的因素仍然是处理时间和处理温度,因此,为了更好的提高菌体存活率和活菌数,在喷雾干燥过程中应尽量调低进风温度、减少菌粉在塔内的存留时间。最终确定最佳的壁材质量浓度为100 g/L,芯材质量浓度为60 g/L,芯材组合参考文献[3]确定为海藻糖20 g/L,甘露醇20 g/L,菌泥25 g/L和抗坏血酸0.01 g/L。
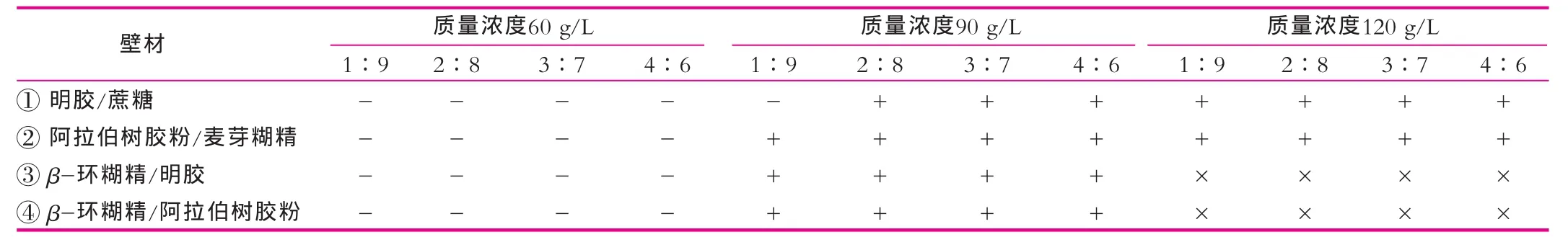
表2 壁材的浓度和配比筛选

表3 在不同组分配比的壁材保护下喷雾干燥后产品的活菌数g-1

表4 正交实验结果
2.3 温度及流速对活菌数的影响
利用上述试验确定的最佳壁材100 g/L(β-环糊精与阿拉伯树胶粉,质量比为4:6),芯材60 g/L(海藻糖20 g/L,甘露醇20 g/L,菌泥25 g/L和抗坏血酸0.01 g/L)配制料液,在我所自行研制的喷雾干燥中试设备上进行实验。梯度设置进风温度,排风温度通过流速进行调节,结果显示,随着进风温度和排风温度的降低,活菌数逐渐升高(表5)。
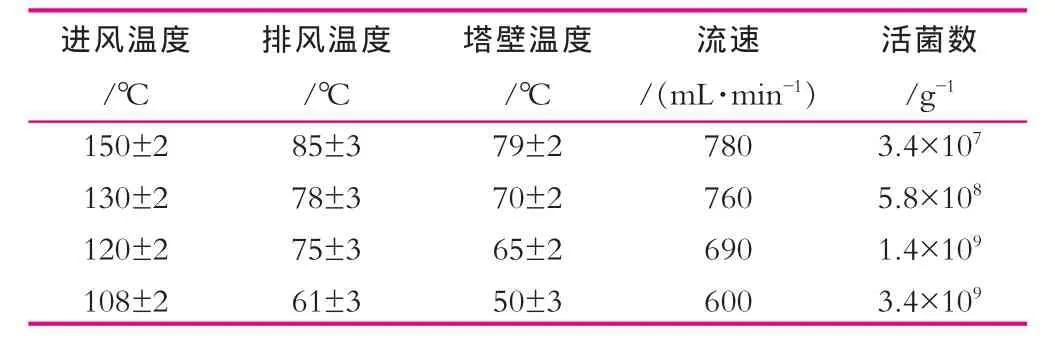
表5 温度与流速对喷雾干燥菌粉活菌数的影响
由表5可以看出,进风温度从150℃逐渐调节到110℃,通过流速的控制排风温度从(85±3)℃降低到(61±3)℃,菌粉的活菌数提高了2个数量级。因此,在喷雾干燥过程中为保证高活菌数,应将进风温度适当降低,同时通过流速控制排风温度,并维持在低温度范围。
当进风温度为(108±2)℃,排风温度(61±3)℃,塔壁温度(50±3)℃,流速为600 mL/min时,喷雾干燥后活菌数最高,达3.4×109g-1,经重复实验验证结果一致,工艺参数稳定。
2.4 喷雾干燥后乳酸双歧杆菌菌粉的检测结果
经计算喷雾干燥后菌粉的存活率为72.12%,微胶囊包埋率为75.88%;参照GB/T 5009.3-2003方法,测定菌粉水分质量分数为5.9%。将喷雾干燥后的菌粉置于4℃储藏30,60,90 d;结果如表6所示。由表6可以看出,随储藏时间的延长菌粉活力缓慢下降,但是4℃储藏90 d时菌粉的活菌数仅降低了一个数量级,产品的稳定性较好,喷雾干燥法制备的乳酸双歧杆菌菌粉的活菌保藏期延长。

表6 喷雾干燥菌粉4℃保藏时间结果
3 结论
与现有技术相比,喷雾干燥法制备双歧杆菌微胶囊具有很多优点:生产成本低、效率高,有成套的设备可供利用且操作控制简单,生产中不会排放大量污染物等,这些都为大规模连续化工业生产提供了便利条件[6,16]。目前针对双歧杆菌喷雾干燥工艺的研究并不多见,而在真空冷冻领域的研究相对比较多[17,18]。
本研究主要对乳酸双歧杆菌在喷雾干燥过程中的工艺参数进行控制,分别利用了QPG-1小型喷雾干燥设备和我所自行研制的喷雾干燥中试设备。小型喷雾干燥设备处理量小,500 mL料液的喷雾干燥约进行3~4 h,适宜实验室筛选研究。我所自行研制的喷雾干燥中试设备处理量大,10 L料液喷雾干燥过程还不到20 min,而且菌粉不粘壁,得率高。最终确定的最佳工艺:发酵液4 000 r/min,离心5 min取菌泥,将包埋壁材和芯材充分混合均匀,静置30 min,然后进行喷雾干燥。进风温度为(108±2)℃,排风温度为(61±3)℃,塔壁温度为(50±3)℃,雾化器转速为17 000 r/min。其中最佳壁材100 g/L(β-环糊精与阿拉伯树胶粉,质量比为4︰6),芯材60 g/L(海藻糖20 g/L,甘露醇20 g/L,菌泥25 g/L和抗坏血酸0.01 g/L)。此工艺条件下制备的乳酸双歧杆菌的活菌数3.4×109g-1,存活率72.12%,微胶囊包埋率75.88%,菌粉水分质量分数为5.9%,4℃保藏90 d活菌数仍可达到2.9×108g-1。经重复试验结果一致,工艺参数的稳定性好,因此可以为双歧杆菌喷雾干燥微胶囊产品的开发、研究及推进产业化发展提供指导和借鉴。
[1]RODRIGUEZ-HUEZO M E,DURAN-LUGO R,PRADOBARRAGAN L A.,et al.Pre-selection of Protective Colloids for Enhanced Viability of Bifidobacterium bifidum Following Spray-Drying and Storage,and Evaluation of Aguamiel as Thermoprotective Prebiotic[J].Food Research International,2007,40(10):1299-1306.
[2]PALACIOS M C,HAROS M,ROSELL C M,et al.Selection of Phytate-Degrading Human Bifidobacteria and Application in Whole Wheat Dough Fermentation[J].Food Microbiology,2008,25(1):169-176.
[3]郝莹.不同剂型双歧杆菌制剂的制备技术及存活性能的研究[D].西安:西北大学,2009.
[4]ZHAO M,ZHANG F,WANG W,et al.Preparation Technology of Bifidobacterium bifidum Freeze-Dried Powder and Microencapsulation and Study on its Characters[J].Journal of Biotechnology,2008, 136(1):514.
[5]李良,魏庆梅,杜鹏,等.双歧杆菌微胶囊技术及应用[J].中国乳品工业, 2006,34(5):39-42.
[6]李宁,田洪涛,吴蕊,等.双歧杆菌微胶囊喷雾干燥工艺的影响因素研究[J].食品与发酵工业,2007,33(8):89-91.
[7]曹永梅,许时婴.微胶囊化双歧杆菌产品的特性[J].食品工业,2001 (3):28-29.
[8]SZILARD K,JUDIT M R,QUANG D N,et al.Changes of Microbial Population and some Components In Carrot Juice During Fermentation with Selected Bifidobacterium Strains[J].Process Biochemistry,2008,43:816-821.
[9]田洪涛,张柏林,贾英民.提高双歧杆菌在离心过程中活菌收得率的研究[J].食品科学,2000,21(6):27-30
[10]孙俊良,赵瑞香,王大红,等.嗜酸乳杆菌真空喷雾干燥微胶囊化技术的研究[J].农业工程学报,2006,22(5):161-164.
[11]赵瑞香.嗜酸乳杆菌及其应用研究[M].北京:科学出版社,2007: 150-166.
[12]沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,2003:77-80.
[13]黄序.微胶囊技术及片剂包衣技术在双歧杆菌保护中的应用[D].天津:天津科技大学,2002.
[14]黄序,戚薇,王建玲,等.肠溶性双歧杆菌微胶囊的初步研究[J].药物生物技术,2002,9(2):105-109.
[15]李宁.双歧杆菌微胶囊制备工艺及功能特性的研究[D].保定:河北农业大学,2007.
[16]刘绘景,陆海霞,楼加佳,等.喷雾干燥对双歧杆菌存活影响的研究[J].食品与机械,2004,20(3):11-12,22.
[17]BRIAN C S T,MARK R E.Spray Drying,Freeze Drying,or Freezing of Three Different Lactic Acid Bacteria Species[J].Food Science,1997,62(3):576-578.
[18]郝莹,王卫卫,马齐,等.冻干乳酸双歧杆菌微胶囊的制备及存活性能研究[J].食品科学,2009,30(9):163-167.
Spray drying technics of Bifidobacterium lactis
FU Bo1,MA Qi1,WANG Wei-wei2
(1.Enzyme Engineering Institute,Shanxi Academy of Sciences,Xi’an 710600,China; 2.College of Life Science,Northwest University,Xi’an 710069,China)
Spray drying of microencapsulation was used to effectively protect the activity of Bifidobacterium lactis during the production and storage,and technics parameters were also tested.Through wall material selection and orthogonal analysis of relevant parameters,the results showed that the best mass concentration of wall-material was 100 g/L,including β-cyclodextrin and gum acacia,and the mass ratio was 4∶6.The mass concentration of core-material was 60 g/L,include trehalose 20 g/L,mannitol 20 g/L,bacteria mire 25 g/L and ascorbic acid 0.01 g/L.The best inlet air temperature was 108±2℃,outlet air temperature was 61±3℃,and tower wall temperature was 50±3℃.Atomizer speed was 17 000 r/min.Under the optimized conditions,the survival bacteria number were over 3.4×109cfu/g,survival rate was 72.12%and encapsulation efficiency was 75.88%.
Bifidobacterium lactis;spray drying;technics
Q93-33
A
1001-2230(2011)05-0010-04
2011-03-31
陕西省科学院青年基金资助项目(2010k-26)。
付博(1982-),女,硕士研究生,研究方向为双歧杆菌活菌制剂开发。
