老鼠簕植物内生真菌Aspergillus terreus(W-8)抗肿瘤活性成分的研究*
2011-01-08孙世伟林贞健朱天骄李德海顾谦群
孙世伟,林贞健,朱天骄,李德海,顾谦群
(中国海洋大学医药学院,教育部海洋药物重点实验室,山东青岛266003)
老鼠簕植物内生真菌Aspergillus terreus(W-8)抗肿瘤活性成分的研究*
孙世伟,林贞健,朱天骄,李德海,顾谦群**
(中国海洋大学医药学院,教育部海洋药物重点实验室,山东青岛266003)
对红树林植物的枝干、枝叶样品进行微生物分离,以P388细胞为模型进行活性评价得到14株具有抗肿瘤活性的真菌。采用溶剂萃取、柱色谱及半制备HPLC等分离手段对来源于红树林植物老鼠簕Acanthus ilicifolius Linn.的菌株Aspergillus terreus(W-8)发酵产物进行了活性追踪分离,共得到5个化合物。通过理化性质及波谱技术,结合文献,鉴定其结构分别为aspulvinone H1(1)、aspulvinone H(2)、butyrolactone I(3)、terrein(4)和3-propylbenzene-1,2-diol(5),其中化合物1的核磁数据为首次报道。采用MTT法初步评价了单体化合物的抗肿瘤活性,结果表明化合物4、5对A549、K562和Hela细胞均具有中等强度的细胞毒活性。
红树林植物;内生真菌;次级代谢产物;抗肿瘤活性;老鼠簕
植物内生真菌是指在其生活史的一定阶段或全部阶段生活于健康植物各种组织、器官内部的真菌,被感染的宿主植物不表现出外在病症[1-2]。它不仅包括互惠共利的和中性的内共生真菌,也包括那些潜伏在宿主体内的病原菌[3]。内生真菌广泛存在于植物体的根、茎、叶、花、果和种子等器官组织的细胞或细胞间隙,不同的内生真菌往往占据不同的生态位。它们在植物体中相互作用,维持着微生态的平衡。在这个平衡的体系中,寄生植物为内生真菌提供营养,作为回报,内生真菌的代谢产物能够产生与宿主植物相同或相似的药用活性成分来增强寄生植物在自然界的竞争力[4-6],因此采用微生物发酵的方法获得植物中有效成分,是解决植物源药用成分有效新途径之一。自从美国蒙大拿州立大学的Strobel小组[7]在短叶红豆杉内生真菌Taxomyces andreanae中发现紫杉醇,国内外掀起了一股对药用植物和濒危植物内生真菌的研究热潮。基于内生真菌能够产生与宿主植物相同或相似化学成分这一观点,人们从具有抗肿瘤活性的植物入手,进行了内生真菌次级代谢产物的研究并得到了很有价值的研究成果。
红树林是指热带、亚热带海岸潮间带的木本植物群落,是海岸带极为独特的生态景观,素有“海上森林”和“海上卫士”之称[8],是热带海岸地带一种重要的湿地类型和重要的生态系统,蕴藏着极为丰富和多样的微生物群落。特殊的生存环境使红树林微生物有可能产生结构独特、生理活性独特的次级代谢产物。因此,研究红树林微生物次级代谢产物具有重要意义。本研究室近年选择红树林这一可持续再生的重要资源,对分别采自广东高桥红树林保护区和厦门九龙江口红树林湿地的桐花树(Aegiceras corniculatum)枝叶、枝干及海口东寨港红树林自然保护区的老鼠簕(Acanthus ilicifolius Linn.)枝叶的3个样品采用P388小鼠白血病细胞系为模型进行筛选,从中得到14株活性红树林内生真菌。通过菌株抗肿瘤活性筛选结合化学筛选以及HPLC指纹图谱分析,发现来源于老鼠簕(A.ilicifolius Linn.)枝叶内生真菌A.terreus(W-8)的粗浸膏对小鼠白血病细胞P388具有明显的细胞毒活性,HPLC指纹图谱显示具有紫外吸收相似的系列色谱峰,提示可能含有结构相近的代谢产物,基于以上分析选取该菌株进行大量发酵,并采用活性追踪的方法,对其发酵产物中活性次级代谢进行了提取分离,从中得到5个单体化合物,并采用MTT方法初步评价了化合物的细胞毒活性。
1 实验部分
1.1 试验试剂和仪器
恒温培养箱:MIR-253(SANYO公司);高压灭菌锅:MLS3750(日本三洋株式会社);超声仪:VC750(美国SONICS公司);洁净工作台:Air Tech(苏州安泰空气技术有限公司);试管式振动培养箱:TC-C-100R(高崎科学器械株式会社);高速离心机:(德国BECKMAN公司);旋转式振动培养箱:TC-C-100R(高崎科学器械株式会社);二氧化碳培养箱:MCO175(SANYO公司);真空浓缩仪:SC250DDA(Savant公司);EYELAN-N型旋转薄膜蒸发仪:Tokyo Rikakikai CO.LTD;相差倒置显微镜:CK40(OLYMPUS公司);超净工作台:MCV-131BNF(T)(SANYO公司);质谱仪:美国Waters Q-TOF Ultima Global型质谱仪;核磁共振仪:日本JEOL JNM-ECP600型;制备高效液相色谱:日本岛津公司产品(LC-6AD泵,SPD-M20AVP检测器,SCL-10AV型系统控制器,YMC-pack ODS(A),10mm×250mm,5μm,4mL/min);硅胶H(200~400目):青岛海洋化工厂产品;Sephadex LH-20:Pharmacia公司。LiChroprep?RP-18(25~40 μm):Merck公司产品。活性测试采用人宫颈癌细胞Hela细胞、人肺腺癌A549细胞和人体慢性髓性白血病细胞K562;胎牛血清(FBS)和RPMI-1640细胞培养基分别为Hyclone公司(Cat.No.STF721)和GIBCOBRLD公司产品;四甲基偶氮唑蓝(MTT)为Sigma公司产品。
常规提取分离用丙酮、甲醇、石油醚、乙酸乙酯、氯仿等均为工业用化学纯产品,重蒸后使用,液相色谱甲醇为色谱纯。
1.2 实验材料与方法
1.2.1 样品来源 供分离的样品来自广东高桥红树林保护区和厦门九龙江口红树林湿地的桐花树(A.corniculatum)枝叶、枝干,海口东寨港红树林自然保护区的老鼠簕(A.ilicifolius Linn.)枝叶。
1.2.2 真菌培养基 分离培养基:采用马铃薯葡萄糖琼脂培养基与以红树林植物枝叶煮水制作的马铃薯葡萄糖琼脂培养基。
发酵培养基:麦芽糖2%,葡萄糖1%,甘露醇2%,味精1%,MgSO4·7H2O 0.03%,KH2PO40.05%,玉米浆0.1%,酵母浸膏0.3%,pH=6.5。
1.2.3 细胞毒活性筛选模型 细胞培养:活性筛选采用小鼠白血病P388细胞系。细胞用含10%FBS的DMEM培养基,在通入5%二氧化碳的37℃细胞培养箱中继代培养。
细胞镜检:取对数生长期的P388细胞,用含10%FBS的新鲜DMEM培养基配制成2×105个/mL的细胞悬液,接种到24孔板中,每孔0.5mL。每孔再加5 μL样品溶液,空白对照留复孔。37℃细胞培养箱中培养17h后,于倒置显微镜下观察细胞形态,记录样品的活性结果。
1.3 红树林植物来源真菌分离方法[9]
处理方法:采用组织切片培养法及匀浆涂布法分离内生真菌[7]。红树林植物枝叶样品用75%酒精和0.02%的氯化汞进行表面消毒,用无菌水冲洗3~5次,在洁净台内晾干。
组织切片法:叶子直接切碎(0.5cm×0.5cm)铺于培养基表面培养;枝干先削去表皮,切碎(0.5cm×0.5cm)后平铺于培养基表面培养。
匀浆涂布法:将处理后样品(枝干内表皮和叶片)0.5g加2mL的无菌水,于研钵中充分研磨后,取0.2 mL的匀浆液作10-1、10-2、10-3、10-4倍的梯度稀释后涂布于培养基表面培养。
28℃培养箱中培养6d左右,开始长出菌丝,4周后菌丝铺满培养皿,因此,4周前挑取尖端菌丝移至新的培养基上,几次纯化后得单一菌落并转接到试管斜面上保存备用。
1.4 菌株发酵提取物的准备
从试管斜面取活化培养的真菌适量,接种到含5 mL液体培养基的试管(20mm×200mm)中,于28℃试管摇床中230r·min-1振荡培养7~9d。取发酵产物,超声破碎,按体积比加入2倍量的乙酸乙酯,静置过夜,离心取上清液,浓缩至干,得到固体浸膏。浸膏精确称重,用甲醇配制成相应浓度供使用。
1.5 目标菌株的培养
1.5.1 目标菌株真菌W-8(A.terreus),来源于海口东寨港红树林自然保护区的老鼠簕(A.ilicifolius Linn.)枝叶。
1.5.2 发酵培养 真菌2号培养基:葡萄糖2%,麦芽糖2%,味精1%,KH2PO40.05%,MgSO4·7H2O 0.03%,酵母浸膏0.3%,玉米浆0.1%,甘露醇2%,陈海水配制,pH=6.5。
培养方法:取菌株孢子适量,接种到100个含300 mL培养液(真菌2号培养基)的1000mL三角玻璃摇瓶中,在室温条件下培养30d,获得发酵液30L。
1.6 活性测试
化合物抗肿瘤活性采用MTT法[10],结合显微镜观察细胞形态变化。
2 实验结果与讨论
2.1 红树林植物来源真菌分离
分别采用马铃薯葡萄糖琼脂培养基和以红树林植物枝叶煮水制作的马铃薯葡萄糖琼脂培养基作为分离培养基,3个样品中共分得42株内生真菌。
2.2 筛选结果
从42株红树林内生真菌中初步筛选出对小鼠白血病P388细胞具有抑制活性的菌株14株,阳性率为33%,具体结果见表1。
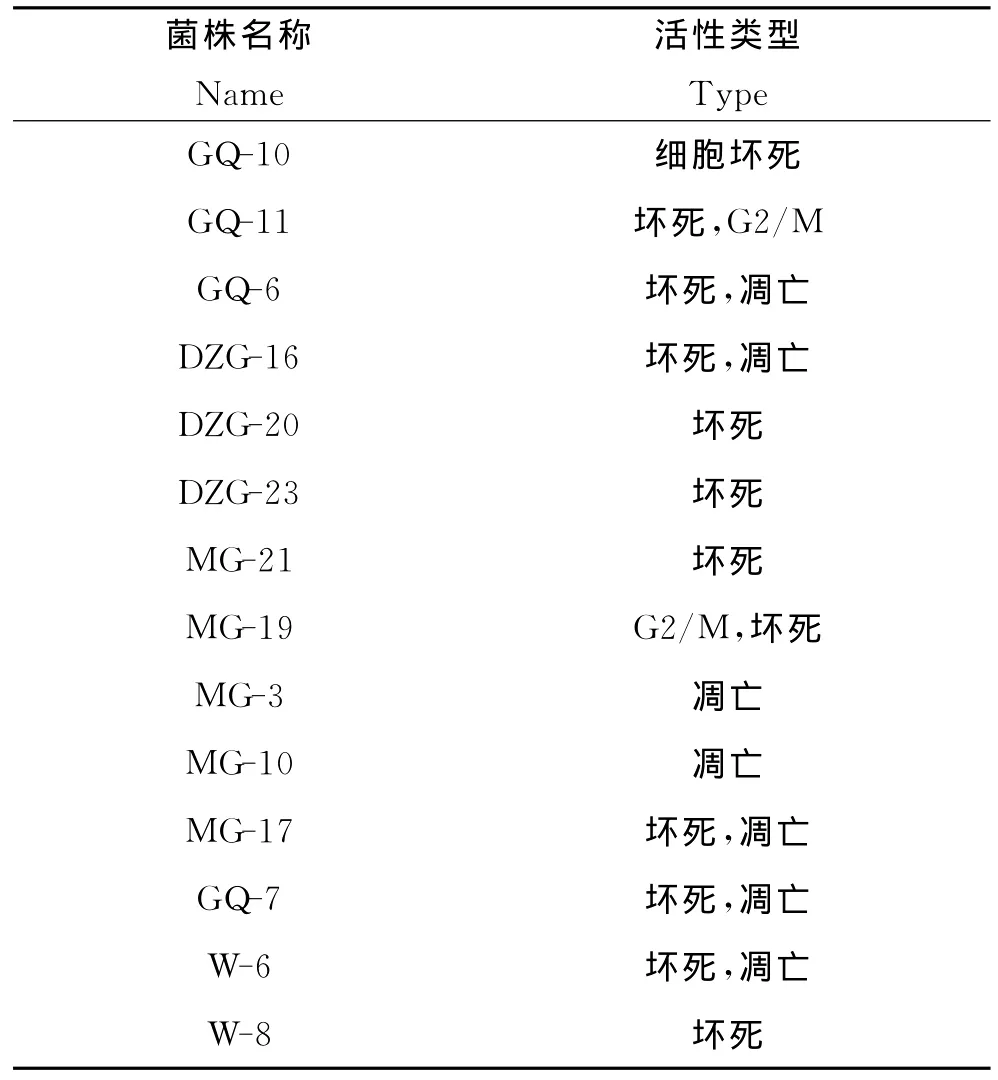
表1 P388细胞抑制活性菌株筛选结果Table 1 The screening result of cytotoxicities of fungi against P388
2.3 目标菌株的确定
在考虑菌株的活性基础上,我们对其代谢产物的薄层色谱和高效液相指纹图谱特征综合分析,最终选择出进一步研究的菌株[9]。
2.3.1 薄层色谱(TLC)法 展开系统:CHCl3∶MeOH=10∶1;显色剂:浓硫酸-香草醛试剂。部分活性菌株的TLC薄层分析结果如图1所示:

图1 活性菌株的TLC数据Fig.1 The TLC analysis of active strains
2.3.2 高效液相色谱(HPLC)法 根据实验室前期的研究积累,确定柱系统:YMC-Pack ODSA,250×4.6mm;进样量:10μL;样品浓度:20mg/mL;流动相:A-甲醇,B-水,梯度洗脱:A相(体积%),0~5min(5),5~45min(5~100),45~55min(100);流速:1.0 mL/min;检测波长:全波长检测。
经过对比我们发现真菌W-8的次级代谢产物丰富且对小鼠白血病P-388细胞有抑制活性,结合HPLC指纹图谱提示菌株W-8具有特征紫外吸收的同系物色谱峰,由此确定真菌W-8作为进一步的研究对象。菌株W-8的指纹图谱如图2所示。

图2 活性菌株W-8的HPLC分析Fig.2 The HPLC analysis of active strain W-8
2.4 浸膏提取分离[9]
将发酵液过滤,分为上清液和菌丝体。取上清液,用等体积乙酸乙酯萃取3次,合并,得上清液的乙酸乙酯萃取液。菌丝体用80%丙酮水溶液超声提取3次,合并提取液,减压浓缩至不含丙酮后,用等体积乙酸乙酯萃取3次,得菌丝体提取物的乙酸乙酯萃取液,合并乙酸乙酯相减压浓缩至干,得到总浸膏35.0g。
总浸膏采用减压硅胶柱层析,以石油醚-氯仿,氯仿-甲醇为洗脱剂进行梯度洗脱,分为10个组分。其中组分Fr.-5和组分Fr.-8经反复的正、反相柱层析、Sephadex LH-20柱层析和制备型高效液相色谱等分离手段,得到化合物1(25mg),化合物2(16mg),化合物3(2.0mg),化合物4(20.5mg),化合物5(3.5mg)。
2.5 化合物结构解析
化合物1,黄色油状物。阳离子ESI-MS在m/z 449[M+H]+、m/z 471[M+Na]+处给出准分子离子峰,提示化合物分子量为448。结合氢谱、碳谱确定分子式为C27H28O6,不饱和度为14。该化合物的1H NMR数据能观察到5组苯环氢信号(δ7.42,H-8;δ6.83,H-9;δ7.46,H-12;δ7.10,H-2’;δ6.38,H-5’),在高场区有2组重叠的甲基氢信号(δ1.63,H-16;δ1.63,H-10’;δ1.74,H-17;δ1.74,H-11’),2组亚甲基信号(δ28.3,C-13;δ27.9,C-7’),2组双键氢信号(δ5.24,H-14;δ5.28,H-8’)综合考虑为2个异戊烯基单元,从13C NMR以及DEPT谱中可观察到分子中含有1个羰基碳信号(δ168.6,C-2),12个芳香碳信号以及3个次甲基信号(δ103.1,C-6;δ124.2,C-14;δ122.9,C-8’)。通过与已知化合物aspulvinone H(2)对比,发现这2个化合物的A环部分核磁数据基本一致,主要差别在B环核磁数据的不同。在化合物2中B环有3个芳香氢,而化合物1中B环只有2个单峰的芳香氢(δ7.10,H-2;δ6.38,H-5),表明在化合物1中有1个芳香氢被羟基取代。仔细对比化合物1与2的13C NMR谱,发现化合物1比化合物2还多了1个化学位移值在δ154.2的与氧相连的芳香季碳,证明上述推断的正确性。相对于化合物2,由于以上结构中C-6’位羟基取代的影响,化合物1中C-3’和C-5’位碳的化学位移值都偏向了高场,而C-2’和C-6’位碳的化学位移值则稍微偏向了低场。化合物1的结构信息虽然被SciFinder数据库收录,但是没有相关文献对其报道,故命名为aspulvinone H1(1)。
化合物2,黄色油状物。阳离子ESI-MS在m/z433[M+H]+、[M+Na]+m/z455处给出准分子离子峰,提示分子量为432。结合1H和13C NMR谱确定分子式为C27H28O5,不饱和度为14。该化合物的1H NMR数据能观察到6组苯环氢信号(δ7.43,H-8;δ6.83,H-9;δ7.43,H-12;δ7.67,H-2’;δ6.87,H-5’;δ7.60,H-6’),为2个1,3,4-三取代苯环信号,在高场区有4个重叠的甲基氢信号(δ1.72,H-16;δ1.72,H-17;δ1.72,H-10’;δ1.72,H-11’),低场区有2个酚羟基氢信号(δ 9.5,OH;δ9.9,OH),2个双键氢信号(δ5.29,H-14;δ5.29,H-8’)综合考虑为2个异戊烯基单元,从13C NMR以及DEPT谱中可观察到分子中含有1个羰基碳信号(δ168.6,C-2)和12个芳香碳信号以及2个亚甲基信号(δ28.3,C-13;δ28.6,C-7’),3个次甲基(δ108.1,C-6;δ123.3,C-14;δ122.8,C-8’)。根据以上信息经过SciFinder检索并且与文献[11]数据对比,确定其结构为aspulvinone H(2)。
化合物3,黄色油状物。阳离子ESI-MS在m/z 425[M+H]+、m/z 447[M+Na]+处给出准分子离子峰,提示分子量为424。结合氢谱和碳谱数据确定分子式为C25H24O7,不饱和度为14。1H NMR谱中,在高场区观测到1组甲基氢信号(δ1.65,H-16;δ1.70,H-17),1个亚甲基氢信号(δ3.14,H-13),此外还给出1个双键氢信号(δ5.10,H-14),结合13C NMR数据(δ 29.2,C-13,δ121.4,C-14,δ134.5,C-15,δ25.7,C-17,δ17.7,C-16),提示分子中可能含有一个异戊烯基片段;δ6.53-δ7.63之间给出7个苯环氢信号,为1个1,3,4-三取代苯环,1个1,2-对位取代苯环的信号,从13C NMR以及DEPT谱中可观察到分子中含有2个羰基碳信号(δ169.7,C-7’;δ169.5,C-2),12个芳香碳信号(其中2个芳碳与氧直接相连),此外还能发现1个羧基甲酯片段的信号(δ3.78,H-8’;δ169.7,C-7’),以上信息说明该化合物也是丁内酯类化合物,经过SciFinder检索并通过与文献[12]数据对比确定其结构为butyrolactone I(3)。
化合物4,淡黄色油状物。阳离子ESI-MS在m/z 155[M+H]+处给出准分子离子峰,结合碳谱氢谱确定分子式为C8H10O3,不饱和度为4。该化合物的13C NMR谱中能观察到1个羰基信号(δ203.6,C-1),4个双键碳信号(δ168.4,C-3;δ139.3,C-6;δ125.5,C-2;δ124.7,C-7),1个甲基碳信号(δ19.1,C-8),2个连氧叔碳信号(δ76.3,C-4;δ80.7,C-5),说明含有一个不饱和酮共轭系统。1H NMR谱中,观测到2个羟基信号(δ3.89;δ4.50)。经过SciFinder检索并通过与文献[13]数据对比确定其结构为terrein(4)。
化合物5,淡黄色油状物。阳离子ESI-MS在m/z 153[M+H]+处给出准分子离子峰,提示分子量为152。该化合物的1H NMR谱显示了典型的1,2,3-三取代苯环的氢谱信号(δ7.1,H-5;δ6.73,H-4;δ6.7,H-6),和1个正丙基氢谱信号(δ2.53,H-7;δ1.54,H-8;δ 0.93,H-6)。综合以上数据特点结合文献[14]数据,确定该化合物为3-propylbenzene-1,2-diol(5)。
2.6 物理常数与波谱数据
化合物1:黄色油状物,ESI-MS(positive):m/z449.3[M+H]+,m/z 471.2[M+Na]+.[α]25D=0.1(c=0.1,MeOH);UV(MeOH)λmax(logε)203(3.16),365(5.32)nm;IR(KBr)νmax3418,2917,2558,2421,1700,1695,1444,1076,1134,1111cm-11HNMR(600MHz,CDCl3)δ:1.63(6H,s,CH3-16,CH3-10′),1.74(6H,s,CH3-17,CH3-11′),3.10(2H,d,J=7.2Hz,H-7′),3.22(2H,d,J=7.4 Hz,H-13),5.24(1H,brd,J=7.4Hz,H-14),5.28(1H,brd,J=7.2Hz,H-8′),6.21(1H,s,H-6),6.38(1H,s,H-5′),6.83(1H,d,J=10.2Hz,H-9),7.10(1H,s,H-2′),7.42(1H,d,J=10.2 Hz,H-8),7.46(1H,brs,H-12).13C NMR(150 MHz,CDCl3)δ:169.3(s,C-2),165.0(s,C-4),156.0(s,C-4′),155.7(s,C-10),154.2(s,C-6′),141.1(s,C-5),132.1(s,C-15),131.9(d,C-12),130.9(s,C-9′),130.5(d,C-2′),129.4(d,C-8),128.3(s,C-11),124.6(s,C-7),124.2(d,C-14),
122.9(d,C-8′),118.7(s,C-3′),115.7(d,C-9),108.1(s,C-1′),105.7(d,C-5′),103.1(d,C-6),98.1(s,C-3),27.9(t,C-7′),26.0(q,C-16),26.0(q,C-10′),28.3(t,C-13),18.1(q,C-17),18.0(q,C-11′)。
化合物2:黄色油状物,ESI-MS(positive):m/z433.4[M+H]+,m/z 455.1[M+Na]+。1H NMR(600 MHz,CDCl3)δ:1.72(12H,s,CH3-16,CH3-17,CH3-10′,CH3-11’),3.20(2H,m,H-7′),3.22(2H,m,H-13),5.29(1H,m,H-14),5.29(1H,m,H-8′),6.55(1H,s,H-6),6.83(1H,d,J=10.0Hz,H-9),6.87(1H,d,J=9.7Hz,H-5′),7.43(1H,d,H-8),7.43(1H,s,H-12),7.67(1H,s,H-2′),7.60(1H,d,J=9.7Hz,H-6′)。13C NMR(150MHz,CDCl3)δ:168.6(s,C-2),162.0(s,C-4),156.5(s,C-4′),154.6(s,C-10),140.4(s,C-5),132.3(s,C-15),132.1(d,C-12),131.7(s,C-9′),129.7(d,C-2′),129.0(d,C-8),128.5(s,C-3′),127.6(s,C-11),126.3(d,C-6′),124.4(s,C-1′),123.3(d,C-14),122.8(d,C-8′),121.2(s,C-7),115.9(d,C-5′),115.1(d,C-9),108.1(d,C-6),100.5(s,C-3),28.6(t,C-7′),28.3(t,C-13),26.0(q,C-10′),26.0(q,C-16),18.9(q,C-17),18.9(q,C-11′)。
化合物3:黄色油状物,ESI-MS(positive):m/z425.1[M+H]+,m/z 447.3[M+Na]+。1H NMR(600 MHz,CDCl3)δ:1.65(3H,s,H-16),1.70(3H,s,H-17),3.14(2H,d,J=7.3Hz,H-13),3.52(2H,dd,H-6),3.78(3H,s,H-8′),5.10(1H,m,H-14),6.53(1H,dd,J=8.0,1.8Hz,H-9),6.51(1H,d,J=1.8Hz,H-12),6.60(1H,d,J=8.0 Hz,H-8),6.91(1H,d,J=8.8Hz,H-3′),6.91(1H,d,J=8.8Hz,H-5′),7.63(1H,d,J=8.8 Hz,H-2′),7.63(1H,d,J=8.8Hz,H-6′)。13C NMR(150MHz,CDCl3)δ:169.7(s,C-7′),169.5(s,C-2),156.5(s,C-4′),153.2(s,C-10),137.1(s,C-3),134.5(s,C-15),131.9(d,C-12),129.6(d,C-6′),129.6(d,C-2′),129.2(d,C-8),128.3(s,C-1′),126.2(s,C-7),124.6(s,C-11),122.3(s,C-4),121.4(d,C-14),116.0(d,C-3′),116.0(d,C-5′),115.2(d,C-9),86.0(s,C-5),53.7(q,C-8′),38.6(t,C-6),29.2(t,C-13),25.7(q,C-17),17.7(q,C-16)。
化合物4:淡黄色油状物,ESI-MS(positive):m/z 155.1[M+H]+,1HNMR(600MHz,DMSO-d6):δ 6.72(1H,dq,J=6.9,16.0Hz),6.36(1H,d,J=16.0Hz),6.01(1H,s),5.82(1H,s,OH),5.70(1H,s,OH),4.50(1H,brs),3.89(1H,brs),1.80(3H,d,J=6.9Hz)。13C NMR(150MHz,DMSO-d6)δ:203.6(s,C-1),168.4(s,C-3),139.3(d,C-6),125.5(d,C-2),124.7(d,C-7),80.7(d,C-5),76.3(d,C-4),19.1(q,C-8)。
化合物5:淡黄色油状物,ESI-MS(positive):m/z 153.2[M+H]+,1HNMR(600MHz,CDCl3)δ:7.10(1H,dd,J=9.6,9.6Hz),6.73(1H,d,J=9.6Hz),6.70(1H,d,J=9.6Hz),4.80(2H,s,OH),2.53(2H,m,CH2),1.54(2H,m,CH2),0.93(3H,t,J=6.9Hz)。
2.7 化合物抗肿瘤活性
采用MTT法初步评价了化合物1-5对人体慢性髓性白血病细胞K562、人肺腺癌A549细胞和人宫颈癌Hela细胞的细胞毒活性(表2)。结果表明,在浓度为50μmol/L时,化合物4和5对K562、A549及Hela细胞都具有中等强度的活性。
3 结语
本文从红树林植物内生真菌W-8的发酵产物中分离鉴定了5个化合物,包括3个α,β-不饱和丁内酯类化合物(1-3),1个环戊酮类化合物(4),1个苯的衍生物(5)。文献[15-16]报道这类丁内酯类化合物主要来源于土曲霉次级代谢产物,且具有5-脂氧合酶抑制剂、依赖细胞周期素激酶的选择性抑制剂、自由基清除剂、抗菌等多种活性,已经引起了许多合成工作者的兴趣[17]。但是本文在评价单体化合物的抗肿瘤活性中,化合物1-3并未表现出对A-549、K-562和Hela细胞株的活性,而化合物4、5均具有中等强度的细胞毒活性,为该菌的主要抗肿瘤活性成分。
[1] Schulz B,Boyle C.What are endophytes?[M].∥Sieber,T.N.Eds.,Microbial Root Endophytes.vol 1.Berlin;Springer-Verlag,2006:13.
[2] Strobel G,Daisy B,Castillo U,Harper J.Natural products from endophytic microorganisms[J].J Nat Prod,2004,67(2):257-268.
[3] Schulz B,Boyle C,Draeger S,et al.Endophytic fungi:a source of novel biologically active secondary metabolites[J].Mycol.Res.,2002,106:996-1004.
[4] Esser,K.Endophytic fungi,occurrence and metabolites[M].∥Anke T,Weber D Eds.The Mycota:A comprehensive treatise on fungi as experimental systems for basic and applied research.Berlin;Springer-Verlag,2009:154-195.
[5] Freeman S,Rodriguez R J.Genetic conversion of a fungal plant pathogen to a nonpathogenic,endophytic mutualist[J].Science,1993,260:75-78.
[6] Saikkonen K,Faeth S H,Helander M,et al.Fungal endophytes:a continuum of interactions with host plants[J].Annu.Rev.Ecol.Syst.,1998,29:319-343.
[7] Stierle A,Strobel G A,Stierle D.Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of Pacific Yew[J].Science,1993,260:214-216.
[8] 韩维冻,高秀梅,卢昌义,等.雷州半岛的红树林植物组成与群落生态[J].广西植物,2003,02:007.
[9] 林贞健.真菌次级代谢产物的化学多样性开发及生物活性研究[D].青岛:中国海洋大学,2006.
[10] Mossman T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assay[J].J Immunol Meth,1983,65(1-2):55.
[11] Bernier D,Br ckner R.Novel synthesis of naturally occurring pulvinones:a Heck coupling,transesterification,and dieckmann condensation strategy[J].Synthesis,2007,15:2249-2272.
[12] Kim B G,Kim J P,Kim W G,et al.Butyrolactone free-radical scavengers from Aspergillus sp.F80161[P].Korean,KR 2002045053,2002-06-19.
[13] Ghisalberti E L,Narbey M J,Rowland C Y.Metabolites of Aspergillus terreus Antagonistic towards the take-all fungus[J].J Nat Prod,1990,53:520-522.
[14] Gaudin J,Nikolaenko O,de Saint Laumer J,et al.Structure-Activity relationship in the domain of odorants having marine notes[J].Helv Chim Acta,2007,90:1245-1265.
[15] Begley,Michael J,Gedge,et al.Aspulvinones,a new class of natual products from Aspergillus terreus.Reinvestigation of structures by x-ray crystallographic and spectroscopic analysis[J].JCS Perkin 1,1979,(1):77-83.
[16] Ojima,Nobutoshi,Takenaka,et al.Structures of pulvinone derivatives from Aspergillus terreus[J].Phytochemistry(Elsevier),1975,14(2),573-576.
[17] Bernier,David,Bruckner,et al.Novel synthesis of naturally occurring pulvinones:a Heck coupling,transesterification,and dieckmann condensation strategy[J].Synthesis,2007,(15):2249-2272
Antitumor Components from an Endophytic Fungus Aspergillus terreus(W-8).Associated with Acanthus ilicifolius Linn.
SUN Shi-Wei,LIN Zhen-Jian,ZHU Tian-Jiao,LI De-Hai,GU Qian-Qun*
(Key Laboratory of Marine Drugs,Chinese Ministry of Education,School of Medicine and Pharmacy,Ocean University of China,Qingdao 266003,China)
Fourteen active strains isolated from the leaves or branches of mangrove plants were screened using P388cell line(mouse leukemia cell line).Five compounds from fungus W-8were isolated by solvent extraction,bioassay-guided fractionation,silica gel column chromatography,and preparative HPLC.By means of physicochemical properties and spectral analysis,they were identified as aspulvinone H1(1),aspulvinone H(2),butyrolactone I(3),terrein(4),and 3-propylbenzene-1,2-diol(5),respectively.The NMR data of compound 1were first reported here.Compounds 4 and 5 showed mediate cytotoxicities against A549,K562,and Hela cell lines.
mangrove plants;endophytic fungi;secondary metabolites;antitumor activity;Acanthus ilicifolius Linn.
R927
A
1672-5174(2011)05Ⅱ-349-07
国家自然科学基金项目(30973627);国家海洋局海洋公益性科研专项(2010418022-3);山东省自然科学重点基金(ZR2009CZ016);教育部高等学校博士学科点专项科研基金(20100132120026)资助。
2011-03-28;
2011-04-13
孙世伟(1986-),男,硕士生。E-mail:sunshiwei_1986@163.com
**通讯作者:E-mail:guqianq@ouc.edu.cn
责任编辑 徐 环
