药用植物虎杖和盾叶薯蓣的组织培养
2011-01-07曾汉元黄小波许方美
曾汉元, 黄小波, 许方美
(怀化学院生命科学系,湖南怀化 418008)
中药材虎杖为蓼科多年生草本植物虎杖(Reynoutria japonica)的茎和根,被历版《中华人民共和国药典》收载.性味苦寒,具有祛风利湿,祛痰止咳,清热解毒,活血化瘀等功效.研究表明,虎杖中所含的白藜芦醇是其有效成分之一[1],具有强心扩血管、抑制血小板聚集、降血脂、镇咳平喘、抗菌、抗病毒、抗肿瘤等多种作用[2],是治疗颅内出血、糖尿病、组织癌变和抑制肿瘤发生最有前途的药物之一[3-5].此外,虎杖嫩茎可以食用,可作为绿色食品来开发.
盾叶薯蓣(Dioscorea zingiberensi)为薯蓣科草质缠绕藤本植物,是一种常用的中草药,根茎可治疗各种急性化脓性感染、软组织损伤,并有抗肿痛和降血糖的作用,对治疗冠心病和脑血管病有特效[6].其根茎含薯蓣皂苷元,是合成甾体激素类药物的主要原料.近年来的研究表明,对薯蓣皂苷元甾体环的每一次化学修饰,都能产生一种疗效奇特的甾体药物.目前,以薯蓣皂素为原料已合成了300多种激素药物,展示了薯蓣皂素广阔的医药前景[6].
在虎杖和盾叶薯蓣的组织培养研究方面已有一些报道[7-9],但他们报道的培养基配方中应用的细胞分裂素为激动素 (KT).考虑到KT的价格高且耐热性较差,因此,我们改用价廉且相对耐热的6-BA对这两种药材进行了组培研究.
1 材料与方法
1.1 材料
实验材料虎杖采自怀化市贺家田乡,种植于怀化学院生物园内;盾叶薯蓣采自中方县盾叶薯蓣良种繁育基地,室内盆栽.
1.2 外植体最佳消毒时间的确定
取虎杖和盾叶薯蓣的嫩芽,流水冲洗干净;用0.1%升汞溶液作消毒剂,各设计三组不同的消毒时间,分别消毒5 min、10 min和15 min,用无菌水冲洗4~5次,在超净工作台内接种在MS基本培养基中,然后放在人工气候箱中进行培养,一周后观察,根据灭菌结果确定适宜灭菌时间.每种灭菌时间处理的材料接种6瓶.
1.3 培养基的设计
以MS为基本培养基,附加不同浓度的2,4-D和6-BA(单位:mg/L,下同),各培养基均添加30 g/L蔗糖、8 g/L琼脂,pH5.8.培养基中激素配比见表2~4,外植体全部采用前面筛选出的适宜灭菌时间进行灭菌.每种配方接种6瓶.
1.4 培养
接种后,放在人工气候箱中进行培养,培养条件为:温度20~25℃,湿度70%~80%,诱导愈伤组织时不开灯光;对愈伤组织进行分化培养时,光照强度为20μmol/m2.s,光照时间为12 h/d.
2 结果
2.1 不同灭菌时间处理的结果
采用0.1%升汞的三种不同灭菌时间分别对虎杖和盾叶薯蓣进行灭菌处理的实验结果 (表1).由表1可知,虎杖和盾叶薯蓣嫩芽的适宜灭菌时间为10 min.

表1 不同灭菌时间处理的结果
2.2 不同浓度激素配比对虎杖愈伤组织的诱导结果
采用不同浓度的生长素和细胞分裂素配比对虎杖愈伤组织的诱导结果,如表2.

表2 不同浓度激素配比对虎杖愈伤组织的诱导结果
由表2可知,在以上6组配方中,以第2组2,4-D 0.2+6-BA 1.0效果最好.
2.3 不同浓度激素配比对盾叶薯蓣愈伤组织的诱导结果
采用不同浓度的生长素和细胞分裂素配比对盾叶薯蓣愈伤组织的诱导结果,如表3.
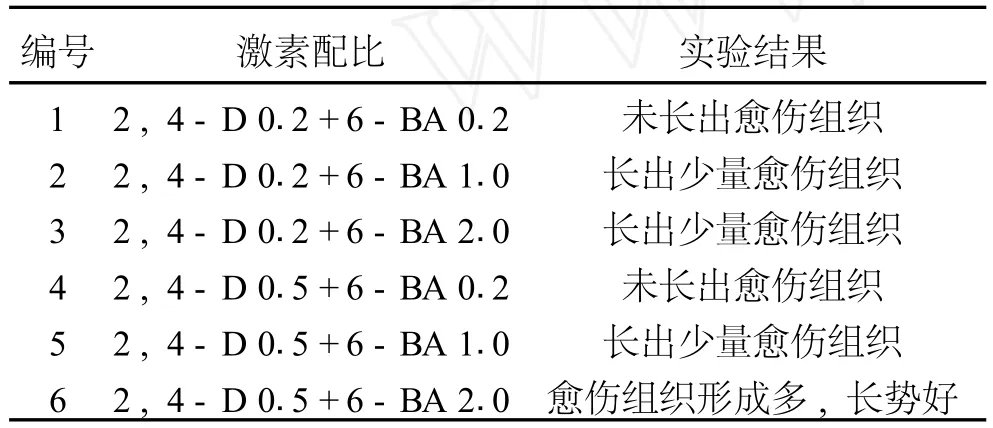
表3 不同浓度激素配比对盾叶薯蓣愈伤组织的诱导结果
由表3可知,在以上6组配方中,以第6组2,4-D 0.5+6-BA 2.0效果最好.
2.4 盾叶薯蓣愈伤组织的分化培养结果
采用不同浓度的生长素和细胞分裂素配比对盾叶薯蓣愈伤组织进行分化培养的结果,如表4.

表4 盾叶薯蓣愈伤组织的分化培养结果
由表4可知,培养出的愈伤组织转接到MS+2,4-D 0.5+6-BA 0.1或者MS+2,4-D 0.2+6-BA 0.1的培养基中都能分化出芽,但是后者长势弱.考虑到细弱的苗在移栽时难以成活,因此,分化培养时以采用前者为宜.
2.5 盾叶薯蓣的生根培养
当盾叶薯蓣的丛生芽长到5~7 cm时,将其分割成单株,然后转入培养基MS+2,4-D 0.5中培养,20 d后,生根率达80%以上.
2.6 移栽
当根长到5 cm以上且根数达到5条以上时进行炼苗和移栽.先将培养瓶瓶口半开5 d,然后将瓶口全部打开,6 d后取出组培苗,用清水洗净根系附着的培养基,移栽到经高压灭菌的腐殖土中,用无菌水一次浇透,放在人工气候箱中培养,温度为22~25℃,湿度为70%~85%.6 d后,幼苗叶片颜色呈绿色;15 d后进行换盆移栽,移栽成活率为70%.
3 讨论
(1)在对一种新的材料进行组织培养时,首先应该研究适宜的灭菌时间.灭菌时间恰到好处,才能达到“既杀灭微生物又保存尽可能多的活组织细胞”的目的.灭菌是否合适的判断方法是:如果接种材料大部分发生污染,说明外植体的消毒时间短或者消毒剂浓度偏低;若接种材料虽然没有污染,但材料已发黄,组织变软,表明消毒时间过长,组织被破坏死亡;接种材料若没有出现污染,且生长正常,即可以认为消毒时间合适.

图1 虎杖愈伤组织

图2 虎杖愈伤组织直接分化出茎和叶

图3 盾叶薯蓣的愈伤组织

图4 盾叶薯蓣的丛生芽
(2)虎杖愈伤组织在弱光照射下,在原培养基中再经过8周培养后直接分化出了茎和叶.可能原因是:在弱光照射下,部分愈伤组织细胞发育出叶绿体,含有叶绿体的细胞合成了一些生长素类物质,从而促进了茎和叶的形成.
(3)Skoog和Miller等提出:在组织培养中,生长素和细胞分裂素的比例决定根和芽的分化:脱分化时生长素低,细胞分裂素高;再分化时生长素高,细胞分裂素低.这一理论对于指导培养基配方的设计、减少实验工作量具有一定的指导意义.
[1]李易非,李多伟,许慧,等.酶解法提取虎杖中白藜芦醇的工艺研究 [J].中成药,2009,31(9):1449-1451.
[2]潘明新,王晓阳.虎杖的化学成分及其药理作用 [J].中草药,2000,23(1):35-40.
[3]刘铭,刘华,张国平,等.虎杖苷对脑出血性损伤大鼠血清白细胞介素-1β和脑组织Bcl-2蛋白表达的影响[J].中草药,2010,41(12):2010-2013.
[4]于柏艳,孙 抒,杨万山,等.虎杖提取物对人肺癌A549细胞株抑制增殖和诱导凋亡作用的研究 [J].中成药,2010,32(11):1972-1976.
[5]王辉,杨再刚,燕树勋,等.虎杖总蒽醌对糖尿病肾病早期血瘀模型大鼠脂代谢及血液流变性的影响 [J].中国实验方剂学杂志,2010,16(16):156-159.
[6]李祥,马建中,史云东.盾叶薯蓣、薯蓣皂素研究进展及展望 [J].林产化学与工业,2010,30(2):107-112.
[7]王宇.虎杖的组织培养及高效无性系的建立 [J].江西农业学报,2009,21(3):73-76.
[8]李琼,李静,姜玲,等.盾叶薯蓣愈伤组织的诱导及芽分化与增殖 [J].贵州农业科学,2010,38(7):15-17.
[9]彭晓英,周朴华,张良波,等.盾叶薯蓣类原球茎的离体诱导及快繁体系的建立 [J].植物遗传资源学报,2010,11(5):629-634.
