神经生长因子、被动运动对失神经大鼠股骨生物力学性能的影响
2011-01-06王建民
王建民
(许昌学院体育学院,河南 许昌 461000)
神经生长因子、被动运动对失神经大鼠股骨生物力学性能的影响
王建民
(许昌学院体育学院,河南 许昌 461000)
目的:探讨神经生长因子、被动运动对失神经大鼠股骨生物力学性能的影响。方法:去除坐骨神经和股神经造大鼠股骨废用性骨质疏松模型,将大鼠随机分为假手术组(SHAM组)、去神经对照组(DN组)、神经生长因子组(NGF组)、被动运动组(PM组)、神经生长因子+被动运动组(NGF+PM)组,观察各组大鼠股骨生物力学指标的变化。结果:NGF+PM组股骨最大载荷、结构刚度、破断载荷、最大应变、弹性模量、极限强度与DN组相比差异均具高度显著性(P<0.01);而与SHAM组相比差异不具显著性(P>0.05),NGF组结构刚度、弹性模量、极限强度低于SHAM组 (P<0.05),最大载荷指标明显低于SHAM组(P<0.01);PM组最大载荷低于SHAM组(P<0.05),其余指标差异不显著。结论:大鼠股骨失神经支配后骨生物力学性能下降,神经生长因子和被动运动均可减缓失神经大鼠股骨生物力学性能的改变,两种方法合用能更有效防治大鼠失神经所致的废用性骨质疏松。
神经生长因子;被动运动;废用性骨质疏松;生物力学性能
神经性疾病所致瘫痪如脊髓损伤后的截瘫或下肢瘫、由于中风导致的偏瘫或轻偏瘫以及严重神经创伤受损后长期卧床,因失神经支配所致的废用性骨质疏松发生率较高,表现为局部肢体失去神经支配和运动能力,目前尚无特效疗法。开展防治失神经所致废用性骨质疏松的研究,有助于减少并发症,如病理性骨折、肾结石、关节周围软组织骨化、肢体畸形等[1]。本实验采用大鼠失神经方法形成废用性骨质疏松的动物模型,大鼠骨失神经支配后,主要表现为失神经支配和失运动能力两个方面,本研究采用外源性神经生长因子和被动运动干预,通过检测大鼠骨生物力学性能的变化,探讨其对大鼠失神经所致废用性骨质疏松的防治作用。
1 研究对象与方法
1.1 实验对象
实验动物(购于河南大学实验动物中心)为3月龄健康雄性SD大鼠50只,体重 265.80±14.65 g,清洁级,在动物房中适应性喂养一周。标准啮齿类动物饲料喂养,自由饮食。
1.2 研究方法
(1)实验材料。
注射用鼠神经生长因子冻干粉(NGF,规格:20μg/支,每支含4500AU),武汉海特生物制药股份有限公司生产。骨钙素试剂盒(BGP)和抗酒石酸酸性磷酸酶试剂盒(TRACP)购自南京建成生物工程研究所。
(2)实验分组。
将50只健康SD大鼠随机分成A、B两组,A组10只为假手术组(SHAM组),B组40只为造模组,造模组大鼠行神经切除术。造模成功后,将B组40只大鼠随机分成4组:去神经对照组(DN组);神经生长因子组(NGF组);被动运动组(PM组);神经生长因子加被动运动组(NGF+PM组)。每组10只,各组内依次编号并用不同颜色记号笔区分。
(3)造模方法。
大鼠腹腔注射3%戊巴比妥钠(25mg/kg)溶液麻醉,无菌条件下先于俯卧位行右后肢股外侧切口,于股骨粗隆水平切断坐骨神经,切除坐骨神经5-6mm,用生理盐水冲洗并缝合切口;再置大鼠于仰卧位,正中纵切口,于腹股韧带水平切断大鼠右侧股神经,切除股神经5-6mm并生理盐水冲洗、缝合切口,缝合后切口消毒。A组进行同法操作,但不切断神经。术后均给予庆大霉素切口外涂。
(4)治疗方法。
治疗于神经切除术后第4天进行,NGF组和NGF+PM组于手术侧腓肠肌处按每公斤体重2个活性单位注射NGF,每天上午注射1次。其余组注射生理盐水,各组大鼠隔日称体重一次,并按体重变化给药。PM组和NGF+PM组于注射30分钟后进行被动运动。实验时间为30天。
(5)被动运动方法[2]。
将大鼠置于自制的网夹内,拉出右后肢,抓住趾部,与脊柱呈45°向后外方牵拉,直至右后肢完全伸直(膝关节、踝关节均伸直),然后再与牵拉方向相反,将右后肢推向身体,使之完全屈曲紧贴身体(膝关节完全屈曲,踝关节完全背屈),这样往复运动为1次,每天被动运动训练300次。
(6)取材。
实验30天后,各组在安静状态下称重。所有动物均以股动脉放血处死,每组大鼠剥取右侧股骨,剔除软组织,用浸透生理盐水的纱布包好,-20℃冰箱保存备用。
(7)股骨生物力学测试。
将股骨置于Instron万能材料试验机(美国Instron Co生产,型号:4302)上作三点弯曲实验,加载速度为2mm/min,跨距为24mm,记录其载荷-变形曲线和应力-应变曲线获得。
(8)数据处理。
2 实验结果
2.1 大鼠一般情况
手术后前两天各组大鼠体重下降,进食减少,三天后各组大鼠体重开始增长,但DN组大鼠增长与其它组相比生长速度延缓,毛色光泽下降,有稀疏了蓬松感,活动力下降,神情倦怠。其他各去神经组手术后也有类似状况,但随着对其实施各种干预手段,毛色有所改善,活力增加,被动运动效果表现最好,大鼠体征与SHAM组类似,身体增长也较快。手术10天左右极个别大鼠出现自食现象,发现后剔出这些异常大鼠。各组大鼠实验期间生长发育情况基本正常。
2.2 股骨生物力学性能的比较
(1)股骨结构力学参数的比较
见表2,在股骨最大载荷方面,DN和NGF组与SHAM组相比差异均具高度显著性(P<0.01),PM组与SHAM差异具显著性(P<0.05),NGF+PM组与SHAM组差异不具有显著性(P>0.05);SHAM、PM和NGF+PM与DN组间差异均具高度显著性(P<0.01),NGF组与DN组间差异具显著性(P<0.05)。
在股骨断裂载荷方面,与SHAM组相比DN组与之的差异具高度显著性(P<0.01),其他组与之无显著性差异(P>0.05)。与DN组相比,SHAM、PM和NGF+PM与DN组间差异均具高度显著性(P<0.01)NGF组与DN组差异不具显著性(P>0.05),但NGF组断裂载荷明显增加。
在股骨结构刚度方面,与SHAM相比,DN组与之的差异具高度显著性(P<0.01),NGF组与之差异具显著性(P<0.05),PM、NGF+PM组与之的差异无统计学意义(P>0.05);SHAM、PM、NGF+PM与 DN组的差异具高度显著性(P<0.01),NGF组与DN组差异具显著性(P<0.05)。
在能量吸收方面,除SHAM组和DN组间有显著性 差异(P<0.05)外,各组之间均无显著性差异(P>0.05)。
表2 各组股骨结构力学参数的比较(±SD)

表2 各组股骨结构力学参数的比较(±SD)
注:与 SHAM组相比,▲:P<0.05,▲▲:P<0.01;与 DN 组相比,■:P<0.05,■■:P<0.01
组别 最大载荷(N) 断裂载荷(N) 结构刚度(N·mm-1) 能量吸收(N·mm)SHAM 87.29 ±7.15■■ 54.88 ±10.34■■ 127.19 ±12.08■■ 63.54 ±4.08■61.03 ±4.15 DN 73.52 ±2.87▲▲ 40.42 ±6.50▲▲ 103.26 ±8.43▲▲ 54.40 ±7.57▲NGF 78.40 ±4.50▲▲■ 45.76 ±8.26■ 115.87 ±12.53▲■ 57.98 ±3.92 PM 81.33 ±3.42▲■■ 52.54 ±11.71■■ 119.27 ±6.81■■ 59.25 ±5.64 NGF+PM 85.51 ±2.77■■ 54.26 ±12.21■■ 123.45 ±12.15■■
(2)股骨材料力学参数的比较
由表3可以看出,在极限强度方面,DN组与SHAM组之间的差异具高度显著性(P<0.01),NGF组与之差异具显著性(P<0.05),其他两组与之差异无统计学意义(P>0.05);SHAM和 NGF+PM组与DN组比较差异具高度显著性(P<0.01),PM组与之差异具显著性(P<0.05),NGF组与之差异不显著(P>0.05)。
在最大应变方面,DN组与 SHAM组之间的差异具高度显著性(P<0.01),其他各组与之比较差异不具统计学意义(P>0.05);SHAM组、PM组和 NGF+PM组与DN组的差异均具有高度显著性(P<0.01),NGF组与之差异则具显著性(P<0.05)。
在弹性模量方面,DN组与 SHAM组之间的差异具高度显著性(P<0.01),其他各组与之差异不显著(P>0.05);SHAM组、NGF组、PM组和 NGF+PM组与DN组比较差一均具高度显著性。
表3 各组股骨材料力学的比较(±SD)
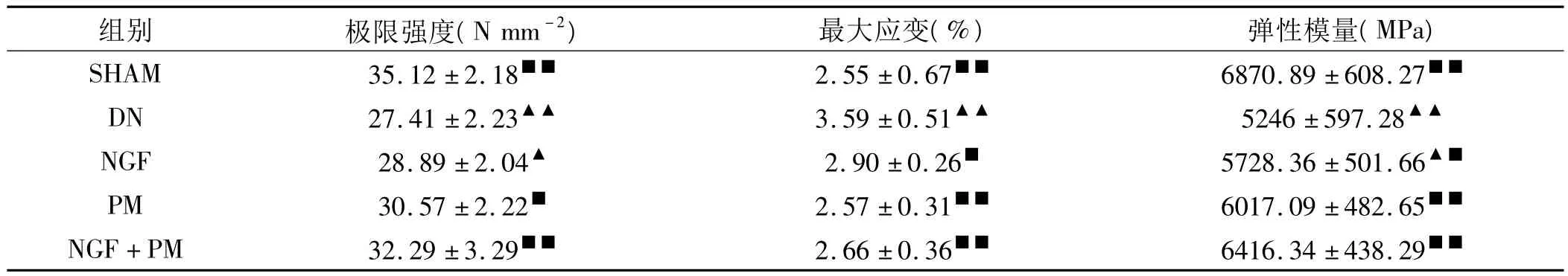
表3 各组股骨材料力学的比较(±SD)
注:与 SHAM组相比,▲:P<0.05,▲▲:P<0.01;与 DN 组相比,■:P<0.05,■■:P<0.01
组别 极限强度(N mm-2) 最大应变(%) 弹性模量(MPa)SHAM 35.12 ±2.18■■ 2.55 ±0.67■■ 6870.89 ±608.27■■DN 27.41 ±2.23▲▲ 3.59 ±0.51▲▲ 5246 ±597.28▲▲NGF 28.89 ±2.04▲ 2.90 ±0.26■ 5728.36 ±501.66▲■PM 30.57 ±2.22■ 2.57 ±0.31■■ 6017.09 ±482.65■■NGF+PM 32.29 ±3.29■■ 2.66 ±0.36■■ 6416.34 ±438.29■■
3 讨论
周围神经损伤后,成骨细胞活性受到抑制,破骨作用加强,导致骨量减少和骨强度下降。
戴寿荣等[3]研究证明大鼠失神经支配后骨结构强度明显下降。予以神经生长因子治疗后,大鼠的骨小梁平均宽度、体积密度、连接点数均较失神经组有明显增加,证明神经生长因子治疗能明显改善失神经后骨结构的改变,减少骨量的丢失。
本研究表明,大鼠股骨失去神经支配后,骨生物力学性能明显下降。说明神经生长因子对去神经骨代谢具有重要的调节作用,可以预防去神经所致骨质疏松的的发生,其机制尚不清楚。
但一些研究[4]证实NGF对骨生成具有促进作用,内源性和外源性NGF可与成骨细胞LNGFR结合,使成骨能力增强。夏胜利等[5,6]研究表明人重组骨形态形成蛋白(rhBMP)可以诱导 NGF及其高亲和受体(TrkA)的表达,表明 NGF间接或者直接通过 BMP路径在最初骨的形成中发挥重要作用。NGF还可抑制骨吸收,通过抑制破骨细胞分泌酸性物质和基质金属蛋白酶减少骨钙吸收和骨胶原的降解作用,保持骨的机械性能和生物功能[7]。另外,神经生长因子具有控制神经元的存活,促进神经元的分化作用,通过修复神经来达到治疗效果,NGF可引导神经长入骨痂,可促进P物质、降钙素基因相关肽(CGRP)的释放调节骨代谢[8]及促进骨组织对 1、25-(OH)2D3 提取过程[9],并能通过增加交感神经的支配间接增加血管的生成,从而促进骨化等,本实验也证实大鼠失神经支配后体重减少,失神经肌肉严重萎缩,而NGF可以延缓肌肉萎缩,维持肌肉对骨骼的应力作用,抑制骨吸收,有利于成骨。
运动对于骨骼的生长、再建和骨量的维持是一种机械刺激,较低或者完全丧失这种刺激对骨的作用,将诱导加速破骨细胞介导的骨吸收,并抑制成骨细胞介导的骨形成,从而导致骨丢失[10,11]。被动运动在临床上是肢体关节康复的重要方法。被动运动能避免因固定所致的肌肉萎缩和废用性骨质疏松等。本实验表明,被动运动能够抑制去神经大鼠骨生物力学性能的下降,延缓废用性骨质疏松的发展。可能机理为被动运动使失神经骨骼重新获得应力刺激,增加骨内血流量,使成骨细胞活性升高,刺激骨形成,减少骨矿物质的损失,另外本实验被动运动组大鼠肌肉萎缩不明显,说明被动运动可以通过延缓肌肉的萎缩而间接对骨骼产生良性作用。
本实验采用大鼠失神经方法形成废用性骨质疏松的动物模型,大鼠骨失神经支配后,主要表现为失神经和失应力刺激两个方面,针对性采用神经生长因子加被动运动同时进行治疗,结果显示两种干预方法同时应用骨生物力学指标优于 PM组和 NGF组,接近SHAM组水平,延缓废用性骨质疏松的发展效果显著。可以初步推断,神经生长因子疗法和被动运动在调节骨代谢方面,两者通过各自的作用途径,既相互协同,又相互补充。NGF组和PM组大鼠体重均没有出现明显下降,肌肉萎缩不明显,所以两者在修复神经、延缓肌肉萎缩等方面作用是一致的,另外两者相互联系,被动运动可以促进内源性神经生长因子的释放[12],神经生长因子通过调节骨系细胞的活性,提高对应力刺激的感受性等等。虽从骨代谢指标来看,联合疗法优于单纯一种干预方式,但目前对神经生长因子和被动运动方法预防废用性骨质疏松机制的研究尚不全面,还有待进一步研究。
4 结论
(1)大鼠失神经支配后,骨生物力学性能下降明显,神经生长因子和被动运动均能有效抑制这种变化,延缓去神经所致大鼠废用性骨质疏松的发生。
(2)神经生长因子加被动运动组防治大鼠废用性骨质疏松表现出更好的效果,具有协同作用。
[1]刘忠厚.骨质疏松学[M].北京:科学出版社,1998:500.
[2]李长宏,吴倩.被动运动和电刺激对尾吊大鼠比目鱼肌肌纤维的影响[J].中华物理医学与康复杂志.2004,26(3):133-136.
[3]戴寿荣,高润.神经生长因子对失神经支配大鼠骨小梁形态计量的影响[J].中国康复医学杂志,2003,8(8):479-480.
[4]于立明,张伟,吴亚东.神经生长因子受体(TrkA)在下颌骨骨折愈合中的表达及意义的研究[J].中国实验诊断杂志,2006,10(7):768 -771.
[5]夏胜利,戴魁戎.神经生长因子在骨再生中的作用[J].国外医学-骨科学分册,2005,26(1):54-57.
[6]夏胜利,戴魁戎,神经营养因子家族及其受体在重组人骨形态发生蛋白-2诱导成骨中的表达[J].中国矫形外科杂志,2006,14(7):535 -538.
[7]郭世绂.骨质疏松基础与临床[M].天津:天津科学技术出版社,2001.
[8]姚建华等.神经生长因子对骨折愈合影响的研究进展[J].中国矫形外科杂志,2000,7(10):996 -998.
[9]王子明,杨恒文,李芳,等.神经生长因子对大鼠坐骨神经半切损伤后的作用观察[J].第三军医大学学报,2000,2(22):42-48.
[10]唐学阳,刘利君,郑虎.废用性骨质疏松幼龄大鼠骨维生素D受体表达的研究[J].四川大学学报(医学版),2010,41(1):106-110.
[11]陈佑学,李国平.骨钙素及运动对其水平的影响[J].中国运动医学杂志,2000,19(2):188.
[12]李红卫,江钟立,沈振海,等.运动训练对糖尿病大鼠骨骼肌神经营养因子-3水平的影响[J].中华物理医学与康复杂志,2010,32(4):241 -244.
Effect of Exogenous Nerve Growth Factor and Passive Movement on Femoral Biomechanics of Denervated Rats
Wang Jian-Ming
(Sports Department,Xuchang University,Xuchang,Henan 461000)
Objective:to investigate the effect of exogenous nerve growth factor(NGF)and passive action on the biomechanics of denervated rats with disuse osteoporosis.Methods:rats were randomly divided into five groups(Sham group,DN group,NGF group,PMgroup and NGF+PMgroup).Results:compared with sham group,the biomechanical indices were in the denervation group(P< 0.01).The maximum load and modulus of elasticity in the combination group were both decreased(P < 0.05).In the PM+NGF Group,the maximum load,structure stiffness and modulus of elasticity were all reduced(P < 0.05).Conclusion:after the denervation,the muscular stress has been lost and femoral mechanical property decrease,nerve repair and regeneration will benefit to prevent or delay the appearance of osteoporosis.
exogenous nerve growth factor,passive movement,osteoporosis,muscular stress
G804.2
A
1001-9154(2011)06-0067-04
G804.2
A
1001-9154(2011)06-0067-04
王建民(1969—),男,硕士,副教授;主要研究方向:高校体育教学与训练。
2011-04-28
