紫外线-乙醇联合使用对克洛诺菌属的协同杀菌效果
2011-01-04傅松哲高建新陈海婴张悦刘缨倪贤生
傅松哲,高建新,陈海婴,张悦,刘缨,倪贤生
(1.南昌市疾病预防控制中心,南昌 330038;2.中国科学院微生物研究所,北京 100101)
紫外线-乙醇联合使用对克洛诺菌属的协同杀菌效果
傅松哲1,高建新1,陈海婴1,张悦1,刘缨2,倪贤生1
(1.南昌市疾病预防控制中心,南昌 330038;2.中国科学院微生物研究所,北京 100101)
为探讨紫外线-乙醇联合使用是否对克洛诺菌属产生协同消毒效果,对0.1%稀释复原婴儿配方奶粉分别用乙醇,氢氧化钠和紫外线对克洛诺菌属NC830的杀菌效果进行了调查。结果表明,体积分数为50%和25%的乙醇处理仅引起3.65和4.05 mL-1的杀灭效果,而使用体积分数为75%的乙醇,阪崎克洛诺菌的水平下降5.46 mL-1(对数值)。质量分数为1.0%,2.5%,5.0%的氢氧化钠杀灭效果分别达到4.84,5.44和6.46mL-1(对数值)。 紫外线分别作用克洛诺菌属10,20,30 min,杀灭效果分别达到1.14,2.03和2.89 mL-1(对数值)。 经过30 min的处理,紫外线、乙醇和两者联合使用对阪崎克洛诺菌杀灭值分别为2.81,3.85和5.07 mL-1(对数值),紫外线-乙醇联合使用对阪崎克洛诺菌产生协同消毒效果。
克洛诺菌属;婴儿配方乳粉;紫外线;协同效果
0 引 言
克洛诺菌属导致新生儿出现脑膜炎和败血病等症状,致死率可高达50%[1]。2008年,阪崎肠杆菌正式从肠杆菌属中划出[2],并命名为克洛诺菌属(Cronobacter)。一项由7个国家参与的国际调查显示高达12%婴儿奶粉中均检出克洛诺菌属[3]。克洛诺菌属在食品加工厂及食品中均被分离出[4]。
Hein等人发现,克洛诺菌属广泛分布在乳粉生产区和非生产区[5]。重复利用的肠内喂养管和回用袋增加了微生物感染的危险[6]。克洛诺菌属能够在不锈钢等多种载体上形成生物膜[7]。传统的消毒措施并不能完全达到效果[8]。
乙醇和紫外线联合使用对金黄色葡萄球菌等常见致病菌有明显杀菌效果[9],然而Jo等人并没有观察到其具有协同杀菌的效果[10]。在本文中,我们将探索联合使用乙醇和紫外线对材料表面克洛诺菌属的杀灭效果。
1 材料与方法
1.1 材料
(1)菌种:坂崎克洛诺菌标准株ATCC29544(Cronobacter sakazakii); 菌株NC830(Genbank登录号GU727683)。
(2)培养基:缓冲蛋白胨水,LB,TSB,TSA培养基和微量生化管。结晶紫中性红胆盐葡萄糖琼脂(VRBGA), 显色培养基 (Xa-GicA、DFI)。Dey-Engley(DE)中和剂肉汤。咖啡(1+2型),全脂牛奶和低脂肪牛奶,脱脂牛奶,婴幼儿配方奶粉。
(3)其他材料:紫外灯(型号ZW40S23W),紫外线波长为253.7 nm,1m辐射照度实测为98 μw/cm2;24孔板及96孔板。
1.2 方法
1.2.1 悬液定量灭菌试验
克洛诺菌属悬液定量灭菌试验参考Kim等人的方法[8]。将标准株ATCC29544和菌株NC830采用24 h新鲜斜面培养物,用磷酸盐缓冲液(PBS)洗下菌苔并进行稀释制备成所需浓度试验菌悬液。将婴幼儿配方奶粉用灭菌蒸馏水溶解,配制成0.1%的浓度,1×105Pa灭菌30 min,将菌悬液0.2%婴幼儿配方奶以等体积混合(终浓度为0.1%)。准备24孔板,加入2 mL消毒液(阳性对照为PBS)于20℃水浴中恒温,然后在每孔加入菌液0.5 mL立即混匀;作用至规定时间,取出2 mL加到含2 mL两倍浓度的Dey-Engley(DE)中和剂肉汤试管内,混匀;中和作用10 min。取样液1 mL采用0.1%蛋白胨水进行梯度稀释,取0.5 mL作倾注平板,36℃培养48 h,进行活菌计数,计算灭菌率。试验重复3次。
1.2.2 生物膜检测
利用生物膜内物质对结晶紫的结合,通过结晶紫染色的办法对生物膜进行定量,参考Wakimoto等人的方法[11]。将已形成稳定生物膜的96孔板用蒸馏水冲洗3次,洗去菌悬液,用福尔马林固定5 min,结晶紫染色15 min,再用蒸馏水冲洗3次。放置干燥后用400 μL体积分数为95%乙醇脱色30 min,所得有色溶液稀释至1 mL用分光光度计测595 nm处吸光值。
1.2.3 紫外线杀灭效果试验
将上述准备的24孔板中加入菌液0.5 mL,放入紫外灯正下方1 m处,加入体积分数75%乙醇或灭菌蒸馏水0.5 mL,作用至规定时间,取出采用0.1%蛋白胨水进行梯度稀释,取0.5 mL加入平板,TSA培养基倾注,36℃培养48 h,进行活菌计数,计算灭菌率。试验重复3次。
1.2.4 数据处理
实验数据统计处理采用SPSS11.5软件进行。
2 结 果
2.1 不同培养基对克洛诺菌生物膜生长影响
图1为不同培养基对克洛诺菌属ATCC29544和NC830生物膜形成能力的影响。由图1可以看出,对于不同培养基,坂崎克洛诺菌生物膜生长量整体次序为:低脂牛奶和全脂牛奶>重组婴幼儿配方奶粉>脱脂牛奶>咖啡>LB培养液 >果汁>0.1%蛋白胨水>酸奶。非常值得注意的是所有克洛诺菌属生长在重组婴儿配方奶粉和全脂牛奶中均好于传统的LB和TSB培养液,表明各种配方奶粉都为克洛诺菌属的生长提供了更好的条件,被污染后食品安全风险极高。而pH值低的酸奶风险较低。因此,生产设备中残留的微量牛奶都可以为克洛诺菌属的生长提供良好的培养基,并在设备表面形成不易去除的生物膜,进而污染下一批的产品。
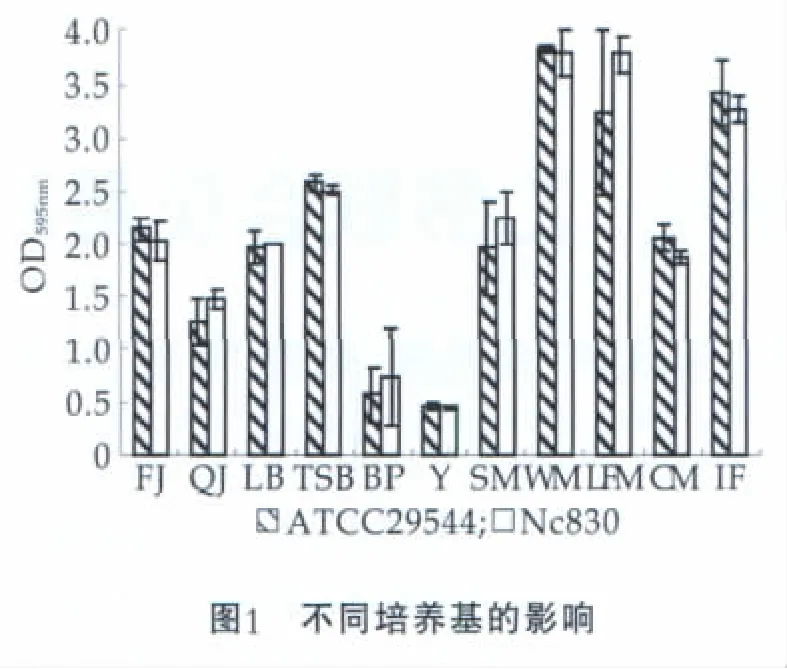
图1中,横坐标FJ为果汁;OJ为橙汁;BP为缓冲蛋白胨水;Y为酸奶;SM为脱脂牛奶;WM为全脂牛奶;LFM为低脂肪牛奶;CM为咖啡混合;IF为婴儿配方奶粉。

表1 紫外线照射对标准菌株和野生株的影响
2.2 紫外线、NaOH和乙醇对菌悬液的杀灭效果
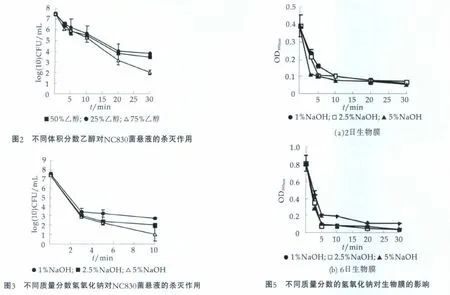
结果表明,采用1 m辐射照度为110 μw/cm2的紫外线分别作用ATCC29544菌株10,20,30 min,照射剂量分别为555,1110和1665 mW·min/cm2。杀灭效果分别达到1.14、2.03和2.89mL-1(对数值)。对于菌株NC830紫外线的杀灭效果也非常接近。由于紫外线对标准菌株和菌株NC830几乎没有差别,因此为更加了解乳粉加工环境中消毒剂的杀灭效果,以下均采用野生菌株NC830进行试验。体积分数50%和25%的乙醇处理仅引起3.65和4.05mL-1(对数值)的杀灭效果,而使用体积分数为75%的乙醇,阪崎克洛诺菌的水平下降了5.46 mL-1(对数值)。氢氧化钠的杀灭效果好于乙醇(P<0.05), 质量分数分别为1.0%,2.5%,5.0%的氢氧化钠杀灭效果分别达到4.84,5.44和6.46 mL-1(对数值)。经过10 min的处理,质量分数为5%的氢氧化钠效果最强。但与质量分数为1%和2.5%的氢氧化钠相比,效果并不显著(P>0.05)。
2.3 NaOH和乙醇对生物膜的杀灭效果
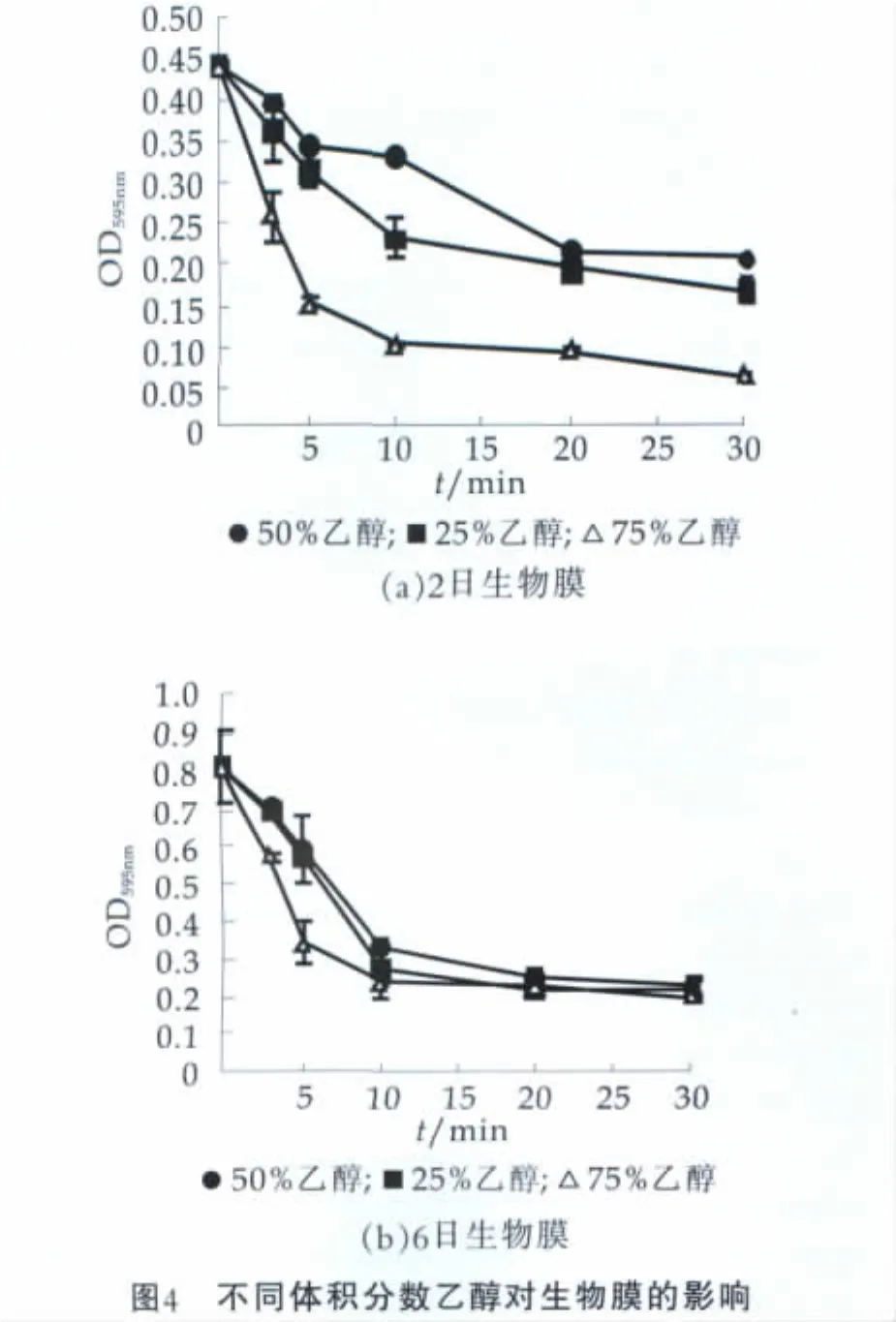
NaOH和乙醇对克洛诺菌2 d和6 d生物膜的杀灭效果如图4和图5所示(结果以OD595值平均值及其标准偏差来表示)。分别将克洛诺菌接种至24孔板内,培养至规定时间弃去菌悬液,分别加入终体积分数为25%,50%和75%的乙醇和质量分数1%,2.5%和5%的氢氧化钠。采用OD595值表征消毒剂对生物膜的破坏作用。经过30 min的处理,乙醇分别使克洛诺菌2 d和6 d生物膜OD595值下降0.38和0.64,显著高于体积分数25%和50%乙醇的处理效果。质量分数1%,2.5%和5%的氢氧化钠均使克洛诺菌2 d和6 d生物膜OD595值显著下降(P<0.05)。经过10min的处理,3种质量分数的氢氧化钠均使克洛诺菌2 d和6 d生物膜OD595值下降约0.3,经过30 min的处理,质量分数为5%的氢氧化钠效果最强,分别使2天和6天生物膜OD595值下降0.336和0.812。但与1%和2.5%的氢氧化钠相比,效果并不显著。值得注意的是体积分数为75%的乙醇和质量分数为1%,2.5%和5%的氢氧化钠对克洛诺菌生物膜的破坏作用并没有显著差异(P>0.05)。
2.4 乙醇和紫外线联合使用对克洛诺菌的杀灭效果
乙醇、紫外线和两者联合使用的杀灭效果如图6所示。经过30 min的处理,3种方法对阪崎克洛诺菌杀灭值分别为2.81,3.85和5.07mL-1(对数值)。 乙醇和紫外线联合使用作用10,20和30 min,均高于单独使用的效果。

3 讨 论
利用紫外线对农产品及环境进行消毒已经有很多应用实例[12]。在各波长紫外线中,只有短波紫外线UVC具有杀菌消毒作用,具有广谱高效、不存在抗药性、无二次污染等优点。然而紫外线的穿透力较差,尘粒、湿度和有机物的含量等均会对其穿透性造成影响。空气中含尘粒多,杀菌效能就会降低;相对湿度增高,杀菌效能也会降低。同样,紫外线在液体中的穿透力,可随着液体深度的增加而降低,水中杂质如溶解的盐类、糖类与各种有机物均可降低紫外线的穿透力,阻挡紫外线的透过,从而影响其杀菌作用。乙醇作为常见的中效消毒剂具有成本低、适合表面消毒、对金属材料腐蚀性低、无二次污染等优点。然而乙醇对常见病原菌的杀灭效果非常有限[9],仅靠乙醇难以实现对生产设备表面及环境有效消毒。NaOH作为强效消毒剂,在乳粉加工厂中也经常使用。然而由于其对金属材料有很强腐蚀性[13],限制了其应用范围。Jo等人[10]分别采用体积分数为70%乙醇或2,160 mW·s/cm2的UV连续处理后,均不再检测出阪崎克洛诺菌,同时并没有观察到其具有协同杀菌的效果。然而,由于其采用0.1%蛋白胨水作为菌悬液,并不能真实地反映实际消毒程序的效果。Jo等人分别采用30%,40%和50%乙醇使阪崎克洛诺菌分别下降约1.73,3.02和4.17 mL-1(对数值),去除率高于本文的试验结果。其原因可能就在于婴幼儿配方奶有机物质量分数高于0.1%蛋白胨水,减弱了其消毒效果。乙醇和紫外线联合使用对阪崎克洛诺菌产生了更好的消毒效果。推测原因可能是由于乙醇使克洛诺菌细胞壁受到破坏,同时紫外线的照射促使克洛诺菌的DNA嘧啶形成一个双键,从而进一步抑制细胞生长。
阪崎肠杆菌在乳粉加工设施中可能的污染途径和来源是目前研究的热点。对重组婴幼儿配方奶粉的生产包括配料,均质,杀菌处理,喷雾干燥和包装等过程。人们普遍认为Cronobacter的污染属于在巴氏杀菌处理后的二次污染,包括干燥和包装等过程。Mullane等人在乳粉加工厂的所有空气过滤器中均分离发现克洛诺菌属。Craven等人的研究表明,克洛诺菌属广泛分布在乳粉生产区和非生产区[14]。5家工厂中2%的环境样品中分离出克洛诺菌属,更多的克洛诺菌属分离在非加工区(49%),高于加工区(29%)。经过脉冲场凝胶电泳分析,129株克洛诺菌属划分为49组。7株在乳粉和同一个工厂的非加工区环境均分离到,包括蒸发室,员工的鞋和外部屋顶。Hein等人[5]对奶粉加工生产线进行采样,在6个不同的采样点均分离出新生儿病原体克洛诺菌属。这些研究都表明克洛诺菌属的污染主要来自于外部环境中,乳粉生产过程中防止克洛诺菌属污染存在三个关键性控制点,即:控制频繁的人流物流的污染,送风空气的处理和消毒程序的强化。
Fu等人[15]的研究进一步证实了克洛诺菌属的二次污染发生在干燥和灌装阶段这一假说,并强调了对设备表面的适当清洗的重要性。该研究模拟婴儿配方奶粉生产过程等几种亚致死实验。接种克洛诺菌属在三个潜在污染的切入点,包括加入添加剂,喷雾干燥和灌装。结果表明,在巴氏消毒后,没有克洛诺菌属的检出。然而,在喷雾干燥过程后,发现了克洛诺菌属。乳粉生产设备中在长期运行过程中,材料表面会产生微小的裂隙,存在某些死角。生产设备中残存的牛奶会为克洛诺菌属提供良好的培养基,使其迅速生长,带来严重的食品安全隐患。因此阻止克洛诺菌生物膜的形成对于杜绝该病原菌的污染十分关键。
Hein和Fu等人[5,15]在对加热后的在线清洗系统(CIP)和模拟在线清洗后的不锈钢材料进行检测,研究也表明经过标准化的在线清洗后,克洛诺菌属仍可检出,表明这些在线清洗的卫生措施无法彻底消除加工生产线中的克洛诺菌属。因此,本文建议在乳粉加工厂的贮存粉仓、喷雾干燥室和包装室安装紫外灯,并在消毒程序中采用,以便强化对材料表面和空气的消毒处理,防止克洛诺菌属生物膜的形成。每一批次生产结束后,对生产设备材料表面采取紫外线-乙醇联合处理,将有助于减少这些病原体的传播。
[1]IVERSEN C,FORSYTHE S J.Risk Pro?le of Enterobacter sakazakii,an Emergent Pathogen Associated with Infant Milk Formula[J].Trends of Food Science Technology,2003,14:443–454.
[2]IVERSEN C,MULLANE N,MCCARDELL B,et al.Cronobacter gen.nov.,a New Genus to Accommodate the Biogroups of Enterobacter sakazakii,and Proposal of Cronobacter sakazakii gen.nov.,comb.nov.,Cronobacter malonaticus sp.nov.,Cronobacter turicensis sp.nov.,Cronobacter muytjensii sp.nov.,Cronobacter dublinensis sp.nov.,Cronobacter genomospecies 1,and of three subspecies,Cronobacter dublinensis subsp.dublinensis subsp.nov.,Cronobacter dublinensis subsp.lausannensis subsp.nov.and Cronobacter dublinensis subsp.lactaridi subsp.nov.[J].Int J of Syst Evol Microbiol,2008,58:1442-1447.
[3]CHAP J,JACKSONA P,SIQUEIRAB R,et al.International Survey of Cronobacter sakazakii and Other Cronobacter spp.in Follow up Formulas and Infant Foods.[J].International Journal of Food Microbiology,2009,136:185-188.
[4]KANDHAI M C,REIJ M W,GORRIS L G.,et al.Occurrence of Enterobacter sakazakii in Food Production Environments and Households[J].Lancet,2004,363:39–40.
[5]HEIN I,GADZOV B,SCHODER D,et al.Temporal and Spatial Distribution of Cronobacter Isolates in a Milk Powder Processing Plant Determined by Pulsed-Field Gel Electrophoresis[J].Foodborne Pathogen Disease,2009,6:225-233.
[6]KIM H,RYU J H,BEUCHAT L R.Attachment of and Bio?lm Formation by Enterobacter sakazakii on Stainless Steel and Enteral Feeding Tubes[J].Applied and Environmental Microbiology,2006,72:5846–5856.
[7]BREEUWER P,LARDEAU A,PETERZ M.et al.Desiccation and Heat Tolerance of Cronobacter[J].Journal of Applied Microbiology,2003,95:967-973.
[8]KIM H,RYU J H,BEUCHAT L R.Effectiveness of Disinfectants in Killing Enterobacter sakazakii in Suspension,Dried on the Surface of Stainless Steel,and in a Bioflm[J].Applied and Environmental Microbiology,2007,72:5846–5856.
[9]HA J H,HA S D.Synergistic Effects of Ethanol and UV Radiation to Reduce Levels of Selected Foodborne Pathogenic Bacteria[J].Journal of Food Protection,2010,73(3):556-561.
[10]JO S H,BAEK S B,HA J H,et al.Maturation and Survival of Cronobacter Biofilms on Silicone,Polycarbonate,and Stainless Steel after UV Light and Ethanol Immersion Treatments[J].Journal of Food Protection,2010,73(5):952-956.
[11]WAKIMOTO N,NISHI J,SHEIKH J,et al.Quantitative Biofilm Assay Using a Microtiter Plate to Screen for Enteroaggregative Escherichia coli.[J].American Journal of Tropical Medicine Hygiene,2004,71:687–690.
[12]BIALKA K,DEMIRCI A.Efficacy of Pulsed UV-Light for the Decontamination of Escherichia coli O157:H7 and Salmonella spp.on Raspberries and Strawberries[J].Journal of Food Science,2008,73:?201–207
[13]王红旺,夏向东.天然碱苛化烧碱液对不锈钢及镍材的腐蚀作用.[J].内蒙古工学院学报,1993,12(2):12-17.
[14]CRAVEN H M,MCAULEY C M,DUFFY L L,et al.Distribution,Prevalence and Persistence of Cronobacter(Enterobacter sakazakii)in the Nonprocessing and Processing Environments of Five Milk Powder Factories[J].Journal of Applied Microbiology,2010,109(3):1044-1052.
[15]FU S Z,GAO J X,LIU Y,et al.Isolation of Cronobacter spp.(Formerly Enterobacter sakazakii)Isolates from Infant Formulas and Their Survival in the Production Process of Infant Formula[J].Czech Journal of Food Science,2011(in press).
Synergistic effects of ethanol and UV radiation to reduce levels of Cronobacter
FU Song-zhe1,GAO Jian-xin1,CHEN Hai-ying1,ZHANG Yue1,LIU Ying2,NI Xian-sheng1
(1.Nanchang Center for Disease Control and Prevention,Nanchang 330038,China;2.Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China)
To investigate whether combined treatments would produce synergistic disinfection effects on food products during food processing compared with single treatments,Cronobacter sakazakii cells in suspensions and biofilms formed on polycarbonate in diluted reconstituted powdered infant milk formula were treated with ethanol,NaOH and UV light as antibacterial treatments.The bactericidal effects of a commercial chemical disinfectant(ethanol)and of UV radiation on C.sakazakii NC830 in vitro were investigated.Treatment with 25%and 50%ethanol cause a decrease in the level of 3.65 and 4.05 log CFU per ml,but treatment with 75%ethanol reduced the levels to approximately 5.46 log CFU per ml,respectively.Various exposure doses of UV radiation with a UV lamp,reduced the levels to approximately 1.14,2.03 and 2.89 log CFU per ml.The synergistic effect of ethanol or UV treatment alone values for C.sakazakii were 2.81,3.85 and 5.07 log CFU/ml,respectively.A synergistic effect of combining ethanol and UV treatments against foodborne pathogens in vitro was observed.
Cronobacter;Powder Infant Formula(PIF);UV;synergistic effects
Q93-33
A
1001-2230(2011)09-0017-04
2011-06-20
傅松哲(1985-),男,硕士,主要从事食品微生物学研究。
