重组凝乳酶原在大肠杆菌中的表达及活性研究
2011-01-04李新苹刘欢欢普燕张富春李轶杰
李新苹,刘欢欢,普燕,张富春,李轶杰
(新疆大学 生命科学与技术学院,乌鲁木齐 830046)
重组凝乳酶原在大肠杆菌中的表达及活性研究
李新苹,刘欢欢,普燕,张富春,李轶杰
(新疆大学 生命科学与技术学院,乌鲁木齐 830046)
为了提高干酪生产中起重要凝乳作用的凝乳酶的原核表达效率,分析了Genbank中牛、羊和骆驼凝乳酶原(prochymosin,pCHY)的保守序列及大肠杆菌密码子的偏爱性,合成了凝乳酶原序列,并将其克隆至大肠杆菌原核表达载体上。经IPTG的诱导得到高效表达的凝乳酶原;Western blotting检测证明了其具有免疫原性;经pH值2到6活化后成功自剪切,得到大小约36 ku的有凝乳活性的凝乳酶。研究获得较高表达水平具有凝乳活性的重组凝乳酶。
凝乳酶原;密码子优化;凝乳活性
0 引 言
凝乳酶以凝乳酶原(prochymosin,pCHY)的形式分泌,在酸性条件下自剪切成有活性的凝乳酶[1],其传统来源是乳牛的皱胃,不但适于制造各种类型的干酪,还是衡量其它凝乳酶代用品的标准。我国凝乳酶生产还没产业化[2],其性质及代用品的研究对我国干酪产业的发展有重要的意义。基因工程菌可高效表达凝乳酶,国内外许多学者应用多种表达系统对其进行了研究,如曲霉[3], 毕赤酵母[4,5],乳酸克鲁维酵母[6],乳酸乳球菌[7],大肠杆菌[8,9]等。基因工程菌用于工业化生产其首要前提是凝乳酶原基因有较高的表达效率,所以本研究根据牛、羊和骆驼的凝乳酶原保守序列及大肠杆菌密码子的偏爱性合成了凝乳酶原基因,实现了其在大肠杆菌的高效表达,为凝乳酶的工业化生产奠定基础。
1 材料和方法
1.1 材料
1.1.1 质粒和菌株
质粒pGEX-4T-1,菌种E.coli DH5α和E.coli BL21(DE3)。
1.1.2 试剂和仪器
限制性内切酶,T4连接酶,DNA聚合酶,质粒提取试剂盒,胶回收试剂盒,羊抗兔IgG-HRP抗体,天然凝乳酶,其余均为分析纯试剂。
1.2 大肠杆菌表达载体的构建与鉴定
根据http://www.kazusa.or.in/codon对E.coli编码氨基酸的密码子使用频率的分析,综合几种凝乳酶原基因,对其进行密码子优化后,送至上海生工公司合成相应的基因序列。将PCR扩增并回收的pCHY基因用EcoR I和Xho I双酶切后,回收酶切产物连到同样酶切回收的pGEX-4T-1载体上,转化E.coli DH5α筛选重组质粒的转化子并提取重组质粒,再进行PCR及酶切鉴定。选择酶切正确且PCR鉴定为阳性的重组质粒送上海生工公司进行序列测定。测序正确的重组质粒用于构建E.coli BL21(DE3)pGEX-4T-1-pchy工程菌。
1.3 重组凝乳酶原基因在E.coli BL21(DE3)中的诱导表达
挑取pCHY+的单个菌落,接种于新鲜LB培养基(含Amp+50 mg/L)中,37℃培养过夜。次日,按1%的接菌量接至新鲜LB培养基(含Amp+50 mg/L)中。当0D600达到0.6~0.8时,在其中加入浓度为0.08 mmol/L的IPTG,在37℃下进行诱导表达。收集诱导后E.coli BL21(DE3)的菌体,PBS洗涤后进行全细胞蛋白SDSPAGE电泳,观察蛋白表达情况。
1.4 pCHY蛋白的提取[10]
将得到的菌体沉淀洗涤后,用浓度为8 mol/L的尿素[11]溶解,复性后,加入GSH/GSSG透析。
1.5 重组牛凝乳酶原的Western blotting[12]
将表达的融合蛋白GST-pCHY经SDS-PAGE分离后,电转至硝酸纤维素膜上,以3%BSA封闭过夜,依次与核酸疫苗制备的兔抗pCHY抗血清、山羊抗兔IgG-HRP分别室温反应1 h,PBST洗涤3次后,加入DAB显色并拍照。
1.6 重组牛凝乳酶原的活化和凝乳活性
将GST-pCHY蛋白溶液的pH用2mM HCl调整至2.0,室温下放置2 h,然后用1M Tris缓冲液(pH8.0)将蛋白溶液的pH回调至6.0,SDS-PAGE分析凝乳酶原的活化情况。
按照孙大庆等[7]的方法,在一个96孔板中,每孔100 μL的检测混合液包括10%的脱脂乳粉、Ca2+、pH值为6.0的磷酸盐缓冲液和活化后的凝乳酶,35℃ 孵育30 min。96孔板倒置于吸水纸上,除去未凝固的上清。与天然凝乳酶比较,计算重组凝乳酶的凝乳活性[13]。
2 结 果
2.1 表达载体pGEX-4T-1-pchy的鉴定
表达载体pGEX-4T-1-pchy经EcoRI和Xho I酶切和PCR鉴定(如图1),均得到约1.1 kb的片段,与理论值大小相符。取鉴定阳性的克隆进行了测序,测序结果与合成的对应序列完全一致,表明表达载体pGEX-4T-1-pchy构建成功。

2.2 重组菌株的诱导表达
将构建成功的E.coli BL21(DE3)/pGEX-4T-1-pchy的转化子在新鲜LB培养基中培养,经IPTG诱导收集转化菌,如图2所示。离心后取上清和沉淀分别留样。菌体沉淀用PBS洗涤,并用细胞裂解液处理后进行超声,直至菌体不再粘稠,离心后分别取上清和沉淀进行SDS-PAGE。 结果表明,在E.coli BL21(DE3)中构建的工程菌表达了带有GST标签的约67 ku大小的外源蛋白,与理论大小一致,且以包涵体的形式存在,表达量较高,初步表明对pCHY基因密码子的优化是成功的。
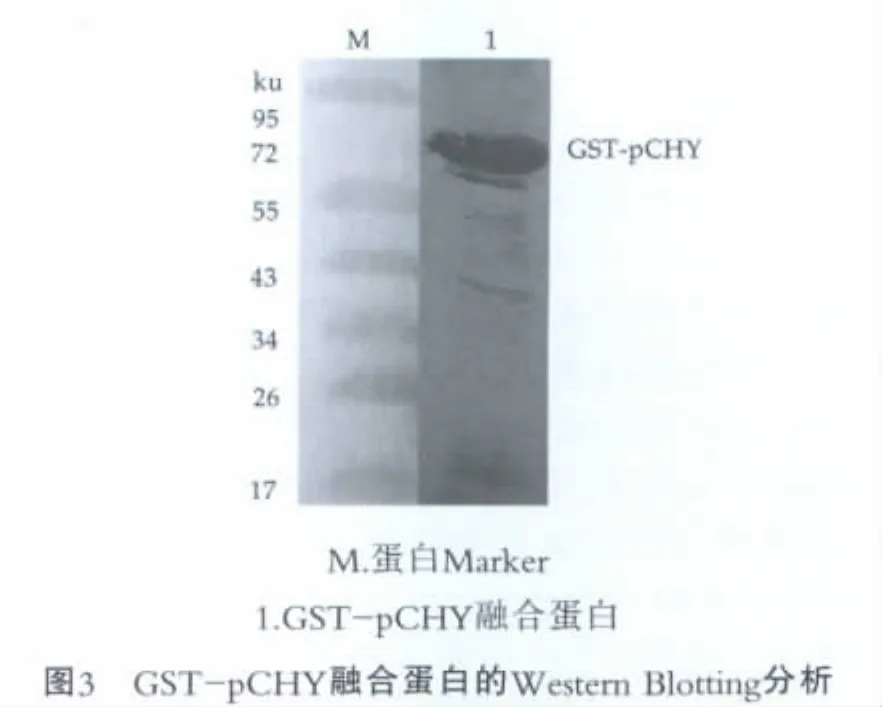
2.3 重组牛凝乳酶原的Westernblotting检测
对包涵体溶解并透析后的GST-pCHY蛋白进行Western blotting检测(如图3所示),在67 ku处出现了一条比较特异的条带,表明GST-pCHY包涵体蛋白经变性复性后具有免疫原性,即初步表明GST-pCHY蛋白复性后恢复了其免疫活性。
2.4 重组牛凝乳酶原活化和凝乳活性分析
将GST-pCHY蛋白溶液酸化后恢复其pH值至6.0,分别取pH恢复前和恢复后留样,进行SDS-PAGE电泳检测。由图4可以看出,与复性后的蛋白相比,经酸化处理后,67 ku处的条带消失,在约36 ku处出现了特征性条带,初步表明对凝乳酶原的活化成功。

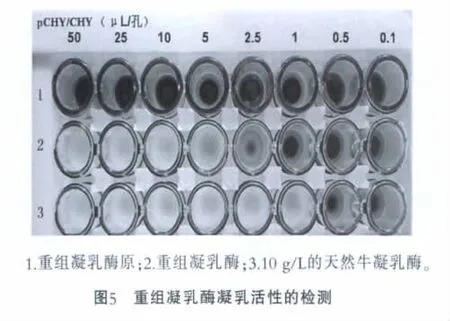
将凝乳酶原活化后,选择测定凝乳活力的脱脂乳最佳浓度[14],加入96孔板中,进行凝乳活性检测,结果如图5所示。由图5可以看出,质量浓度为10 g/L的天然凝乳酶的凝乳活力为133.3个Soxhlet单位(SU),重组凝乳酶可达26.7个SU,相当于每mL含有2 mg天然凝乳酶。
3 讨 论
大肠杆菌作为宿主,表达的包涵体蛋白产量高,易于分离,可用于工业化生产。E.coli对编码同一种氨基酸的各种密码子的使用具有偏爱性,使用其常用的密码子,可以提高重组蛋白的表达水平[15]。袁伟,冯镇[16,17]等采用了乳酸克鲁维酵母中高度或中度使用频率的密码子对牛凝乳酶原基因进行了密码子优化,使难以在乳酸克鲁维酵母中高效表达的基因得到表达。MENZELLA H.G.[18]表明,对大肠杆菌中基因序列进行密码子优化时,密码子随机选择比一个氨基酸对应一个密码子表达的凝乳酶的产量高。本研究利用该系统,优化了凝乳酶原基因的密码子,表达了具有生物活性的凝乳酶原,活化后凝乳效果显著。
本研究不但分析了大肠杆菌中密码子的使用频率,同时还综合了牛、羊、骆驼这些主要动物来源的凝乳酶原的基因序列,以期在干酪生产中产生更好的凝乳效果及风味。牛凝乳酶具有较高的凝乳活性和较低的蛋白水解活性,是优先选用的凝乳酶。但牛凝乳酶不能使生驼乳凝固,研究表明骆驼凝乳酶的凝乳活性比牛凝乳酶高70%,非特异性的蛋白水解活力只相当于牛凝乳酶的20%,耐热性更好[19]。而山羊凝乳酶比牛凝乳酶更耐热且更稳定[20],已有研究者完成了对其的克隆[21],重组羔羊凝乳酶制造的奶酪与重组牛凝乳酶有相似品质[22]。对本研究得到的凝乳酶进行凝乳实验后发现,它可以使生驼乳凝固。
凝乳酶原除了可用于制作干酪外,有研究者也关注于凝乳酶原的自剪切作用,将其与标签蛋白基因构建在一起,通过自剪切作用切除标签蛋白,得到单纯的靶蛋白,拓展了凝乳酶原的应用范围[23]。本文利用凝乳酶原的这一优势来切割标签蛋白,得到有活性的凝乳酶,从而简化蛋白纯化的程序。同时,在纯化凝乳酶方面我们也通过超滤等技术进一步的探索,以期得到纯度高的凝乳酶。
本研究在大肠杆菌系统中通过优化密码子,得到了高效表达的凝乳酶原,可以为我国大规模生产凝乳酶提供优良的菌株,使我国拥有自主产权的凝乳酶,从而摆脱依赖进口的现状,具有良好的应用前景。
[1]MOHANTY A K,MUKHOPADHYAY U K,GROVER S,et al.Bovine Chymosin:Production by rDNA Technology and Application in Cheese Manufacture[J].Biotechnology Advances,1999,17(2-3):205–217.
[2]朱仁俊,石振兴,甘伯中,等.凝乳酶的研究进展[J].中国乳品工业,2010,38(1):39-42.
[3]STEFAN R K,HANS J M,HENRIK R N,et al.Characterization of Recombinant Camel Chymosin Reveals Superior Properties for the Coagulation of Bovine and Camel Milk[J].Biochemical and Biophysical Research Communications,2006,342(2):647–654.
[4]JUAN A V,JOSE M A,MARGARITA P,et al.Cloning and Expression of Buffalo Active Chymosinin Pichia Pastoris[J].Agric.Food Chem,2008,56(22):10606–10610.
[5]张莉,姜媛媛,张健,等.牛凝乳酶基因在毕赤酵母中的重组表达[J].生物工程学报,2009,25(8):1160-1165.
[6]冯镇,张兰威.小牛凝乳酶原基因在乳酸克鲁维酵母中的表达及遗传稳定性研究[J].食品科学,2008,29(7):297-302.
[7]孙大庆,秦兰霞,姚丽燕,等.牛凝乳酶原基因在乳酸乳球菌中的表达[J].微生物学报,2010,50(5):628-633.
[8]王景会,姜媛媛,李启云,等.牛凝乳酶基因的克隆与表达[J].中国乳品工业,2008,36(10):8-12.
[9]张莉,蒋媛媛,张健,等.牛凝乳酶全长cDNA的克隆及其原核表达载体的构建[J].食品与生物技术学报,2010,29(2):271-275.
[10]王焱冰,李轶杰,张富春.草原兔尾鼠卵透明带3融合蛋白抗原的制备及免疫反应性[J].中国生物制品学杂志,2007,20(4):244-251.
[11]WEI C J,TANG B,ZHANG Y Y,et al.Oxidative Refolding of Recombinant Prochymosin[J].Biochem,1999,340(Pt 1):345–351.
[12]SAMBROOK J,RUSSELL D W.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[13]ARIMA K,YU J,IWASAKI S.Milk-Clotting Enzyme from Mucor Pusillus var.Lindt Perlman GE,Lorand L[J].Methods in Enzymology:New York and London:Academic Press,1970,19:446–459.
[14]李玉秋,王景会,李铁柱,等.重组牛凝乳酶的纯化及其酶学性质的研究[J].食品与发酵工业,2010,36(8):50-54.
[15]李轶杰,张富春,张钰,等.优化密码子提高草原兔尾鼠ZP3融合蛋白的原核表达[J].细胞与免疫学杂志,2005,21(6):700-703.
[16]袁伟,柯涛,杜敏华,等.牛凝乳酶原基因的合成及其在乳酸克鲁维酵母中的表达[J].生物工程学报,2010,26(9):1281-1286.
[17]FENG Z,ZHANG L W,HAN X,et al.Codon Optimization of the Calf Prochymosin Gene and Its Expression in Kluyveromyces Lactis[J].World J Microbiol Biotechnol,2010,26(5):895–901.
[18]MENZELL H G.Comparison of Two Codon Optimization Strategies to Enhance Recombinant Protein Production in Escherichia Coli[J].Microbial Cell Factories,2011,10(15):1-8.
[19]KAPPELER S R K,HANS J M.Characterization of Recombinant Camel Chymosin Reveals Superior Properties for the Coagulation of Bovine and Camel Milk[J].Biochemical and Biophysical Research Communications,2006,342(2):647–654.
[20]ASHWANI K,JITENDER S,ASHOK K M,et al.Purification and Characterization of Milk Clotting Enzyme from Goat(Capra Hircus)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2006,145(1):108113.
[21]王学清,杨宝进,罗军,等.西农萨能羊凝乳酶原前体cDNA的克隆与序列分析[J].畜牧与兽医,2007,39(10):26-29.
[22]I.ROGELJ,B.PERKO,A.FRANCKY,et al.Recombi nant Lamb Chymosin as an Alternative Coagulating Enzyme in Cheese Production[J].American Dairy Science Association,2001,84(5):1020–1026.
[23]SUNE F L J,KASPER L,LISE-LOTTE B N,et al.Recombinant Chymosin Used for Exact and Complete Removal of a Prochymosin Derived Fusion Tag Releasing Intact Native Target Protein[J].Protein Science,2009,18(5):1023-1032.
Expression of recombinant prochymosin in E.coli and research on its activity
LI Xin-ping,LIU Huan-huan,PU Yan,ZHANG Fu-chun,LI Yi-jie
(College of Life Science and Technology,Xinjiang University,Urumqi 830046,China)
Chymosin plays an important role in clotting milk when manufacturing cheese.Aim to improve the expression of recombinant chymosin,we analyzed the conserve sequence of buffalo,lamb,camel in Genbank and the optimal codons of E.coli,synthesized the sequence of prochymosin.The gene encoding prochymosin has been cloned and hyperexpressed in E.coli BL21(DE3)after IPTG induction.Western blotting indicates the prochymosin protein has antigenicity.SDS-PAGE shows it could autocatalytically clip at acidic pH,and activited chymosin which is about 36 ku shows milk clotting activity.The recombinant chymosin which could make milk clotting has high level expression.
prochymosin;optimal codons;clotting milk
Q789,Q936
A
1001-2230(2011)09-0014-03
2011-07-01
国家自然科学基金资助(30860265);新疆生物资源基因工程重点实验室基金(XJDX0201-2010-2)。
李新苹(1986-),女,硕士,研究方向为生化与分子生物学。
李轶杰
